LSD1对前列腺癌LNCaP细胞的上皮间质转化和侵袭能力的影响
王 敏,刘修恒,陈志远
(武汉大学人民医院泌尿外科,湖北武汉 430060)
前列腺癌(prostate cancer,PCa)是老年男性发病率极高的恶性肿瘤。在我国,PCa的发病率逐年上升,其发病率高居男性恶性肿瘤的第6位,而病死率居男性恶性肿瘤的第9位,在男性泌尿生殖系统肿瘤中其发病率已经超过膀胱癌和肾癌,位居第1[1]。上皮间质转化(epithelial-mesenchymal transition,EMT)导致肿瘤细胞侵袭能力增强,是介导肿瘤转移发生的重要机制[2-3]。在前列腺癌中,EMT参与雄激素信号轴的调控[4],并增加前列腺癌细胞的转移和侵袭能力,参与前列腺癌的转移过程[5]。E-钙黏素(E-cadherin)表达的丢失同N-钙黏素(N-cadherin)和α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)的高表达是EMT的标志。赖氨酸特异性去甲基化酶(lysine-specific demethylase 1,LSD1)是第1个被发现的组蛋白去甲基化酶[6],其与肿瘤发生、发展关系密切,它的表达增加与神经母细胞瘤、肺癌、结直肠癌、膀胱癌等诸多肿瘤相关[7-9]。LSD1同组蛋白去乙酰化酶(histone deacetylase,HDAC)、REST辅助抑制因子(CoREST)和Snail等辅助因子形成功能复合体,能够催化组蛋白H3第4位赖氨酸二甲基和一甲基化(histone H3 dimethyl Lys4,H3K4me1、me2)的去甲基化,抑制E-cadherin基因的转录,从而调节EMT过程[10]。LSD1不仅参与雄激素信号通路的调节,还参与调节EMT过程,因此,我们推测LSD1在前列腺癌细胞中可能通过调节EMT过程,来介导前列腺癌发生、转移和进展。本文初步探讨LSD1与前列腺癌细胞EMT过程之间的关系,试图为临床治疗前列腺癌提供新的思路。
1 材料与方法
1.1 组织标本收集2006年1月至2008年12月在武汉大学人民医院接受前列腺癌根治术的前列腺癌患者标本46例,其中15例为低Gleason评分(4~7分)、31例为高Gleason评分(8~10分)。另收集诊断为良性前列腺增生并接受经尿道前列腺电切术患者的标本25例。
1.2 试剂及抗体前列腺癌LNCaP细胞株购自中国医学科学院基础医学研究所。RPMI1640培养基和胎牛血清购自美国Gibco公司,Trizol 购自美国Invitrogen公司,SYBR Green I PCR试剂盒购自立陶宛Fermentas公司,LSD1小鼠抗人抗体和E-cadherin小鼠抗人抗体购自美国Santacruz公司,N-cadherin兔抗人抗体和α-SMA兔抗人抗体购自美国CST公司,羊抗鼠IgG二抗和羊抗兔IgG二抗购自北京博奥森公司,ECL试剂盒购自美国Millipore公司,转染试剂Lipofectamine 2000购自美国Invitrogen公司。LSD1过表达质粒购自上海吉凯基因化学技术有限公司,LSD1siRNA购自美国Santacruz公司。
1.3 方法
1.3.1免疫组化检测 组织切片用新鲜配制的体积分数为3%的H2O2灭活细胞内源性过氧化物酶,然后用血清封闭,根据测试指标滴加LSD1抗体以及相应生物素化二抗,DAB显色,封片。
1.3.2实验分组 实验分为3组:转染LSDl过表达质粒的LNCaP细胞组 (过表达组)、转染LSD1siRNA的LNCaP细胞组 (干扰组)和正常的LNCaP细胞组(空白对照组)。我们前期预实验已经证实转染过表达质粒空载体和siRNA空载体的LNCaP与正常的LNCaP细胞的各项基因表达无明显差异。
1.3.3细胞培养 培养条件是含10%(体积分数)胎牛血清(fetal bovine serum,FBS)、100 U/mL青霉素和100 μg/mL链霉素的RPMI1640培养基,培养箱条件设置为5%CO2、95%空气(体积分数)、37 ℃,硫酸铜溶液保持培养箱内湿度并灭菌,每3~4 d更换培养液1次。
1.3.4质粒转染和目的基因检测 转染步骤参见Lipofectamine 2000操作说明,转染细胞数为1×105个,转染48 h后收获细胞,用聚合酶链反应技术(polymerase chain reaction,PCR)检测LSDl表达情况:采用Trizol法提取总RNA,紫外分光光度计测定RNA纯度和浓度后,取2 μg进行逆转录,生成cDNA。采用PCR试剂盒定量检测LSDl和内参Actin表达。引物信息如下:LSD-1,F:5-GCCCAAAGAAACTGTGGTGTC-3,R:5-TGTGGCTGGGTAGTTACGGAT-3;Actin,F:5-CACCCAGCACAATGAAGATCAAGAT-3,R:5-CCAGTTTTTAAATC-CTGAGTCAAGC-3。
1.3.5Matrigel迁移和侵袭实验 将无或有包被Matrigel基质胶的Transwell小室放人24孔培养板孔中,上层加入200 μL无血清培养基单细胞悬液(含1 ×103个细胞),下室加入800 μL含10%胎牛血清(体积分数)培养基,常规条件下培养48 h。用湿润的棉签去除小室上层的基质胶和细胞,4%多聚甲醛(质量分数)固定20 min,PBS漂洗3次,0.1%结晶紫(质量分数)染色5 min,PBS漂洗3次。取下Transwell小室置于载玻片上,倒置显微镜下观察,任意选取5个视野(×200)计数,拍照。
1.3.6Western blot分析 提取细胞总蛋白,用BCA法测蛋白含量,分装后于-70 ℃冰箱保存。取上述蛋白 (约40 μg)进行聚丙烯酰胺凝胶电泳[SDS-PAGE,10%分离胶(质量分数)],然后电转移至硝酸纤维素膜上,经封闭、洗脱后分别加入LSDl小鼠抗人抗体(1∶1 000),E-cadherin小鼠抗人抗体(1∶800)、N-cadherin兔抗人抗体(1∶1 000)和α-SMA兔抗人抗体(1∶1 000),4 ℃孵育过夜,洗膜后以相应的二抗室温孵育1 h,并以小鼠抗人β-actin单克隆抗体(1∶2 000)作为上样对照。用ECL,暗室X光胶片曝光。
2 结 果
2.1 LSD1在良性前列腺增生组织和前列腺癌组织中的表达水平我们前期研究发现,LSD1主要在正常前列腺上皮细胞和前列腺癌细胞核表达[11]。一方面,LSD1在前列腺癌组织内高表达,显著高于良性前列腺增生组织;另一方面,其在高Gleason评分的前列腺癌组织中表达显著高于低Gleason评分的前列腺癌组织(图1)。
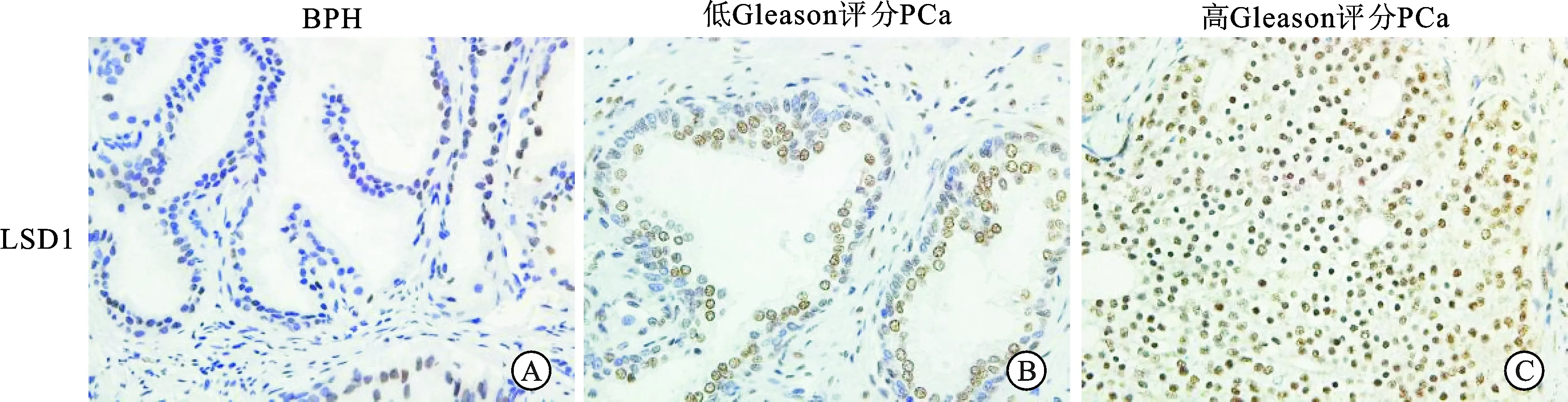
图1 免疫组化检测LSD1在良性前列腺增生组织和前列腺癌组织中的表达水平(×400)
A:良性前列腺增生组织;B:低Gleason评分前列腺癌组织;C:高Gleason评分前列腺癌组织。
2.2 LSDl在各实验组中的表达水平PCR结果显示,过表达组LSDl基因的mRNA相对表达水平显著高于空白对照组,差异具有统计学意义(P=0.002);干扰组LSDl基因的mRNA相对表达水平显著低于空白对照组,差异具有统计学意义(P<0.001)。这说明通过转染LSD1基因质粒可以显著上调LNCaP细胞的LSD1基因表达水平,而转染LSD1siRNA可以显著下调LNCaP细胞的LSD1基因表达水平(图2)。
2.3 LSDl影响LNCaP细胞的迁移和侵袭能力同步化处理过表达组、空白对照组和干扰组LNCaP细胞后,以Transwell小室法检测各组细胞的迁移能力,结果表明过表达组穿过细胞数显著多于空白对照组,差异具有统计学意义(P=0.007),而干扰组穿过细胞数显著少于空白对照组,差异具有统计学意义(P=0.012);同时,以包被Matrigel基质胶的Transwell小室法检测各组细胞的侵袭能力,结果表明过表达组穿过细胞数显著多于空白对照组,差异具有统计学意义(P=0.004),而干扰组穿过细胞数显著少于空白对照组,差异具有统计学意义(P=0.009)。这表明上调LSDl基因表达可以增加前列腺癌细胞的迁移和侵袭能力,而抑制LSDl基因表达能够减弱前列腺癌细胞的迁移和侵袭能力(图3)。
2.4 LSDl促进LNCaP细胞的上皮间质转化Western blot分析结果显示,过表达组LSDl蛋白表达水平显著高于空白对照组,差异具有统计学意义(P=0.000 3);干扰组LSDl蛋白表达水平显著低于空白对照组,差异具有统计学意义(P<0.001)。过表达组细胞N-cadherin(P=0.002)和α-SMA(P=0.006)的表达水平显著高于空白对照组,而E-cadherin(P<0.001)的表达水平显著低于空白对照组,差异均具有统计学意义;同时,干扰组细胞N-cadherin和α-SMA的表达水平显著低于空白对照组(P均<0.001),而E-cadherin的表达水平显著高于空白对照组,差异均具有统计学意义(P<0.001)。这说明上调LSDl基因表达显著增加N-cadherin和α-SMA的表达,并显著降低E-cadherin的表达,从而促进上皮间质转化;而下调LSDl基因表达则能够抑制上皮间质转化(图4)。
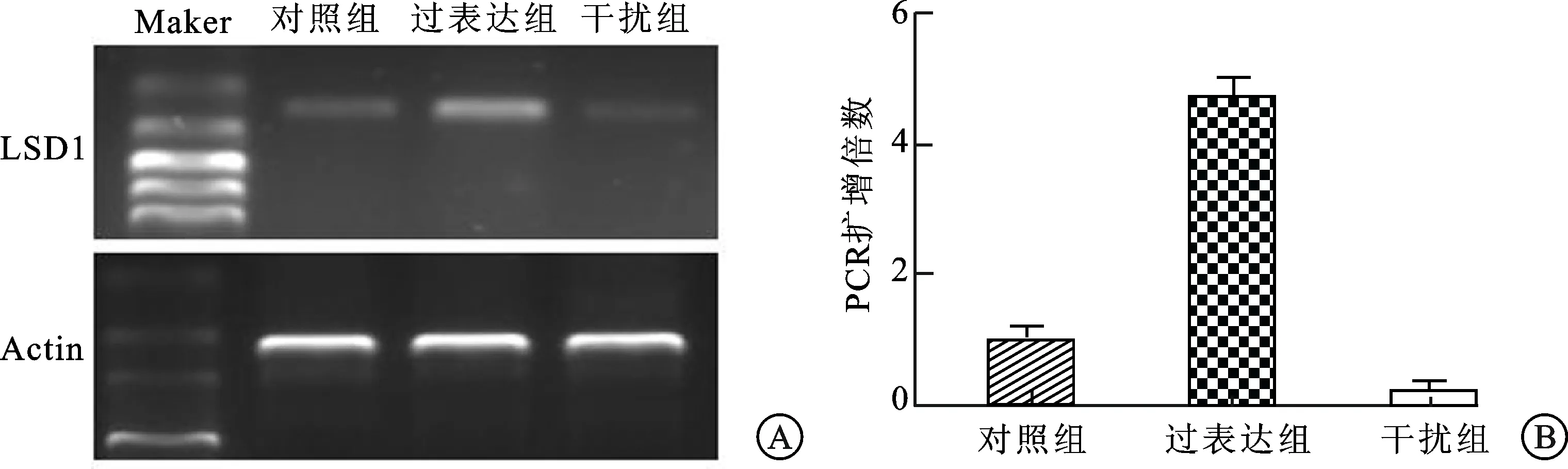
图2 PCR鉴定各组LSD1基因的mRNA表达水平
A:PCR结果显示LSD1mRNA在过表达组表达明显上调,而在干扰组中的表达明显下调;B:LSD1mRNA在对照组、过表达组和干扰组中扩增倍数的比较。
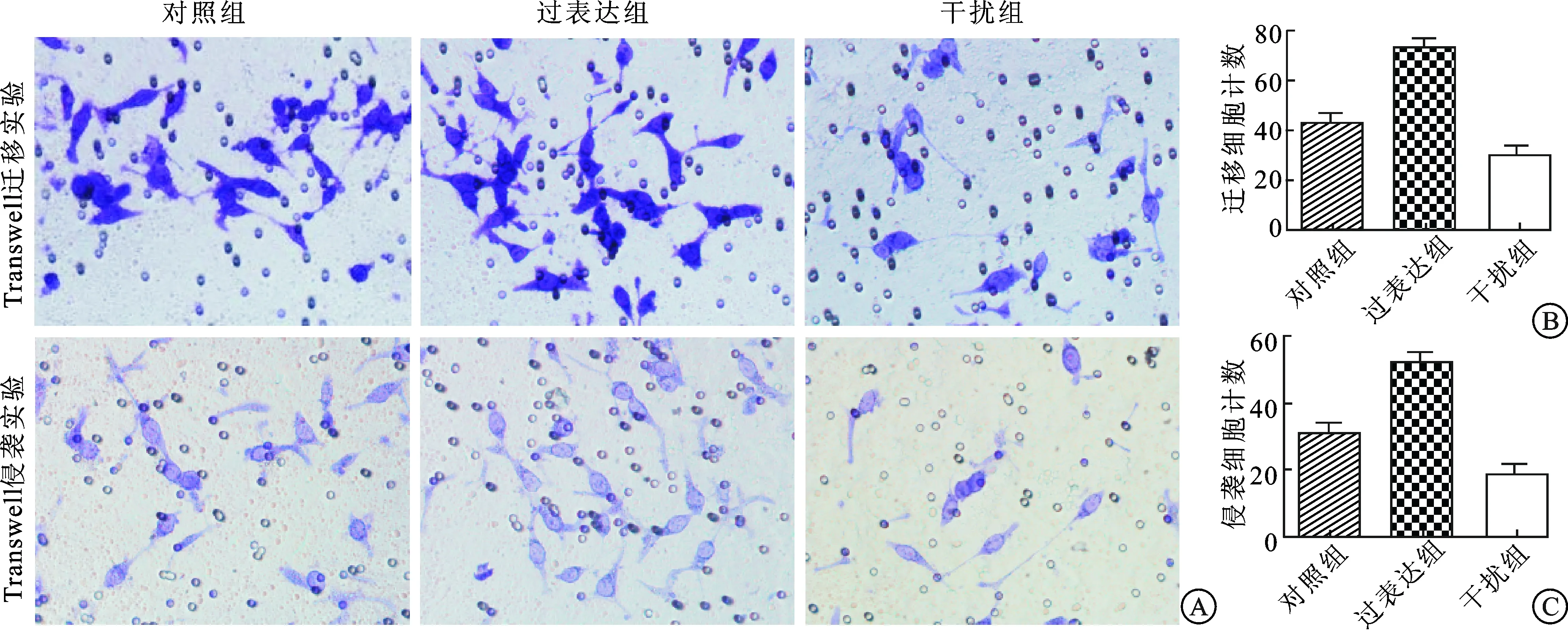
图3 各组细胞Transwell迁移和侵袭实验结果对比
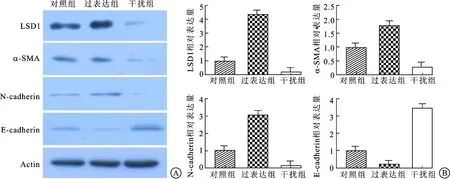
图4 Western blot分析各组LSDl、α-SMA、N-cadherin和E-cadherin蛋白表达水平
3 讨 论
组蛋白甲基化在表观遗传中发挥着十分重要的作用,在2004年LSD1首次被发现以前,组蛋白甲基化一直被认为是不可逆的[6]。组蛋白甲基化转移酶(histonemethyl transferase,HMT)使组蛋白发生甲基化修饰,LSD1是组蛋白去甲基化酶。多项研究表明,LSD1对于维持肿瘤的生物学特性发挥了重要作用,与肿瘤发生、转移、增殖和凋亡等多种行为关系密切[7-8,12-14]。
ZHENG等[15]研究发现,使用siRNA或抑制剂抑制LSD1功能能够诱导某些表达异常的基因沉默,从而有效治疗癌症。HAN等[16]报道,联合使用LSD1抑制剂和DNA甲基转移酶(DNA methyltransferase,DNMTs) 抑制剂,能够明显抑制膀胱癌、白血病和结肠癌等多种癌细胞的增殖。本研究发现,LSD1在前列腺癌中的表达显著高于良性前列腺增生组织,并且在高Gleason评分的前列腺癌组织中的表达显著高于低Gleason评分的前列腺癌组织。因此,我们推测LSD1可能跟前列腺癌进展和转移相关。
上皮细胞通过一系列机制再分化为间质细胞,这一过程被称为EMT[17]。在肿瘤进展过程中,EMT被认为与肿瘤细胞获得干细胞潜能、治疗抵抗和转移进展等恶性潜能相关[18-19]。同时,EMT被认为在前列腺癌转移中发挥着非常重要的作用[20]。E-cadherin的丢失被认为是EMT的标志性改变,与肿瘤获得侵袭性和发生远处转移关系密切[21-22]。近年来,EMT在肿瘤进展、转移中的作用已经成为研究的热点。
本研究发现,在前列腺癌LNCaP细胞中通过过表达的方法上调LSD1表达,能够增加LNCaP细胞的迁移和侵袭能力,同时,能够显著降低EMT标志物E-cadherin的表达、并增加间质表型N-cadherin和α-SMA的表达;而在前列腺癌LNCaP细胞中通过siRNA干扰的方法抑制LSD1表达,能够降低LNCaP细胞的迁移和侵袭能力,同时,能够显著增加EMT标志物E-cadherin的表达、并减少间质表型N-cadherin和α-SMA的表达。LSD1主要表达于细胞核内,具有调控基因转录的功能,一方面它可以作用于H3K4,使单甲基化和双甲基化的H3K4去甲基化,从而抑制相关基因的表达;另一方面,它可以作用于H3K9,使单甲基化和双甲基化的H3K9去甲基化,从而激活相关基因的表达。说明LSD1能够增加前列腺癌细胞的侵袭能力、促进前列腺癌细胞EMT的发生,可能通过调节EMT过程促进前列腺癌进展、转移。研究显示,在Snail 诱导发生的EMT过程中,Snail能够通过招募LSD1,沉默上皮细胞基因E-cadherin的表达[10]。Snail 包含1个Snag 结构域,该结构域含有丰富的精氨酸和赖氨酸残基,类似于组蛋白H3的N末端尾部序列,从而使得Snail 能够借助Snag结构域将LSD1 钩住,同时还能够招募HDAC 和CoREST 辅助抑制因子等,与E-cadherin 启动子区域形成功能复合体,催化H3K4me1、me2 的去甲基化,从而抑制E-cadherin基因的转录。因此,在前列腺癌的发生、发展过程中,过表达的LSD1可能以功能复合体的形式催化前列腺癌细胞H3K4me1、me2 的去甲基化,导致E-cadherin基因表达的降低以及N-cadherin和α-SMA基因表达的增加,从而促进EMT过程。
因此,我们推测LSD1高表达可能成为判断前列腺癌进展、转移和预后的一个标志,前列腺癌细胞可能通过高表达LSD1,促进EMT发生,使肿瘤细胞更具有侵袭和转移性,从而利于发生远处转移。LSD1有可能成为一个治疗前列腺癌的新型抗癌靶点。