乳腺癌高表达基因1在前列腺癌组织中的表达及临床意义
夏 康,郭 佳,翟官忠,刘泽林,王 潇,刘修恒
(武汉大学人民医院泌尿外科,湖北武汉 430060)
乳腺癌高表达基因1(breast cancer overexpressed gene 1,BCOX1)是在乳腺癌研究中新发现的肿瘤相关基因[1]。BCOX1被发现以来,研究主要集中在阐明该基因在乳腺癌中的作用。我们发现其所在的人类染色体17q11.2-q22区域中多个突变的基因位点与前列腺癌易感性相关[2]。在本课题组前期的体外实验中发现,异常表达的BCOX1具有调控前列腺癌细胞增殖、浸润和转移的能力[3]。到目前为止,BCOX1在前列腺组织中的表达情况尚不明确。本研究旨在检测BCOX1在良恶性前列腺组织中的表达水平,分析其与前列腺癌患者临床病理学特征的相关性,探讨BCOX1对前列腺癌患者生存的影响。
1 材料与方法
1.1 组织标本经武汉大学人民医院伦理委员会批准后,收集2006年1月至2012年6月在武汉大学人民医院泌尿外科行前列腺癌根治术的100例患者的手术标本作为实验组。对照组为80例同期行经尿道前列腺电切术患者的良性前列腺增生组织标本。所有患者均经病理学确诊,且在手术前均未经内分泌治疗、放疗、化疗等其他治疗干预。回顾性收集以上100例前列腺癌患者的临床病历资料:术前血清前列腺特异抗原(prostate specific antigen,PSA)、前列腺癌TNM临床分期、术后Gleason评分、精囊侵犯、血管侵犯和切缘状态。
1.2 免疫组化法将实验组与对照组的前列腺石蜡组织标本,切片(4 μm)后脱蜡、水化。消除内源性过氧化物酶并行抗原修复。一抗为BCOX1兔抗人多克隆抗体(Biorbyt,USA),4 ℃过夜。滴加二抗后二氨基联苯胺(diaminobenzidine,DAB)显色,并用苏木素复染,常规脱水干燥后封片,在显微镜下观察并拍照。
1.3 结果评判在Olympus显微镜下观察,BCOX1阳性染色位于细胞质中,表现为淡黄色细颗粒、棕黄色颗粒和褐黄色粗颗粒。染色评判方法为依据组织中阳性细胞百分比和细胞的染色强度综合判断。阳性细胞数<5%为0分;阳性细胞数<50%为1分;阳性细胞数>50%为2分。胞质不染色或微弱染色为0分;胞质染色为1分;胞质强染色为2分。将以上2种评分相加后为BCOX1在前列腺癌组织中的表达水平:0~2分为低表达,3~4分为高表达[4]。由2名经验丰富的病理科医师在不知晓样本的临床和病理信息情况下,使用以上评分标准进行判定,达成共识。
1.4 对所有前列腺癌患者术后进行门诊和电话随访生化复发(biochemical recurrence,BCR):手术后未接受辅助治疗的患者,连续2次PSA≥0.2 ng/mL[5]。无生化复发生存期(BCR-free survival,BRFS):手术之日算起,终止日期为生化复发的时间;总生存期(overall survival,OS):手术之日算起,终止日期为死亡或末次随访日期,按月计算。
1.5 统计学方法应用SPSS 18.0统计软件分析,分类变量采用χ2检验,单因素生存分析采用Kaplan-Meier法并用Log-rank检验,用Cox回归模型分析各变量与预后的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 前列腺癌组织和良性前列腺增生组织中BCOX1蛋白的表达BCOX1主要在前列腺癌组织的细胞质内表达,正常前列腺组织中细胞质无或浅染色,在Gleason评分>7的高度恶性前列腺癌组织中的细胞质深染(图1C)。将BCOX1在前列腺组织中的蛋白表达水平分为低表达和高表达,进行统计学分析。80例良性前列腺增生组织中BCOX1高表达率为7.50%(6/80);100例前列腺癌组织中BCOX1高表达率为72.00%(72/100),差异具有统计学意义(P<0.05)。结果说明,在蛋白水平BCOX1在前列腺癌组织中的表达水平显著高于良性前列腺增生组织。
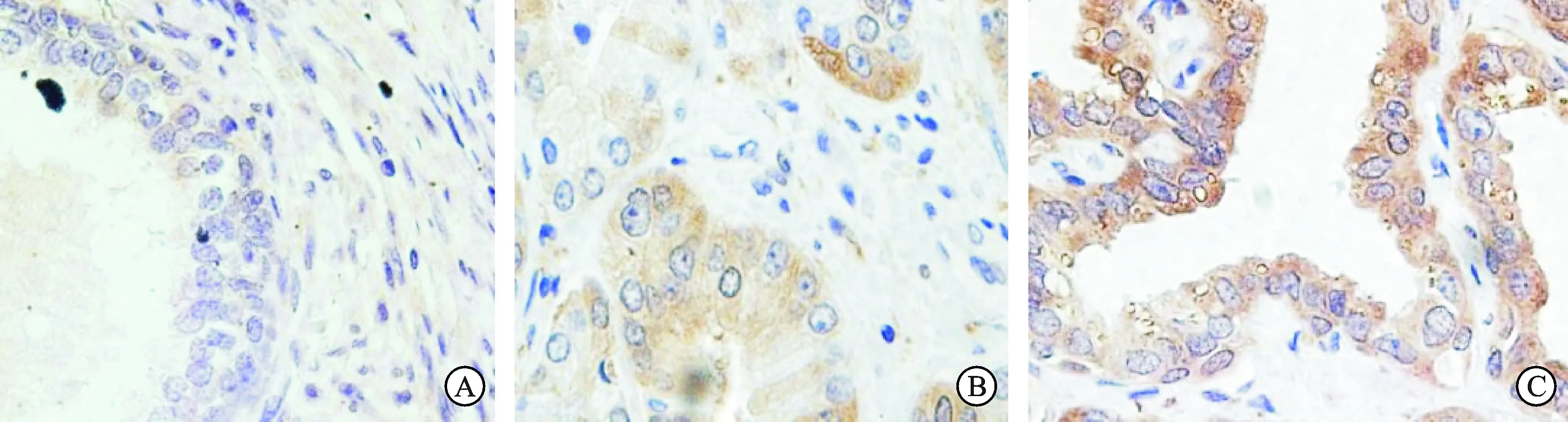
图1 BCOX1在前列腺良恶性组织中的蛋白表达(免疫组化,×400)
A:良性前列腺增生组织;B:低度恶性前列腺癌组织;C:高度恶性前列腺癌组织。
2.2 BCOX1蛋白表达与前列腺癌临床病理的关系在前列腺癌组织中,BCOX1蛋白表达水平在不同Gleason评分和PSA水平之间差异具有统计学意义(P<0.05,表1),而在不同年龄、TNM临床分期、周围血管侵犯、术后切缘状态和精囊侵犯之间差异无统计学意义(P>0.05,表1)。
2.3 BCOX1的表达与前列腺癌患者的BRFS和OS的关系利用Kaplan-Meier对不同BCOX1表达水平前列腺癌患者的BRFS和OS进行生存曲线分析,结果显示,BCOX1高表达前列腺癌患者与低表达患者比较5年BRFS明显缩短,且BCOX1高表达前列腺癌患者5年OS显著低于低表达前列腺癌患者(P<0.05,图2)。
2.4 影响前列腺癌患者预后的单因素和多因素生存分析对100例前列腺癌患者生存资料进行预后分析,单因素分析发现TNM临床分期、精囊侵犯、术后切缘状态以及BCOX1表达水平与BRFS和OS相关;将上述各因素纳入多因素Cox回归分析发现TNM临床分期、精囊侵犯、术后切缘状态以及BCOX1表达水平与BRFS和OS相关(表2,表3)。单因素及多因素Cox回归分析均提示BCOX1是前列腺癌患者预后的独立危险因素。
表1 不同Gleason评分、临床分期、PSA水平、精囊侵犯、血管侵犯和切缘状态前列腺癌组织中BCOX1蛋白的表达[例(%)]
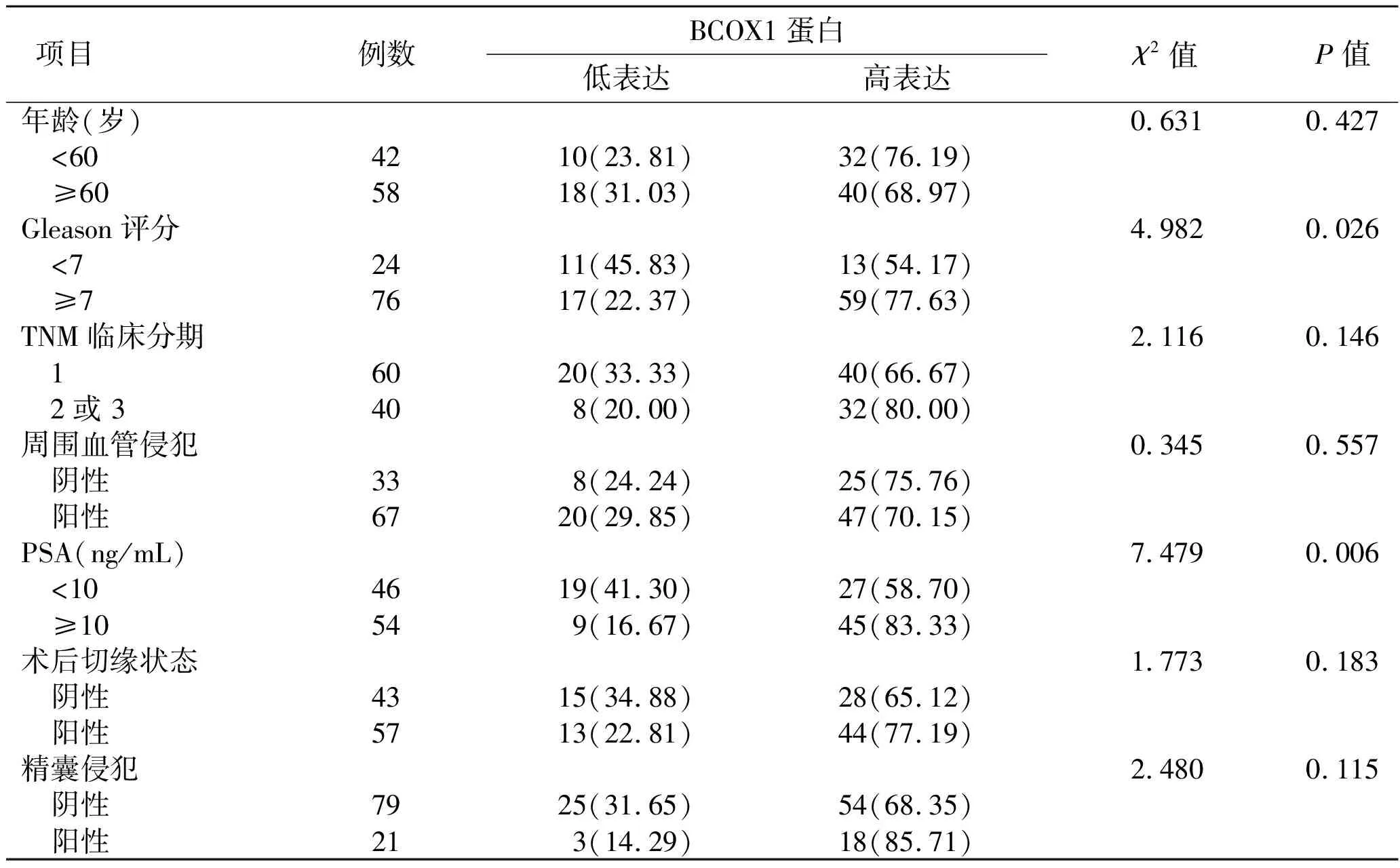
项目例数BCOX1蛋白低表达高表达χ2值P值年龄(岁)0.6310.427 <604210(23.81)32(76.19) ≥605818(31.03)40(68.97)Gleason评分4.9820.026 <72411(45.83)13(54.17) ≥77617(22.37)59(77.63)TNM临床分期2.1160.146 16020(33.33)40(66.67) 2或 3408(20.00)32(80.00)周围血管侵犯0.3450.557 阴性338(24.24)25(75.76) 阳性6720(29.85)47(70.15)PSA(ng/mL)7.4790.006 <104619(41.30)27(58.70) ≥10549(16.67)45(83.33)术后切缘状态1.7730.183 阴性4315(34.88)28(65.12) 阳性5713(22.81)44(77.19)精囊侵犯2.4800.115 阴性7925(31.65)54(68.35) 阳性213(14.29)18(85.71)
PSA:血清前列腺特异抗原。

图2 BCOX1高表达与低表达前列腺癌患者的生存曲线
表2 单因素和多因素分析影响前列腺癌患者BRFS的危险因素
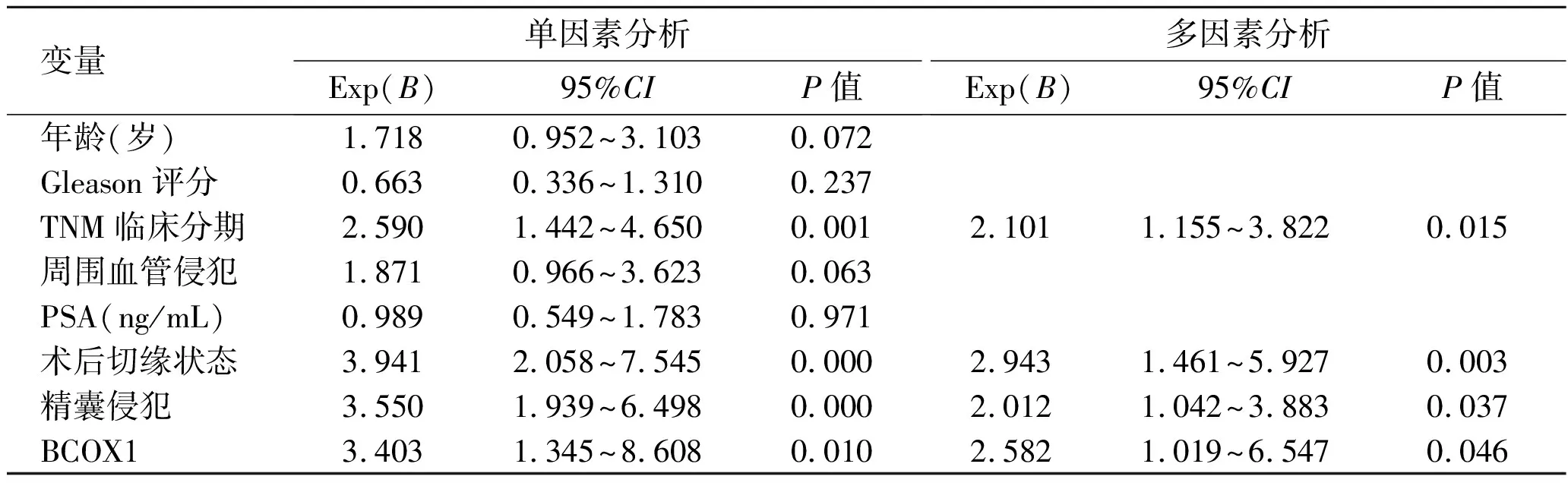
变量单因素分析Exp(B)95%CIP值多因素分析Exp(B)95%CIP值年龄(岁)1.7180.952~3.1030.072Gleason评分0.6630.336~1.3100.237TNM临床分期2.5901.442~4.6500.0012.1011.155~3.8220.015周围血管侵犯1.8710.966~3.6230.063PSA(ng/mL)0.9890.549~1.7830.971术后切缘状态3.9412.058~7.5450.0002.9431.461~5.9270.003精囊侵犯3.5501.939~6.4980.0002.0121.042~3.8830.037BCOX13.4031.345~8.6080.0102.5821.019~6.5470.046
PSA:血清前列腺特异抗原;BCOX1:乳腺癌高表达基因1;BRFS:无生化复发生存期。

表3 单因素和多因素分析影响前列腺癌患者OS的危险因素
PSA:血清前列腺特异抗原;BCOX1:乳腺癌高表达基因1。
3 讨 论
前列腺癌的生化复发提示预后不良,随着对前列腺癌研究的不断深入,前列腺癌预后评估相关新型分子标志物不断被发现。共济失调毛细血管扩张突变基因(ataxia telangiectasia mutated gene,ATM)与乳腺癌敏感基因1/2(breast cancer susceptibility gene 1/2,BRcA1/2)的突变能区分恶性程度较高的前列腺癌和惰性前列腺癌;神经纤毛蛋白2(neuropilin 2,NRP 2)可作为高危前列腺癌的独立危险因素;前列腺癌根治术前中性粒细胞和淋巴细胞比值(neutrophil lymphocyte ratio,NLR) 与患者高生化复发率密切相关[6-8]。基于肿瘤基因组图谱(the Cancer Genome Atlas,TCGA)数据库,按照BCOX1基因的表达水平和Gleason评分将前列腺癌患者分组后,利用UALCAN公共网站(http://ualcan.path.uab.edu/index.html)可进行基因表达与生存分析的在线统计学分析[9]。
BCOX1基因序列是由1 103个碱基对构成,可以编码由222个氨基酸组成的BCOX1蛋白,在细胞浆内表达[10]。研究表明BCOX1主要在乳腺癌组织中存在,特别是在恶性程度较高的乳腺癌(浸润性和转移性乳腺癌)中高表达。最近研究表明BCOX1表达与乳腺癌的病理级别、人类表皮生长因子受体2 (human epidermalgrowth factor receptor-2,HER2)以及三阴性乳腺癌相关,BCOX1的高表达可以作为预测乳腺癌不良预后的新生物指标[11]。BCOX1基因所在的人类染色体17q11.2-q22区域中部分基因位点突变被认为与前列腺癌易感性相关[12]。通过分析公共microarray数据库(https://www.oncomine.org/)中的人类前列腺组织中BCOX1的数据,发现BCOX1的mRNA水平在前列腺癌组织中的表达显著高于良性前列腺增生组织,而BCOX1在前列腺组织中的具体表达情况尚不清楚[13]。
本研究中我们用免疫组化染色方法观察100例前列腺癌组织和80例良性前列腺增生组织中的BCOX1的表达情况,结果显示,蛋白水平BCOX1在前列腺癌组织中的表达水平显著高于良性前列腺增生组织,异常表达的BCOX1可能与前列腺癌具有相关性。进一步分析BCOX1与前列腺癌临床病理参数的关系,结果发现在前列腺癌组织中,BCOX1蛋白表达水平在不同Gleason评分和PSA水平之间差异具有统计学意义,提示BCOX1高表达可能是前列腺癌的高危因素与术后复发相关。
通过Kaplan-Meier生存分析发现前列腺癌患者中BCOX1的蛋白表达水平与患者术后BRFS和OS相关,进一步利用Cox比例风险回归模型分析,结果显示BCOX1的表达是前列腺癌患者术后复发和预后的独立危险因素,BCOX1表达较高的前列腺癌患者生存期相对较短。本实验结果与TCGA数据库有关BCOX1基因与前列腺癌预后的关系具有一致性。BCOX1在前列腺癌中的具体作用机制尚不明确,本课题组前期研究发现异常表达的BCOX1不仅可以调控前列腺癌细胞的增殖、侵袭和迁移,还可以影响STAT3信号通路的激活参与前列腺癌细胞神经内分泌分化的调控。神经内分泌分化最具有代表性的标记物是嗜铬粒蛋白A,可以作为去势抵抗性前列腺癌患者生存期的预测指标[14]。以上结果表明,BCOX1是前列腺癌的相关癌基因,是判断前列腺癌预后的潜在指标,可能为优化患者的术后临床决策提供依据,提高患者的生存期。
本研究为单中心回顾性研究,标本量较小,可能导致患者的代表性差,结果存在一定偏倚。此外前列腺癌患者的生存期较长,本研究随访时间较短,今后我们将加大样本量并继续对这部分患者进行随访研究。BCOX1能否作为分子生物学诊断和治疗的靶点,有待后期实验进一步研究。
综上所述,BCOX1在前列腺癌组织中高表达,其表达水平与前列腺癌术前PSA水平、术后Gleason评分有关,与前列腺癌患者预后密切相关,可为筛选高风险前列腺癌患者提供重要信息,有助于对具有潜在复发风险和不良预后的患者进行早期综合治疗。BCOX1可能成为监测前列腺癌患者预后的理想指标。