多价抗虫水稻外源Bt 基因的多引物多重PCR 检测方法
方欣怡 阳菁 王井章 李阳生
(武汉大学生命科学学院 水稻国家重点实验室,武汉 430072)
水稻鳞翅目害虫会影响水稻丰产和稳产。稻纵卷叶螟、二化螟、三化螟对我国水稻生产造成的损失可占总产量的5%-10%,杂交水稻水稻的广泛种植使得长江流域的三化螟危害下降,二化螟进而变成主要害虫[1-2]。其主要危害表现为造成叶片枯白、枯心苗、白穗。目前在水稻中尚未发现对水稻鳞翅目害虫具有抗性的稻种资源,因此过去对螟虫的防治主要以施用农药为主,但也存在防治效果不佳、农药残毒污染、增加成本等问题。
近10 年,我国政府大力支持转Bt基因在粮食作物中的应用,投入了大量的人力、财力、物力。Bt基因是来自于苏云芽孢杆菌的一种杀虫基因,这种转基因水稻可在体内表达出一种Bt 杀虫蛋白,可特异性毒杀鳞翅目、鞘翅目昆虫,减少杀虫剂的使用量,是目前农作物转基因育种主要使用的目标抗虫基因[3-4]。在抗虫育种及生产中发现,随着Bt 杀虫剂的大量应用,会使害虫产生抗性,作用难以持久,而使其应用具有一定的风险。不同的Bt 蛋白在昆虫体内的受体并不相同,同时利用多个Bt基因的多价抗虫水稻,可以获得抗虫性状的持久利用[5-7],而且不会明显改变农艺性状,单拷贝插入的后代分离符合孟德尔遗传规律。目前国内水稻科学家们已经培育出一系列的转Bt基因抗虫水稻,如转基因水稻TT51-1(转cry1Ab/cry1Ac融合基因),转基因水稻T2A-1(转cry2A基因),转基因水稻T1C-19(转cry1C基因)等[4,5,8-10],并利用这些转化事件通过杂交和系统选育的方法,培育了一批具有商业生产潜力的转基因水稻新品系。这些抗虫新品系不仅可以用来作为新的抗性育种资源,也可以用于发展三价Bt水稻[4]。利用多个Bt基因培育多价抗虫水稻获得持久的抗虫性状是抗虫转基因育种的发展趋势。
选育Bt基因纯合的优良单株是决定育种进程的一个关键因素。目前常用的检测Bt基因的分子标记主要是根据外源插入片段序列设计的特异显性标记,该标记可以检测目标基因的有无,无法判断当代植株的纯合或杂合基因型,需要在下一代对基因型或者表型进行群体验证[4-5,11-12]。以前的检测方法所需时间较长,对试验技术条件要求较高,且受仪器、设备和电力以及空间等诸多因素的限制,不利于快速检测以及在基层实验室的推广应用[13-16]。在筛选含多个Bt抗性基因的纯合后代时,利用以前的方法进行鉴定效率较低,费时费力。根据转基因插入位点附近的序列设计多重PCR 标记,可以有效鉴别基因型的纯合和杂合[5,17-19],特别是在多价抗性纯合后代的筛选中,能提高效率,加快育种进程。
转Bt基因水稻TT51-1(转cry1Ab/cry1Ac融合基因),T2A-1(转cry2A基因)和T1C-19(转cry1C基因),是培育抗螟虫水稻和多价抗虫水稻的优良亲本。本研究根据TT51-1,T2A-1 和T1C-19 中外源DNA 插入位点两侧基因组序列分别设计引物L 和R,根据插入序列设计引物I,通过L+R+I 的引物组合检测结果,不仅可以在单个抗性基因材料中同时鉴定转基因插入事件的纯合、杂合和阴性3 种基因型,还可以在双价和三价抗虫材料中,同时鉴定出各个抗性基因的基因型,以期为利用Bt基因进行抗螟虫水稻分子育种提供一个高效的基因鉴定技术。
1 材料与方法
1.1 材料
转Bt基因纯合系TT51-1(cry1Ab/1Ac)、T2A-1(cry2A)、T1C-19(cry1C)由华中农业大学作物遗传改良国家重点实验室/国家植物基因研究中心(武汉)提供。非转基因水稻9311、R988、超泰B 由本实验室保存。
分别用9311 与TT51-1,R988 与T2A-1,超泰B 与T1C-19 杂交,以获得的F1自交得F2用于筛选单价Bt转基因插入事件的不同基因型植株(图1-A);同时将三个F1彼此间两两杂交,在杂交F2后代中筛选双价Bt转基因插入事件的不同基因型(图1-B);在9311/TT51//R988/T2A-1 的F2后代中筛选出双价纯合TT51-1(+/+)T2A-1(+/+)基因型的水稻单株,与T1C-19(T1C-19(+/+))杂交,在杂交F2后代中筛选三价Bt转基因插入事件的不同基因型(图1-C)。
1.2 方法
1.2.1 DNA 提取方法
1.2.1.1 碱裂解法 剪下大约1-2 cm 长的水稻叶片放于2 mL 圆底离心管中,并在其中加入钢珠和40 μL 0.25 mol/L NaOH 溶液,放在QIAGEN Tissuelyser样品打样机中磨碎匀浆,再加入160 μL 0.05 mol/L(pH8.0)Tris-HCl,振荡混合摇匀后12 000 r/min 离心,取上清,得到DNA。
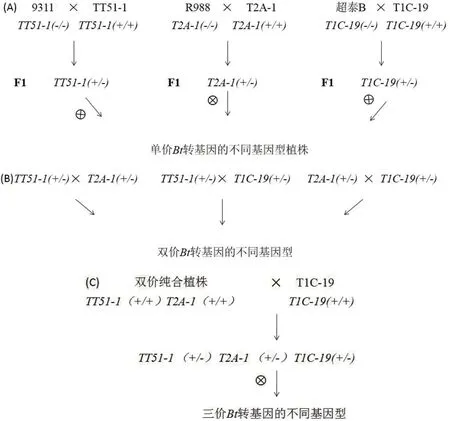
图1 用于检测的不同基因型水稻材料
1.2.1.2 CTAB 法 取约100 mg 新鲜的水稻嫩叶组织放入2 mL EP 管,在液氮冷冻条件下将组织研磨成粉末状。再加入600 μL 2×CTAB 提取液(2×CTAB提取液使用之前加入0.2%的巯基乙醇),颠倒混匀之后放入水浴锅中,65℃水浴30-60 min,期间每10 min 颠倒混匀一次。取出EP 管,待其冷却后加入等体积的600 μL 的24∶1 的氯仿/异戊醇混合液,剧烈振荡,使之充分混匀,12 000 r/min 室温离心10 min。然后取上清液约400 μL,加入1/10 体积的3 mol/L NaAC 溶液40 μL,加入2 倍体积的无水乙醇880 μL,充分混匀后于-20℃冰箱中静置30 min,12 000 r/min,4℃离心10 min 弃上清,再次12 000 r/min,4℃离心1 min,用100 μL 的移液枪吸去管底的多余液体。加入200 μL 75%乙醇,温和震荡EP 管,将沉淀弹起,清洗沉淀,8 000 r/min,4℃离心2 min后弃去上清,重复上一清洗步骤。弃去上清,再次离心,用100 μL 的移液枪吸去管底的多余液体,风干沉淀6 min,加入50 μL 1×TE 溶液,用枪反复吹打,确保沉淀溶解完全,得到DNA。
1.2.2 引物设计方法 由NCBI 数据库中查询得到TT51-1(Genebank:EU880444.1)的 外 源 片 段插入序列及插入位点两侧水稻基因组序列,T2A-1(GenBank:HQ161063.1)的部分外源片段序列及插入位点左侧水稻基因组序列,T1C-19(GenBank:HQ161062.1)的部分外源片段序列及插入位点左侧水稻基因组序列。根据TT51-1 插入序列及两侧基因组序列设计L+R 及I+R 组合用于分别检测基因组片段和插入事件。根据T2A-1 和T1C-19 插入序列及左侧基因组序列设计L+I 引物组合检测插入位点,在插入位点右侧选取1 kb 左右基因组片段设计R 引物,用L+R 组合检测基因组片段(图2)。所有引物利用Premier5 软件设计,引物序列及扩增产物信息见表1,由武汉金开瑞生物工程有限公司合成。
1.2.3 二引物PCR 扩增产物测序方法 PCR 产物经1%的琼脂糖凝胶电泳分离后,回收包含目标片段的胶块,用南京诺唯赞生物科技有限公司生产的DNA胶回收试剂盒回收目标片段DNA,送北京奥科鼎盛生物科技有限公司进行测序。
1.2.4 不同PCR 扩增体系方法
1.2.4.1 三引物PCR 扩增体系 因为所设计的引物退火温度均在52-57℃之间,在此区间做梯度PCR测试发现温度影响较小,最终选用56℃作为体系的退火温度。
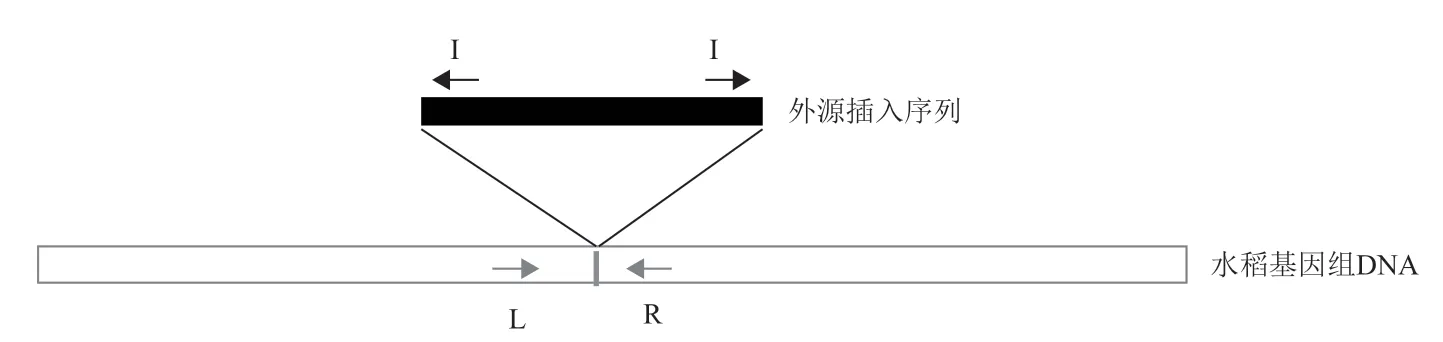
图2 三引物PCR 检测转基因插入事件原理示意图

表1 实验所用引物及产物序列
考虑到三引物多重PCR 扩增体系中存在1 个左侧引物L、1 个右侧引物R 和1 个插入序列I,引物相互之间的竞争对扩增效果会有影响。所以,设计了几个不同引物使用量的PCR 反应体系,最终选用最为合适的PCR 扩增体系即2AL1∶2AR1∶2AI1按 照0.5∶0.15∶0.35 的 比 例 进 行 混 合 扩 增,1AR1∶1AL1∶1AI1 或1AR1∶1AL1∶1AI2 和1CL1∶1CR1∶1CI1 或1CL2∶1CR2∶1CI2 按 照0.5∶0.15∶0.35 的比例进行混合扩增,分别能得到两条大小有明显区别且明亮的条带。能区分转基因杂合体、转基因纯合体和非转基因材料,在杂合体中扩增出清晰的片段,片段大小分别与纯合体和阴性材料中的片段大小一致,表现在杂合体两条片段的扩增量几乎一致。
转基因插入位点侧翼引物L+R 用于扩增基因组序列,L/R+插入序列特异引物I 用于检测特异转基因事件。利用L+R+I 的三引物组合,在转基因纯系材料TT51-1、T2A-1、T1C-19 中,仅能扩出特异转基因事件条带。在转基因阴性材料9311、R988、超泰B 中,仅能扩出基因组序列条带。在转基因杂合材料9311/TT51-1、R988/T2A-1、超泰B/T1C-19 中,能扩出两条预期大小条带。
PCR 反应体系为30 μL,其中包含2×mix 15 μL(诺唯赞green mix),DNA 模板2 μL 和合适量的三引物L、R 和I(引物浓度为10 μmol/L,引物使用量根据优化结果确定)。PCR 反应程序为95℃反应5 min,然后进入三温度循环,每个循环包括 94℃反应30 s,56℃反应45 s,72℃反应1 min,共30 个循环,最后72℃反应5 min。
1.2.4.2 六引物PCR 扩增体系 为了测试不同Bt基因的三引物体系能否同时使用以检测双价和三价转基因水稻,将9311/TT51-1、R988/T2A-1 和超泰B/TIC-19 两两杂交,在杂交后代中利用3 种三引物体系检测筛选出不同基因型的双价水稻单株,以这些后代DNA 作为模板,分别利用不同引物组合进行PCR 扩增。
设计了几个不同引物使用量的PCR 反应体系,最终选用最为合适的PCR 扩增体系:
检 测TT51-1和T2A-1的6 条 引 物,1AR1∶1AL1∶1AI1∶2AL1∶2AR1∶2AI1 按 照0.4∶0.1∶0.5∶0.4∶0.1∶0.5 的比例进行混合扩增;检测TT51-1和T1C-19的6 条 引 物,1AR1∶1AL1∶1AI1∶1CL1∶1CR1∶1CI1 按 照0.5∶0.05∶0.45∶0.5∶0.05∶0.45 的比例进行混合扩增;检测T2A-1和T1C-19的6 条引物,2AL1∶2AR1∶2AI1∶1CL1∶1CR1∶1CI1 按 照0.4∶0.15∶0.45∶0.4∶0.15∶0.45的比例进行混合扩增。
PCR 反应体系为30 μL,其中包含2×mix 15 μL(诺唯赞green mix),DNA 模板2 μL 和合适量的6条引物(引物浓度为10 μmol/L,引物使用量根据优化结果确定)。PCR 反应程序为95℃反应5 min,然后进入三温度循环,每个循环包括 94℃反应30 s,56℃反应45 s,72℃反应1 min,共30 个循环,最后72℃反应5 min。
1.2.4.3 九引物PCR 扩增体系 进一步希望利用3 组引物组合同时检测3 个Bt基因的基因型。将9311/TT51-1 x R988/T2A-1 F2 后代中基因型为双价纯合的单株与T1C-19 杂交,获得基因型为TT51-1(+/-)T2A-1(+/-)T1C-19(+/-)水稻材料,用于检测9 条引物组合的扩增效果。在多引物PCR 体系中,随着引物数量的增减,多重引物之间存在的引物间的相互干扰的难度加剧。因此,针对9 条引物组合,设计了不同引物使用量的27 个PCR 反应体系(表2)。
在三引物的基础,把各自适合的引物体系混合在一起后进行PCR 扩增,发现可以出现6 条大小不同的目的条带,但有的太微弱。故考虑调整引物浓度配比,优化后得到最佳引物配比1AR1∶1AL1∶1AI1∶2AL1∶2AR1∶2AI1∶1CL1∶1CR1∶1CI1 为0.4∶0.15∶0.45∶0.4∶0.1∶0.5∶0.4∶0.15∶0.45,PCR 反应体系为30 μL,其中包含2×mix 15 μL(诺唯赞green mix),DNA 模板2 μL 和最适量的9 条引物(引物浓度为10 μmol/L,引物使用量根据优化结果确定)。

表2 三价转基因材料PCR 不同9 条引物比例扩增体系
PCR 反应程序为95℃反应5 min,然后进入三温度循环,每个循环包括 94℃反应30 s,56℃反应45 s,72℃反应1 min,共30 个循环,最后72℃反应5 min。
2 结果
2.1 三引物PCR体系对转基因水稻材料扩增的特异性检测
以不同类型水稻DNA 为模板,分别利用不同引物组合进行PCR 扩增,均能扩增出预期大小的目的条带(图3)。
对引物L+R、L/R+I 和L+R+I 在不同水稻材料中扩增出的片段的测序结果显示阴性条带与预期有所差别(表3),原因是我们以NCBI 数据库中TT51-1、T2A-1、T1C-19 三个转基因事件的部分插入序列和日本晴的基因组为参考序列设计引物,但实际PCR 扩增检测的是其他水稻品种,因此阴性条带存在些许差异;阳性条带与预期结果完全一致,均能扩增出目标片段。
2.2 不同转基因水稻材料扩增及条件优化
2.2.1 双价转基因水稻材料扩增及条件优化 由图4 可以看出,不同的6 条引物组合能够在双价转基因材料中扩增出预期大小条带。
2.2.2 三价转基因水稻材料扩增及条件优化 由图5-A 可见,在三价杂合转基因水稻(TT51-1(+/-)T2A-1(+/-)T1C-19(+/-))中,体系24 的扩增效果最好,6 条扩增条带均清晰可见。
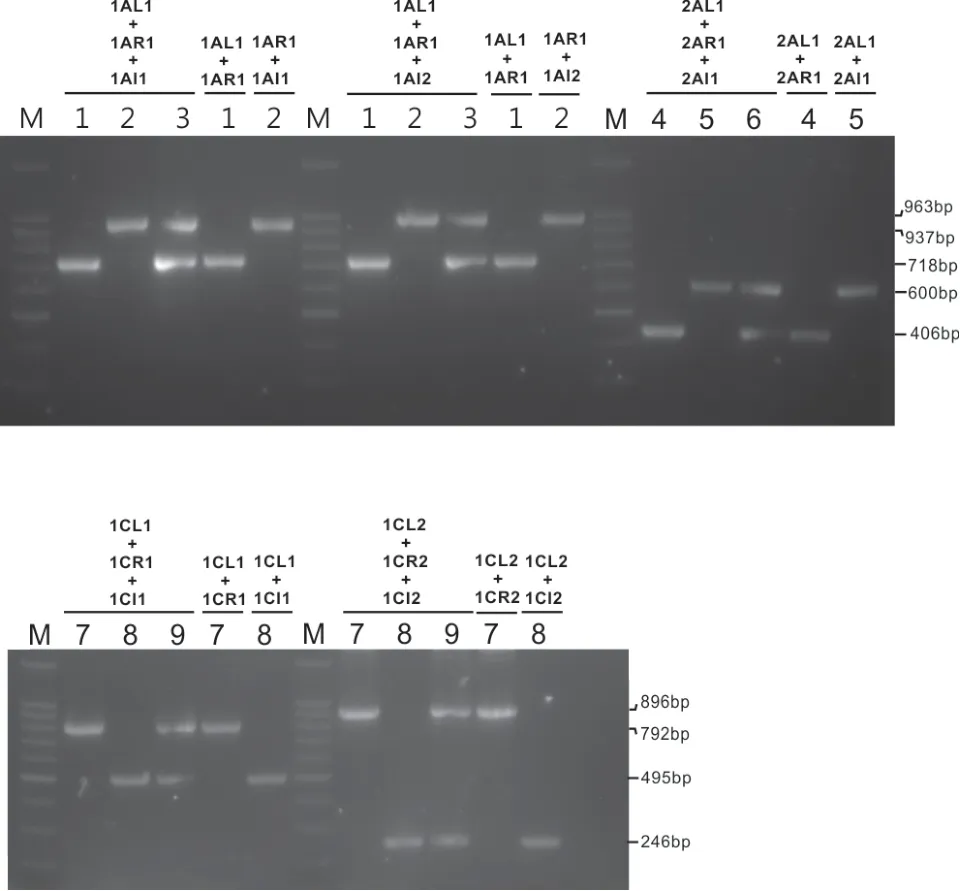
图3 三引物PCR 体系在水稻材料中的扩增

预期大小/bp 实际大小/bp 9311 716 718 TT51-1 937 937 9311/TT51-1 716 + 937 718 + 937 2AR1+2AL1+2AI1预期大小/bp 实际大小/bp R988 406 434 T2A-1 600 600 R988/T2A-1 406 + 600 434 + 600 1CR1+1CL1+1CI1预期大小/bp 实际大小/bp超泰B 790 792 T1C-19 495 495超泰B/T1C-19 790 + 495 792 + 495
在9311/TT51//R988/T2A-1(TT51-1(+/+)T2A-1(+/+))x T1C-19(T1C-19(+/+))的F2代植株中,利用多引物检测体系分别筛选含有单价、双价、三价不同Bt基因型的水稻单株,用于检测9 条引物检测体系的特异性。利用体系24 的引物配比,对不同基因型的转基因材料进行了检测,结果(图5-B)表明9 条引物PCR 体系可以准确区分3 种Bt基因的不同基因型。
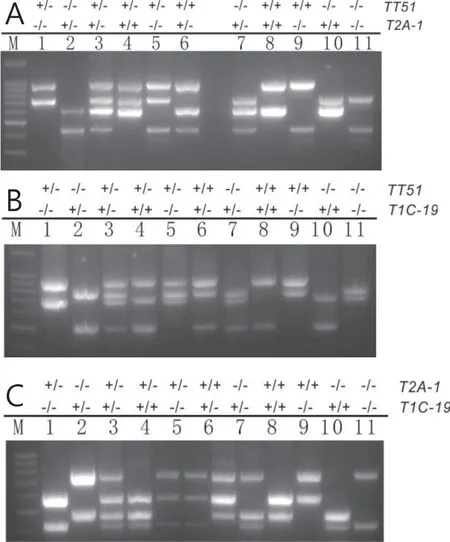
图4 6 条引物PCR 体系检测双价转基因水稻
同时也检测了该PCR 体系对不同提取方法所获得的DNA 模以及对不同商用PCR 扩增试剂的通用性(图5-C),发现对于碱裂解法粗提的DNA 和CTAB 提取的DNA 作为模板进行扩增效果没有明显差别,对不同的商用试剂也有很好的兼容性。
2.3 单价或多价转基因抗虫水稻材料的分子检测
根据杂交亲本的基因型状况不同,利用该检测方法能够在F2或者F3代中快速鉴定出单价、双价和三价Bt转基因水稻的转基因纯合单株。随机选取了基因型为TT51-1(+/-)T2A-1(+/-)T1C-19(+/-)自交后代里的288 株,提取DNA 后做9 条引物PCR检测结果见表4。
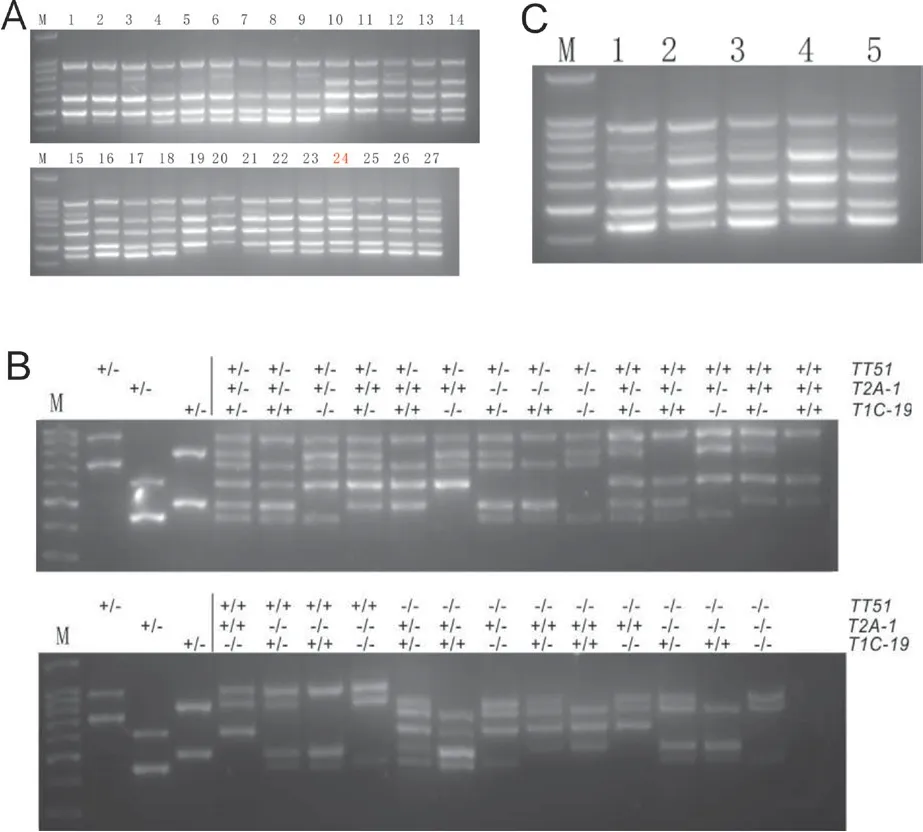
图5 9 条引物PCR 体系检测3 价转基因水稻
3 讨论
利用Bt基因能够增强转基因植物对螟虫的抗性,已经在国内外多年的研究和商业化种植得到充分证明。但同时也存在长时间大规模利用单一Bt抗性基因后,使害虫产生抗性的风险。选育带有多个不同Bt基因的多价转基因作物,是降低这一风险的有效手段[5-7]。然而抗虫性在形状上通常表现为显性或者半显性,因此很难从表型鉴定上来判断多个Bt基因的导入以及纯合/杂合情况。利用分子标记辅助选择手段,可以在选育后代中检测多个Bt基因的导入情况,对于这种多个功能类似外源基因导入的选育,具有更明显的优势,能够加快选育进程。常用的Bt基因分子标记,多是根据插入片段设计的特异显性标记,而无法判断当代植株的纯合或杂合情况[20]。
利用转基因插入位点附近的序列设计三引物的多重PCR,可以在一个反应中鉴定Bt基因的纯合、杂合和转基因阴性,能大大提高检测效率[5]。因此利用多重PCR 的方法,理论上也可以同时检测多价Bt转基因后代的基因型。多重PCR 可以在 PCR 反应中同时加入多对引物,同时扩增多个目的基因,利用一次 PCR 反应,就能同时检测多个靶标基因,与传统 PCR 方法相比,具有低耗时、高通量、节省样品的优点[21],但同时在引物设计、反应条件优化上也存在着不小的技术难度。在本研究中,我们针对已经获得转基因安全证书的转基因水稻TT51-1(转cry1Ab/cry1Ac融合基因)、以及在转基因育种研究中被广泛使用的供体材料T2A-1(转cry2A基因)和T1C-19(转cry1C基因),设计了一系列多重引物,用于在水稻选育材料中检测单价、二价、三价转Bt基因的基因型,以便尽快确认Bt基因的纯合或者杂合状态,解决抗虫表型鉴定无法区分单价和多价的问题,能够加快抗虫转基因水稻的选育进程。
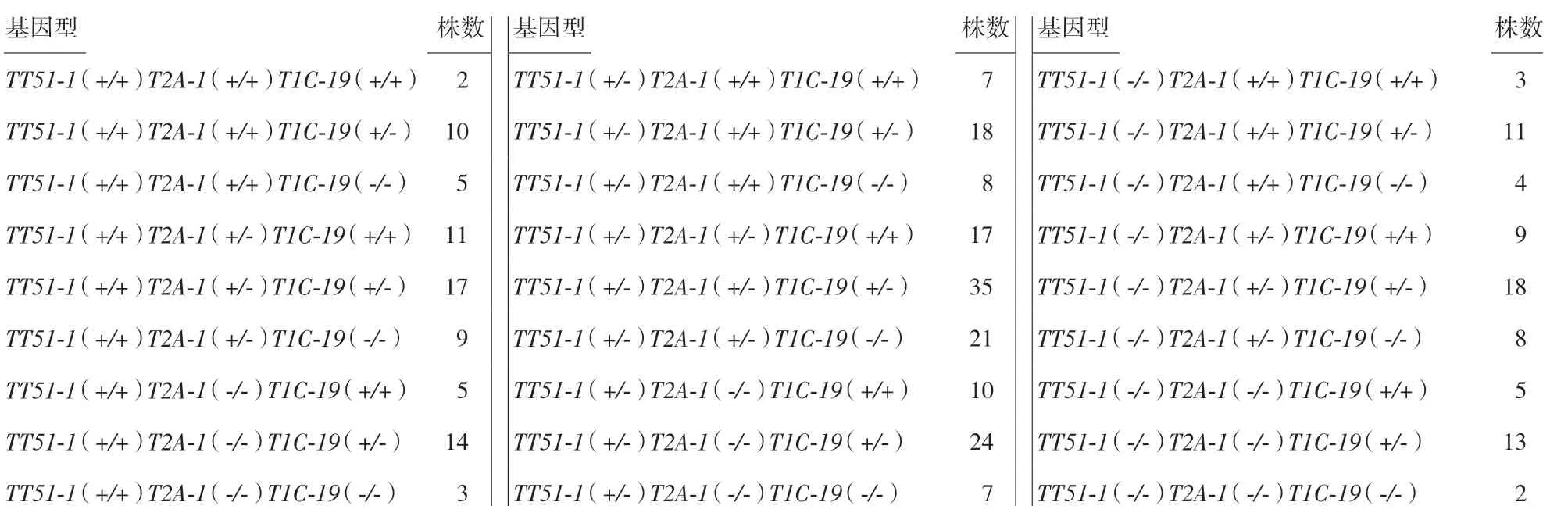
表4 在TT51-1(+/-)T2A-1(+/-)T1C-19(+/-)自交后代中随机选取288 个水稻样品,用9 条引物检测法进行快速鉴别后代基因型的结果统计
多重PCR 的实验设计难度随着扩增片段的增加而递增,要避免引物间的相互结合,引物与模板上目标片段以外的非特异性结合,还要注意不同扩增片段间的扩增效率差异引起的资源竞争以及不同扩增片段的检测区分[21]。本研究中,我们针对3 个转化事件合理设计了多重PCR 引物,最多可以同时利用9 条引物检测3 个Bt基因的转基因情况。本研究设计的9 条引物PCR 扩增体系产物条带清晰,条带大小区分明显,在普通琼脂糖凝胶上即可有效区分,不需要借助荧光探针或者聚丙烯酰胺凝胶电泳等较昂贵或较费时的检测手段。
在聚合多价Bt基因的检测过程中,会涉及到大量的DNA 提取,按照传统的CTAB 提取方法费时费力。利用NaOH 和Tris-HCl 能快速提取水稻DNA 用于PCR 检测,但提取的DNA 质量却不如传统CTAB提取方法。在不同PCR 反应体系中的测试结果表明,用常用的国产或者进口PCR 反应试剂均能获得较好的扩增结果。对DNA 模板的测试结果也表明,不论是经过裂解、抽提、纯化的基因组DNA,还是粗提未经纯化的基因组DNA,均能得到一致的检测结果。这些测试说明本次设计的多重PCR 体系,能够快速、有效、经济地对大量育种后代进行Bt基因型的检测,以配合后续的农艺性状评估,综合筛选出合适的选育后代。表3 检测结果只需要一个工作日时间便可独立完成,从用碱裂解法粗劣提取DNA,到PCR 扩增,跑胶电泳,最终统计结果,体现了本方法的高效性。本实验结果证明该检测方法的可靠性,且在不同实验试剂中具有良好的兼容性。
利用Bt基因进行抗螟虫水稻育种是防治水稻螟虫的有效途径,多价Bt转基因水稻的选育是抗虫转基因水稻品种改良的一个重要方向,多引物多重PCR 方法的建立为利用多价Bt基因抗螟虫水稻分子育种提供了一个简便有效的基因检测技术,将有助于提高对Bt基因的检测效率,加快抗螟虫水稻的育种进程。
4 结论
本研究针对多价转Bt抗虫水稻设计多重引物及反应体系,可在琼脂糖胶上快速区分代表TT51-1、T2A-1、T1C-19 事件插入的阳性、阴性条带,用于对转Bt基因插入事件水稻的纯合、杂合、阴性进行检测,且对不同的PCR 试剂及不同提取方法的DNA模板都有很好的兼容性。

