烟草过氧化物酶基因NtPOD2 的克隆及表达分析
王静 刘仑 杨勇 胡圣 李立芹
(1. 四川农业大学作物科学国家级实验教学示范中心,成都 611130;2. 四川农业大学农学院,成都 611130)
植物在非生物胁迫和生物胁迫下会导致细胞活性氧(Reactive oxygen species,ROS)过量的积累,过量的ROS 积累会非特异性的损害细胞组分,包括细胞核、核酸、蛋白质以及光合色素等,在生物体内抗氧化酶可以清除活性氧,维持细胞内ROS 平衡,在抗氧化物酶中POD 起着关键的作用[1]。在植物中广泛存在过氧化物酶,且具有多种功能[2]。过氧化物酶是多基因家族酶类,参与植物多种代谢途径,如植物的抗旱、抗盐、抗寒等多种抗逆功能[3-5]。烟草是中国非常重要的经济作物,烟草的产量与品质受到盐碱、冷害以及干旱等非生物胁迫的影响,因此在分子水平上研究POD 对提高烟草非生物胁迫耐逆性具有重要意义。
POD 是广泛存在于植物中的氧化还原酶,在植物生长发育和应激反应中发挥着重要的作用,是植物重要的保护酶类,最常见的是第Ⅲ类分泌过氧化物酶(Secretory peroxidase,POD),其功能是催化去除H2O2,参与木质部合成和降解、还原剂氧化和植物形态的形成,并参与环境胁迫相应[6-9]。目前,研究表明,POD 家族基因与植物生长发育有关,如植物木质素聚合、栓化作用、细胞壁结构蛋白的交联等[10-11]。在许多植物中POD 的作用都有过报道,而最主要的作用是利用H2O2为底物来参加各种还原物质的氧化。ROS 是植物在胁迫刺激下产生的,并被POD 还原为H2O 和O2,因此POD 是植物非生物胁迫下清除ROS 的关键酶。Sierla 等[12]研究表明,在植物胁迫下,POD 活性增加,且参与了胁迫途径调控。Kumar 等[13]和Neill 等[14]研究表明,植物中的ROS 可以被POD 部分清除。目前,植物中POD 基因研究取得了很大进展,在山楂、水稻、小麦等多种植物中成功克隆POD 家族基因[15-17]。但植物中POD 与ROS 具体作用机制仍不明确。
本研究成功克隆到过氧化物酶家族基因NtPOD2,预测NtPOD2编码蛋白结构与功能,同时运用荧光定量测定NtPOD2在烟草各个组织中表达水平,以及在非生物胁迫处理下的表达模式,为进一步研究POD 基因在烟草中与ROS 作用机制提供科学依据。
1 材料与方法
1.1 材料
挑选饱满均一的普通烟草(K326)种子,消毒(75%乙醇和20%NaClO),反复用无菌水清洗,播种于MS 培养基培养2 周,取大小均匀的幼苗进行ABA、H2O2、干旱、低温、低钾及高盐胁迫处理,每项处理设置3 次重复,分别在0、3、6、12 和24 h 共5 个时间点整株取样。ABA 与H2O2非生物胁迫具体处理方法参照张雪薇等[18]。
1.2 方法
1.2.1NtPOD2的 克 隆 用Primer 5.0 软 件 设 计NtPOD2引 物NtPOD2-F 和NtPOD2-R( 表1)。 以烟草叶片为材料,提取RNA,按照反转录试剂盒步骤进行反转录合成cDNA,将cDNA 稀释10 倍进行PCR 扩增,PCR 反应程序为95℃ 5 min;95℃ 30 s,55℃ 30 s,72℃ 3 min,35 个循环。1%琼脂糖凝胶电泳检测,回收目的片段,将其与pMD19-T载体连接,转化,在含有Kn 的LB 固体培养基进行涂板,过夜培养后,挑取3 个单克隆菌落进行测序。

表1 引物序列
1.2.2 生物信息学分析 参照王静等[19]方法进行NtPOD2的生物信息学分析。
1.2.3 烟草NtPOD2的表达分析 采用Primer 5.0 设计荧光定量引物,烟草18SrRNA为内参,引物序列为18S-F 和18S-R(表1)。每个样品重复4 次,结果分析参考王静等[19]方法。
1.2.4 构建过表达载体 重组克隆载体NtPOD2-pMD19-T 与表达载体pBI121 酶切反应,NtPOD2-pMD19-T 进行37℃双酶切,酶切体系为10×T Buffer、1 μL;XbaⅠ 0.5 μL、SmaⅠ 0.5 μL、载 体3 μL 和ddH2O 5 μL。酶切过后产物与pBI121 载体16℃连接过夜,连接后产物转化DH5α 大肠杆菌感受态,在涂有Kn 的LB 培养基平板式上筛选,挑取单克隆菌株摇菌并送去测序公司进行测序,检测是否构建成功。
2 结果
2.1 NtPOD2的克隆
以烟草叶片cDNA 为模板进行PCR 扩增,获得一条大小为750-1 000 bp 条带。经回收和测序,片段大小为897 bp(图1)。
2.2 NtPOD2-pBI121过表达载体的构建
通过对NtPOD2-pMD19-T 质粒进行双酶切和测序,结果一致,目的片段大小为897 bp(图2)。
2.3 NtPOD2蛋白序列生物学分析
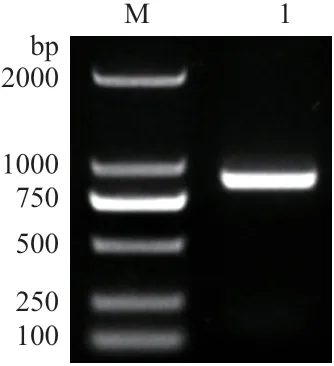
图1 NtPOD2 的克隆

图2 NtPOD2-pBI121 重组质粒酶切
对NtPOD2 蛋白进行生物学分析,理化性质分析结果表明,NtPOD2 蛋白分子量为32.55 kD,等电点为5.78,不稳定系数为37.72。疏水性分析结果显示该蛋白属于亲水性蛋白(图3)。NCBI 在线分析NtPOD2 蛋白保守功能域(图4),该蛋白属于Class Ⅲ型分泌性过氧化物酶。采用SMART 和Scan Prosite 分析NtPOD2 蛋白理化性质,结果为NtPOD2 蛋白含有6 个蛋白激酶C 磷酸化位点(67-69 SeK;70-72 TaR;77-79 SaR;183-185 TfR;200-202 SqR;235-237 SkK)、1 个N-糖基化位点(75-78 NNSA)、5 个酪氨酸激酶Ⅱ磷酸化位点(89-92 SevD;101-104 ScaD;183-186 TfrD;192-195 TniD;209-212 SggD)、1 个氨基化位点(126-129 lGRR)、1 个依赖于cAMP 和cGMP 的蛋白激酶磷酸化位点(128-131 RRdS)。NtPOD2 蛋白信号肽预测结果显示,NtPOD2 蛋白不存在信号肽,定位在细胞质中的概率最大(0.65)。二级结构分析表明,NtPOD 蛋白二级结构的最大元件为α-螺旋,最小元件为β-转角(图5-A)。三级结构分析结果表明,6个半胱氨酸残基48-53、102-294 和181-206 分别形成3 个保守的二硫键桥(图5-B)。

图3 疏水性分析

图4 保守结构域分析

图5 NtPOD2 编码蛋白的结构预测
2.4 NtPOD2同源性分析
把NtPOD2编码氨基酸序列与绒毛状烟草、美花烟草、番茄、马铃薯以及胡杨POD2通过Dnaman多重序列比对(图6-A),发现NtPOD2 蛋白具有POD 家族典型的结构特征,在N 端都包含peroxidase活性位点GAslLRLhFHDC。把NtPOD2编码氨基酸序列通过Blast 比对,选择不同物种POD2 氨基酸序列下载,通过MEGA5 构建系统进化树(图6-B),结果表明,NtPOD2 蛋白序列与绒毛状烟草POD2 以及美花叶烟草POD2 蛋白序列有较高同源性,分别为99%和94.65%。
2.5 NtPOD2的组织表达分析
采用qRT-PCR 对烟草K326 各个组织进行表达分析,发现NtPOD2在根、茎、叶、花中均有表达,在根中表达量明显高于茎、叶、花(图7-A)。
2.6 NtPOD2在信号分子处理下的表达分析
烟草K326 幼苗上在培养皿上用ABA 和H2O2处理,对处理后烟草幼苗NtPOD2表达分析表明,在12 h 之前,ABA 处理下NtPOD2的表达受到抑制,24 h 时受到显著诱导,为对照的3.14 倍(图7-B);H2O2处理的早期,NtPOD2的表达受到强烈诱导,12 h 时上升至最大,为对照的120.67 倍(图7-C)。以上结果表明NtPOD2能够响应逆境胁迫相关的信号分子调控。

图6 NtPOD2 同源性分析
2.7 NtPOD2在逆境胁迫下表达分析
PEG 和低温处理后,该基因分别在12 h 和6 h 时达到最大值,分别为对照的2.48 倍(图8-A)、8.60 倍(图8-B)。低钾处理下,NtPOD2表达量上升,NaCl 处理下该基因下调(图8-C-D)。结果表明,NtPOD2可能参与了PEG、低温等非生物胁迫。
3 讨论
生物信息学分析表明,NtPOD2 蛋白含有3 个二硫键,属于分泌蛋白,含有活性位点(GAslLRLhFHDC),属于典型的Class Ⅲ型分泌性过氧化物酶。信号肽预测显示NtPOD2 蛋白定位在细胞质中,因此该基因可能在内质网加工成熟,进而通过高尔基体运输到细胞质。该蛋白与其他物种Class Ⅲ型分泌性过氧化物酶相比含有相似的保守结构域(6A)以及二硫键桥[20]。该蛋白含有最大元件为α-螺旋,最小元件为β-转角。NtPOD2蛋白以Asp47、Val50、Gly52、Asp54 和Ser56 为中心的Ca2+结合位点构成远端的氧供体结构域,而Thr175、Asp219、Thr221 和Asp226 为 中 心 的Ca2+结合位点构成近端的氧供体结构域,位于这两个结构域中间的血红素则由Fe2+与His46 和His174 形成共价键,构成活性中心。蛋白质空间结构影响其功能,NtPOD2 蛋白特定的空间结构为其发挥功能奠定了基础。同源性分析表明,NtPOD2 蛋白与其他植物POD 蛋白含有较高同源性,其中与美花烟草POD2同源性为99%,可能与美花烟草POD2是POD 家族的同一成员。通过对NtPOD2生物学分析,旨在为研究POD 基因家族奠定基础。

图7 NtPOD2 的不同组织及信号分子处理下的表达模式

图8 NtPOD2 在非生物逆境胁迫下的表达模式
烟草Ntpx在花中表达量最高,银杏GbPOD1和小桐子JcPOD73茎中表达量最高[21-22]。郭媖等[23]从陆地棉中克隆的GhPOD1和GhPOD2,两者相似性达99%,但表达模式相差很大。作为多基因家族的POD基因,具有功能多样性的特点。本研究表明NtPOD2在组织中都有表达,但根中表达最高,而茎、叶、花表达量相对较少,不同植物中POD 基因在不同部位表达模式不同,说明POD 家族基因表达存在特异性。NtPOD2在ABA 处理下,表达量在3 h 先下降,20 h 又上升至最大,约为对照的3.14 倍(图5-B),说明NtPOD2受ABA 诱导。Gao 等[1]研究表明柽柳ThPODs参与非生物胁迫反应(PEG、ABA、NaCl 等),并依赖ABA 信号转导途径。钟新榕等[24]用不同浓度的ABA 处理黄瓜幼苗,POD 活性在短时间内可以提高。Anderberg 等[25]研究结果表明低温胁迫、盐胁迫以及干旱胁迫下,能较短时间内增加植物体内ABA 含量,进而诱导ABA 调控相关基因的表达。司丛丛等[26]研究表明,烟草Ntpx在5%PEG6000胁迫下,Ntpx在最初无明显变化,在6 h 后表达量上调在ABA 和干旱胁迫下,表达量上调。本研究采用10 mmol/L H2O2处理烟草幼苗,NtPOD2的表达受到强烈诱导,12 h 时上升至最大,为对照的120.67 倍。苏亚春等[27]用100 μmol/L ABA 处理甘蔗,结果表明,ScPOD02表达量在3 h 显著增加,500 mmol/L H2O2处理下随着时间的延长,ScPOD02表达量基本不变。而这与苏亚春等在ABA、H2O2处理甘蔗后,ScPOD02表达模式不同,这可能是不同的浓度ABA、H2O2造成的。由此说明NtPOD2可能受干旱、ABA、NaCl、H2O2胁迫诱导,并依赖ABA 信号转导途径进而参加植物生长发育。
在200 mmol/L NaCl 处理下NtPOD2表达量呈现先下降后上升又下降的表达模式,在12 h 表达量达到最大,约为对照1.12 倍。苏亚春等[27]用250 mmol/L 的NaCL 处理下ScPOD02表达量先在6 h 下降,而在12 h 表达量又上升,约为对照的1.91 倍。与苏亚春用NaCl 处理甘蔗后ScPOD02表达模式一致,在6 h 前表达量下降,在12 h 时表达量上升为最大,之后又下降。程华等[21]用200 mmol/L NaCl喷洒银杏幼苗后,POD1表达量降低。Bae 等[11]用200 mmol/L NaCl 处理白杨后PoPOD1基因表达水平下调。低钾胁迫下,NtPOD2受到强烈诱导,NtPOD2表达量上调。王伟等[28]研究表明,大豆在低钾胁迫下,细胞内氧负离子O2-增加,超氧化物歧化酶催化O2-发生歧化反应生成H2O2-含量增加,进而引起过氧化物酶活性上升。在低温胁迫下,NtPOD2在6 h 表达量达到最大,在12 h 后又降低。Guo 等[29]在4℃条件下处理柽柳叶和根,叶中ThPOD1表达量在6 h 强烈诱导后又逐渐下降,根ThPOD16 h 强烈诱导后在24 h 达最大值后又下降。外源基因的表达增加宿主细胞的耐受性,植物受到生物胁迫以及非生物胁迫下,可以引起活性氧产生,进而破坏细胞稳态以及防御机制[30-31]。由此说明烟草NtPOD2,在不同胁迫下表达模式发生改变,以上均说明该基因在生物胁迫以及非生物胁迫中发挥着重要作用,由此推测,NtPOD2参与生物胁迫与非生物胁迫,可能引起活性氧的改变,进而参与植物生理调控与防御机制。
4 结论
NtPOD2可能通过ABA 信号通路来参与生物胁迫以及非生物胁迫。

