婴儿源动物双歧杆菌消化道胁迫抗性及体外对免疫细胞活性影响的比较
万 峰,孙思睿,侯雨佳,赵 桉,张 晟,孟祥晨*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
双歧杆菌是人体肠道菌群的重要组成部分,其数量与人体健康状况密切相关。目前,大量的科学实验已经证明双歧杆菌具有多种促进健康和预防疾病的益生及保健作用,如维持肠道菌群平衡、增强免疫系统、抗肿瘤、控制内毒素产生、降低血清胆固醇、延缓机体衰老及促进维生素代谢等作用[1-2],被广泛应用于乳制品和微生态制剂生产中。含双歧杆菌的功能性食品已成为当前许多国家优先研究和发展的领域,旨在调整微生态平衡,预防肠道疾病,促进人体健康。
双歧杆菌发挥益生作用的前提是以一定数量的活菌定植于肠道内[3]。被摄食后,双歧杆菌会面临胃酸、胆汁酸及各种蛋白酶的胁迫。因此,能够耐受肠道内环境并在肠道定植的优良双歧杆菌对于应用具有重要现实意义。在众多益生作用中,免疫调节功能及机理一直备受关注,作为天然存在于结肠的优势菌群,双歧杆菌的种类和数量变化直接或间接影响机体的免疫功能。双歧杆菌一般通过黏附作用定植于肠道内,与宿主细胞相互交流作用,进而影响肠道菌群结构和免疫功能状态。因此,有学者认为双歧杆菌的黏附能力是决定免疫调节活性的重要因素之一,可作为前期筛选或评价免疫性能的重要指标[4];在体外研究中,常通过对免疫细胞的影响探讨其免疫调节活性。
本研究以从3~6 个月健康婴儿粪便自行分离鉴定的4 株动物双歧杆菌乳亚种作为实验菌株,比较其耐受性及黏附性能,并进一步分析具有优良抗性和黏附性能的双歧杆菌的免疫细胞调节活性。本实验旨在获得具有优良性能及潜在益生特性的双歧杆菌,为后续研究菌株的功能性成分及开发益生菌制品提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与细胞株
4 株动物双歧杆菌乳亚种H15-2、H20-9、H27-9、H34-21,动物双歧杆菌BB12作为参考菌株。均保藏于东北农业大学乳品科学教育部重点实验室。
Caco-2细胞株购自中国科学院上海细胞库。
1.1.2 培养基与试剂
改良MRS(mMRS)培养基:蛋白胨5 g/L,牛肉膏5 g/L,胰蛋白胨10 g/L,酵母浸粉5 g/L,葡萄糖20 g/L,乙酸钠5 g/L,吐温-80 1 g/L,柠檬酸氢二铵2 g/L,K2PO42 g/L,MgSO4·H2O 0.58 g/L,MnSO4·H2O 0.25 g/L,L-半胱氨酸盐酸盐0.5 g/L。
细胞培养基:在完全培养基DMEM中添加10%胎牛血清及1%青链霉素混合液。0.22 μm滤膜过滤除菌,4 ℃备用。
牛胆盐、α-淀粉酶、胃蛋白酶、胰蛋白酶 美国Sigma公司;胎牛血清 加拿大Wisent公司;抗生素、Cell Counting kit-8(CCK-8)试剂盒 北京索莱宝科技有限公司;Trypsin-EDTA 美国Gibco公司;与细胞培养相关的产品均购自美国Corning公司;刀豆蛋白ConA、中性红 上海Biosharp公司;其他试剂均为国产生化分析纯。
1.1.3 实验用小鼠
小鼠购自哈尔滨医科大学附属第二医院研究院实验动物中心,为6~8 周龄的雌性BALB/c小鼠,体质量约为19~21 g,清洁级。饲养室温度为(23±2)℃,每天人工灯光照明12 h,标准饲料喂养,自由饮水。
1.2 仪器与设备
厌氧培养箱 美国Thermo Electron公司;HF90型二氧化碳培养箱 中国香港力康发展有限公司;UV-2401PC型紫外分光光度计 日本岛津公司;BA300型倒置显微镜 厦门麦克奥迪实业集团有限公司;冷冻高速离心机 上海市离心机械研究所;GI54DWS型灭菌锅 厦门致微仪器有限公司;Model 680型酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 菌株的活化
取-20 ℃保藏的双歧杆菌置于室温融化,以融化液的3%接种于mMRS液体培养基中,37 ℃厌氧培养18~20 h。经连续2~3 代液体培养,保证菌株的活力,方可进行实验。
1.3.2 耐受性实验
1.3.2.1 对酸和胆盐的耐受性
参考文献[5]所述方法略作修改。将离心洗涤后的菌体分别重悬在pH 2、pH 3的磷酸盐缓冲液及质量浓度为3 g/L胆盐溶液中。酸耐受实验在孵育0、1、3 h取样,胆盐耐受实验在0、3 h取样。存活率表示为孵育不同时间活菌数对数值与0 h时活菌数对数值的百分比。
1.3.2.2 对模拟消化道环境的耐受性
采用本实验室自行设计配制的消化液,体外模拟菌体经历消化道的过程[6]。按1.3.2.1节方法计算存活率。
1.3.3 黏附性实验
1.3.3.1 菌株对Caco-2细胞的黏附实验
细胞活化培养及实验参考文献[7]所述方法,通过计算每孔中黏附菌数与初始菌数的比值评价黏附能力的大小。
1.3.3.2 菌株对病原菌黏附Caco-2细胞的影响
分别采用竞争实验、排斥实验、替代实验研究菌株对致病菌(大肠杆菌ATCC 25922及鼠伤寒沙门氏菌ATCC 14028)黏附Caco-2细胞的抑制作用。具体方法参照文献[8],通过计算每孔中未黏附到细胞的致病菌数与初始致病菌数的比值评价抑制黏附能力的大小。
1.3.4 菌株产胞外多糖含量的测定
1.3.4.1 标准曲线的绘制
标准曲线绘制方法参考文献[9]。取2 mL各溶液于具塞试管中,加6%苯酚溶液1 mL摇匀,迅速加入浓硫酸5 mL,于490 nm波长处测定吸光度,得标准回归方程为:y=0.013 7x-0.005(R2=0.996 4)。y表示吸光度,x表示葡萄糖质量浓度(mg/L)。
1.3.4.2 多糖含量的测定
参考文献[10]略作修改。将活化后的菌体接种至10 mL液体mMRS培养基中,100 ℃加热灭酶15 min,加入1.7 mL质量分数为80%的三氯乙酸溶液,12 000×g离心20 min收集上清液,加入2 倍体积95%冷乙醇溶液,4 ℃过夜离心取沉淀,蒸馏水溶解沉淀物,4 ℃透析48 h,苯酚-硫酸法测定胞外多糖含量。
1.3.5 菌株对免疫细胞活性的影响
1.3.5.1 脾淋巴细胞增殖实验
脾淋巴细胞制备参照文献[11]所述,最终调整细胞的浓度为2×106个/mL。在96 孔板中加入180 μL/孔的脾淋巴细胞悬液,每孔再加入20 μL 106、107、108CFU/mL的双歧杆菌(即菌数-细胞数分别为1∶1、10∶1、100∶1)作为实验组;空白对照组为200 μL细胞培养液;阴性对照组为180 μL脾淋巴细胞悬液加入20 μL细胞培养液;阳性对照组为180 μL的脾淋巴细胞悬液加入5 μg/mL ConA;双歧杆菌对照组为180 μL的细胞培养液加入20 μL上述不同浓度的菌悬液。CCK-8法测定淋巴细胞增殖活性[12]。脾淋巴细胞转化值和增殖指数见式(1)、(2):

式中:OD1、OD2、OD3、OD4分别为实验组、阴性对照组、双歧杆菌对照组、阳性对照组在酶标仪450 nm波长处的OD值。
1.3.5.2 腹腔巨噬细胞能量代谢水平的测定
巨噬细胞制备参照文献[13]所述。在96 孔板中加入100 μL/孔的巨噬细胞悬液,置37 ℃、5% CO2的培养箱中培养4 h使其完全贴壁后,用磷酸盐缓冲液洗去未贴壁细胞。参照1.3.5.1节加样及测定,以OD值表示腹腔巨噬细胞能量代谢水平。
1.3.5.3 腹腔巨噬细胞吞噬中性红能力的测定
参照1.3.5.2节得到巨噬细胞后,按1.3.5.1节向每孔中加入100 μL不同浓度的菌悬液,阴性对照加入100 μL细胞培养液,于37 ℃、5% CO2的培养箱中培养24 h。吸去上清液并在每孔加入100 μL中性红溶液,按照文献[14]所述方法测定其吞噬能力。
1.4 数据分析
2 结果与分析
2.1 4 株动物双歧杆菌的耐受性
2.1.1 耐酸及胆盐的能力
在不同pH值条件下,4 株动物双歧杆菌存活率均差异显著(P<0.05)(表1),随孵育时间的延长,活菌数逐渐下降。在pH 3条件下孵育3 h,除H27-9外,其余菌株存活率均在60%以上,其中H15-2(90.19%)的存活率显著高于其他3 株菌(P<0.05)。当在酸性更强的pH 2环境中孵育1 h后,4 株菌的存活率均大于60%,而孵育3 h后,除对照株BB12(57.31%)外,实验菌株均检测不到活菌。在质量浓度为3 g/L胆盐溶液中孵育3 h后,菌株存活率均大于60%,菌株H15-2(94.84%)存活率显著高于其他受试菌株及对照株(P<0.05)。

表1 动物双歧杆菌在酸性及胆盐条件下的存活率Table 1 Survival rates of B. animalis under acid and bile salt stress%
2.1.2 耐受模拟消化道环境的能力
为更好地模拟消化道环境,制备模拟口腔、胃液、肠液的消化液,如图1所示,菌体在经历模拟唾液5 min、模拟胃液2 h、模拟肠液2 h的过程中,活菌数不断下降,最终存活率仍保持在90%以上,表现出对模拟消化道环境较好的耐受性,但均显著低于对照菌株BB12(P<0.05)。受试的4 株菌中,H15-2(93.69%)的耐受性显著高于其他3 株菌(P<0.05)。3 种模拟消化液中,模拟唾液对菌体存活影响较小,后两种消化液的影响更为显著。

图1 4 株动物双歧杆菌经模拟消化道环境后的存活率Fig. 1 Survival rates of four B. animalis after being exposed to simulated digestive tract environment
2.2 4 株动物双歧杆菌的黏附力
2.2.1 对Caco-2细胞的黏附能力
双歧杆菌的黏附能力是衡量其能否定植于肠上皮细胞进而发挥益生作用的重要指标。图2表明,4 株双歧杆菌中,仅H34-21的黏附率(1.31%)显著低于其他3 株菌(P<0.05),其余3 株菌的黏附率均大于或接近20%,与BB12(21.65%)无显著性差异(P>0.05),表现出较好的黏附能力,其中H15-2的黏附率高达27.59%。
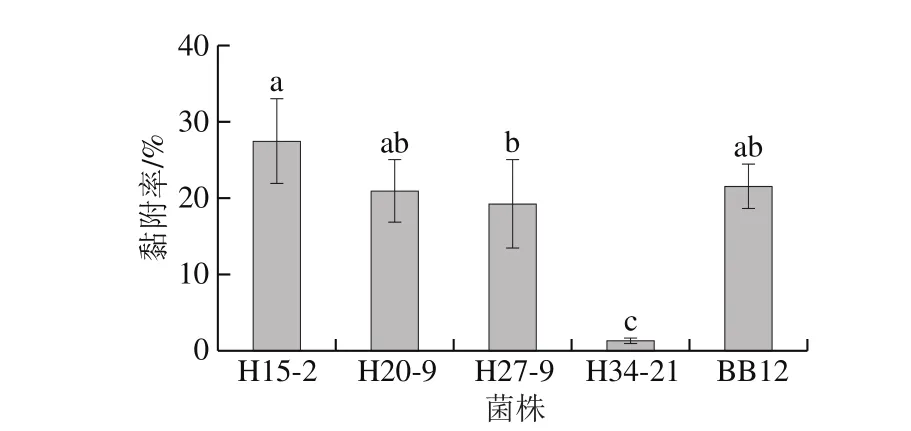
图2 4 株动物双歧杆菌对Caco-2细胞的黏附能力Fig. 2 Adhesion capacities of four B. animalis to Caco-2 epithelial cells
2.2.2 对致病菌黏附Caco-2细胞的影响
4 株受试菌对两株致病菌黏附Caco-2均有不同程度的抑制作用(表2),除H27-9及H34-21外,其他菌株对沙门氏菌的黏附抑制作用强于大肠杆菌。在3 种作用方式中,排斥作用>竞争作用>替代作用。菌株BB12对两种致病菌的黏附抑制率显著高于4 株受试菌(P<0.05)。在竞争和排斥实验中,H20-9、H27-9对两种致病菌显示出了明显的抑制效果;在替代实验中,H27-9、H15-2对沙门氏菌有较好的抑制作用。
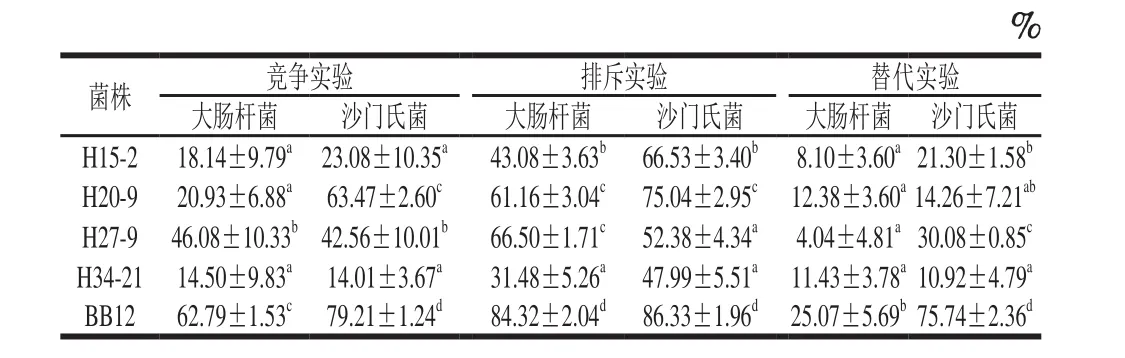
表2 4 株动物双歧杆菌对致病菌黏附Caco-2细胞的抑制率Table 2 Inhibition rates of four B. animalis against adhesion of pathogenic bacteria to Caco-2 cells
2.3 4 株动物双歧杆菌产胞外多糖能力
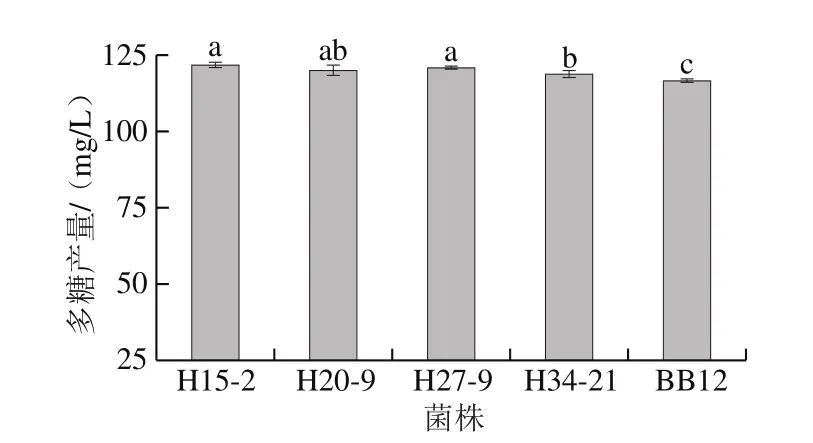
图3 动物双歧杆菌胞外多糖的产量Fig. 3 EPS production of B. animalis
所有菌株均能合成胞外多糖且多糖产量均超过100 mg/L(图3)。4 株受试菌产胞外多糖能力均显著高于对照菌株BB12(P<0.05),表现出较强的产胞外多糖能力,其中H15-2胞外多糖产量最高,达到121.87 mg/L。
2.4 动物双歧杆菌H15-2对免疫细胞活性的影响
2.4.1 对小鼠脾淋巴细胞增殖的影响
根据黏附及胁迫抗性实验结果,选择动物双歧杆菌H15-2进行体外免疫活性实验,淋巴细胞转化值可以直接反映淋巴细胞的活性大小,是衡量T淋巴细胞免疫功能的重要指标之一[15]。实验结果表明,脾淋巴细胞转化值随受试菌浓度增大而增加,表现出明显的剂量依赖关系(图4A)。当菌数-细胞数比例为10∶1及100∶1时,菌株H15-2对淋巴细胞的转化值显著高于阳性对照组ConA(P<0.05),表明H15-2可以调节脾淋巴细胞活性且在菌数大于107CFU/mL时效果更好。
淋巴增殖指数可以衡量菌体对脾淋巴细胞增殖作用的影响,即增殖指数大于1时表示促进增殖,增殖指数小于1时表示抑制增殖[16]。发现只有当H15-2菌体浓度为108CFU/mL时,脾淋巴细胞的增殖指数大于1且显著高于阳性对照(P<0.05)(图4B),表明H15-2具有促进脾淋巴细胞增殖的作用。

图4 动物双歧杆菌H15-2对脾淋巴细胞转化值(A)和淋巴增殖指数(B)的影响Fig. 4 Effects of B. animalis H15-2 on transformation of splenic lymphocytes (A) and proliferation index (B)
2.4.2 对腹腔巨噬细胞能量代谢水平的影响
腹腔巨噬细胞能量代谢水平与H15-2菌体浓度表现剂量依赖关系(图5),当菌体与巨噬细胞的比例为10∶1及100∶1时,巨噬细胞能量代谢水平显著高于阳性对照组ConA(P<0.05)。表明动物双歧杆菌H15-2可以调节巨噬细胞活性并促进其增殖,提高其能量代谢水平。
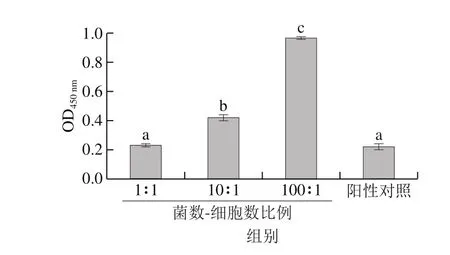
图5 动物双歧杆菌H15-2对腹腔巨噬细胞代谢能量水平的影响Fig. 5 Effect of B. animalis H15-2 on energy metabolism level in macrophages
2.4.3 对巨噬细胞吞噬中性红能力的影响
通过巨噬细胞吞噬中性红的方法评价双歧杆菌H15-2对巨噬细胞吞噬作用的影响,OD570nm值越高表示巨噬细胞的吞噬能力越强。当H15-2菌数-细胞数比例为10∶1及100∶1时,可以明显提高巨噬细胞的吞噬作用(P<0.05)(图6),表明H15-2能够提高巨噬细胞活性,增强其吞噬功能,且吞噬能力与菌体数量呈剂量依赖关系。

图6 动物双歧杆菌H15-2对腹腔巨噬细胞吞噬能力的影响Fig. 6 Effect of B. animalis H15-2 on phagocytic activity of peritoneal macrophages
3 讨论与结论
国际粮农及世界卫生组织[17]建议,益生菌在应用前必须经过一系列实验评价以确保其到达肠道之后具有较高的存活率和定植能力进而发挥益生功能。在其建议的体外实验中,特别强调对人工模拟消化道胁迫环境(胃酸和胆汁盐)的耐受力以及对肠黏膜的黏附能力。因为黏附是益生菌发挥益生作用的先决条件,抵御消化道胁迫环境能力是其存活的保证。
双歧杆菌被人体摄入后面临高胃酸和高胆盐环境。一般来说,胃液的pH值在3左右,但受饮食影响会有较大波动,极少情况下会达到2以下,小肠中胆盐占0.03%~0.3%左右,食物通过胃的时间为1~2 h,通过小肠的时间则较短[18]。由于体内实验的复杂性和困难性,国内外研究大多集中于酸胁迫、胆盐胁迫等单一因素评价菌株对消化道环境的抗性进而筛选出耐受力较强的菌株。Matsumoto等[19]分析了9 种双歧杆菌的耐酸性,研究发现长双歧杆菌、青春双歧杆菌耐酸性较差,在pH 3条件下处理1 h活菌数显著降低,pH 2条件下处理1 h无活菌检出。与此结果相比,本实验的4 株动物双歧杆菌对酸有更好的耐受能力,经pH 3和pH 2条件下孵育1 h后,仍有超过80%和60%的存活率,这可能是由于不同菌种间的差异造成的,Margolles等[20]报道动物双歧杆菌较其他双歧杆菌具有更强的耐酸能力。相似地,Charnchai等[21]从婴儿粪便分离出的4 株动物双歧杆菌在3 g/L质量浓度胆盐中孵育4 h后,菌株存活率在84%~90%之间。而本研究的菌株在相同胆盐质量浓度下处理3 h后存活率均大于60%,其中H15-2的存活率高达94.84%。此外,研究表明双歧杆菌的耐酸机制主要与F0F1-ATPase酶活性有关,而具有胆盐耐受力的菌株与其胆盐水解酶、表层蛋白、细胞膜脂肪酸的构成、胞外多糖等有关[20]。由此可见,本实验的4 株动物双歧杆菌均具备较好的耐酸、耐胆盐能力。
本实验除考虑菌株对酸及胆盐的耐受性外,还通过体外连续模拟消化道环境评价其耐受性。由于消化道是一个完整体系并且其中存在各种消化酶,因而较单纯的酸性及胆盐环境,连续模拟消化道环境更能反映菌体通过肠道的真实情况。李军等[22]通过连续模拟胃液、十二指肠液、小肠液观察动物双歧杆菌RH对整个消化道逆环境的耐受性,存活率依次为90%、76%、73%;Madureira等[23]采用体外连续4 步模拟消化道(口腔、胃、十二指肠、回肠)评价菌株的耐受能力,动物双歧杆菌活菌数对数值仅下降1 个数量级。本实验室自行设计的连续模拟消化道环境与这些实验类似,但本实验的4 株动物双歧杆菌在历经模拟消化道后仍有90%的存活率,且活菌数对数值下降不到1 个数量级,H15-2存活率高达96.7%,这表明本实验4 株动物双歧杆菌具有较强的抗消化道胁迫能力。较单纯的酸性环境,菌株在模拟消化道环境中的存活率更高,这可能是由于蛋白酶的存在降低了酸性环境的极化程度,从而在一定程度上保护了菌体细胞[24]。而胃液较肠液对菌株的影响更为显著主要是因为pH值对菌体存活影响更为显著。由于条件限制,本方法未能模拟胃肠蠕动及pH值的动态变化,有一定缺陷和不足,但仍可作为前期筛选耐受性优良菌株的重要依据。
双歧杆菌经口摄入人体后,除能够经历消化道胁迫环境以较高活菌浓度进入肠道,还要具备较好的黏附定植能力,才能发挥其最大的生理活性。黏附是细菌与宿主细胞相互作用的第1步,也是细菌定植的必要条件。早期研究表明,使用Caco-2细胞体外评价双歧杆菌黏附能力的结果与体内黏附肠上皮细胞水平有一定的相关性[25]。Xu等[26]测定了8 种益生菌的表面性质及对Caco-2细胞的黏附性能,黏附率最高的为鼠李糖乳杆菌LGG(23.2%),其次是长双歧杆菌(20%);Arboleya等[27]采用荧光标记法分析了来源于母乳中的双歧杆菌对人肠黏膜的黏附能力,其中长双歧杆菌的黏附率高达50%。与Xu等[26]所应用的菌株比较,本实验的双歧杆菌H15-2的黏附率高于商业菌株LGG和BB12,可达27%,具有较强的黏附性能。而相较Arboleya等[27]的实验,H15-2的黏附能力略差,这主要是由于Arboleya等[27]采用荧光标记法评价黏附能力,该方法可以反映死菌对细胞的黏附情况;而本实验则采用了平板菌落计数法,评价的是存活菌体的黏附。由此可见,黏附模型不同,菌株生境来源以及种属不同,双歧杆菌的黏附能力存在较大差异[28]。目前,关于双歧杆菌的黏附机理尚未完全清楚,大部分学者认为,双歧杆菌发挥其黏附功能大多与其表面的脂磷壁酸、多糖和表层蛋白等有关[29]。
此外,双歧杆菌黏附能力与对病原微生物的黏附抑制作用密切相关,这是由于具有较好黏附能力的菌株可以通过竞争黏附受体、争夺营养物质、产生抑菌物质、增强免疫应答等方式抑制肠道致病菌的黏附[30]。本研究中的4 株动物双歧杆菌可以通过竞争、排除和替换方式抑制致病菌的黏附,从而起到保护宿主细胞的作用,菌株H20-9和H27-9对沙门氏菌和大肠杆菌黏附抑制率最高可分别达75.04%和66.5%。Candela等[31]采用实时荧光定量聚合酶链式反应法研究了4 种益生菌对肠道致病菌沙门氏菌和大肠杆菌黏附Caco-2细胞的影响,结果显示所有菌株对沙门氏菌的黏附抑制率均高于大肠杆菌,本实验中2 株菌(H15-2和H20-9)与其结果类似,另2 株菌则表现出相反的结果。Candela等[31]实验的1 株动物双歧杆菌对沙门氏菌及大肠杆菌黏附抑制率分别达88%和44%,本实验4 株动物双歧杆菌对两者的抑制率分别在10%~75%和8%~67%之间,相比较,本实验中的动物双歧杆菌对沙门氏菌抑制效果略差,但部分菌株(H27-9、H20-9)对大肠杆菌的抑制效果较好。这种差异一方面源于菌株的不同,另一方面是由于评价方法不同,实时荧光定量聚合酶链式反应法反映死、活菌体对细胞的黏附,而平板计数法只能反映活菌体的黏附。
作为益生菌分泌的一种生理活性物质,胞外多糖被认为与菌体对消化道环境耐受性、肠黏膜黏附力及免疫调节活性等具有相关性。Hidalgocantabrana等[32]报道高产胞外多糖的双歧杆菌能增加其在胃肠道的抗性,Ruasmadiedo等[33]实验结果则表明胞外多糖的存在可以增加益生菌对肠黏膜的黏附性。本实验中,胞外多糖最高的H15-2同样具有最强的耐受性和黏附能力,推测三者可能具有一定的关联性,但耐受性较强的BB12胞外多糖产量却最低。因此,本研究胞外多糖合成相关结果与其他实验结果的相关性并不明显,且具体对耐受性及黏附性的贡献度尚未得知,需要更加深入研究其机制以证实三者间的联系。此外,有研究指出与消化道逆环境耐受能力高度相关的多糖为荚膜多糖[34],而本实验测得粗多糖为黏液多糖,因此仍需要进一步实验探究其相关性。双歧杆菌合成胞外多糖的量通常较低,一般平均在每升几十到几百毫克不等[35]。本实验的4 株动物双歧杆菌胞外多糖平均产量在120 mg/L左右,显著高于对照株BB12。双歧杆菌的胞外多糖还具有抗肿瘤、免疫调节、降低胆固醇等作用[36],可作为前期筛选具有益生特性菌株的重要指标之一。
体外评价双歧杆菌的免疫调节作用,大多采用机体主要的免疫细胞,如脾淋巴细胞、巨噬细胞等反映益生菌对免疫功能的影响。淋巴细胞可以反映细胞免疫功能的强弱,而巨噬细胞则在非特异性免疫应答中发挥重要作用[37]。李艾黎等[16]发现无论是活性乳杆菌还是热致死乳杆菌对于小鼠脾淋巴细胞增殖均有一定的促进作用,这种作用表现出明显的剂量依赖关系。在此基础上,将双歧杆菌的剂量提高10 倍(即细菌数-细胞数比例为100∶1),发现具有良好耐受性及黏附性的双歧杆菌H15-2对淋巴细胞和巨噬细胞增殖都有明显促进作用,在一定程度上可以增强巨噬细胞的吞噬能力,对两种免疫细胞的调节效果呈现剂量依赖关系。而范志红等[38]研究则表明高浓度的菌体(>109CFU/mL)对巨噬细胞活性有抑制作用,但具体原因尚不清楚,且益生菌到达肠道前活菌数仍会有损失,因此本实验仅限于体外研究,在体内具体的有效剂量仍需进一步探索研究。目前,对于双歧杆菌免疫调节作用机理的研究还不透彻,但普遍认为双歧杆菌菌体表面成分,如肽聚糖、脂磷壁酸、表层蛋白等,或分泌至菌体外的可溶性物质,如抗菌物质、胞外多糖及分泌蛋白等,能通过M细胞进入集合淋巴结,激活T细胞和B细胞,从而调节和增强机体的免疫力[39]。
综上所述,动物双歧杆菌H15-2具有良好的耐受性、黏附力及产胞外多糖能力,并且具有潜在的免疫调节作用,可作为具有益生功能的菌株进行深入研究和开发。

