大肠杆菌ptsG基因缺陷菌株的构建及其发酵混合糖产L-丙氨酸
潘海亮,王 灿,赵 筱,王永泽,王金华*
(湖北工业大学 生物工程与食品学院 发酵工程教育部重点实验室,湖北 武汉 430068)
L-丙氨酸是人体一种非必需氨基酸,在日化、食品和医药等领域有着广泛的应用,可以用作甜味剂、营养液和蛋白质合成原料[1]。据研究,L-丙氨酸在工业塑料领域上有着巨大的商业价值[2]。目前L-丙氨酸主要以葡萄糖为原料进行发酵而获得,这就意味着每年需要大量的小麦或玉米等粮食作物用于生产丙氨酸,这是与人争粮的不利局面。
木质纤维素在地球广泛存在且可再生,其水解液中含有大量的五碳糖和六碳糖,其中主要为木糖和葡萄糖[3]。以廉价的木质纤维素糖源为原料进行发酵生产是近来的研究热点,其关键是解除发酵中葡萄糖对其他碳源产生的分解碳代谢物阻遏效应(carbon catabolite repression,CCR)[4],即葡萄糖效应(glucose effect,GE)。解除葡萄糖效应使大肠杆菌能同时利用葡萄糖和木糖进行生物制造的相关研究已有报道。采用菌株选育或混菌发酵方式可有效缓解葡萄糖效应,如CORDARO J C等[5]利用磷霉素从大肠杆菌野生菌中筛选出了不通过糖类磷酸转移酶系统(phosphatase transporter system,PTS)转运糖类的菌株[6],乙醇产量提高了20%;EITEMAN M A等[7]通过在培养基中加入两种分别只利用葡萄糖和木糖的大肠杆菌来生产乳酸,完全避免了葡萄糖效应。而采用工程菌构建方式,直接将PTS途径相关基因进行突变被认为是目前解除葡萄糖效应的主要途径之一[8]。通过敲除PTS转运系统中葡萄糖转运酶基因(glucose transporters gene,ptsG)来增强大肠杆菌对混合糖的利用,已广泛利用于聚羟基脂肪酸酯[9]、琥珀酸[10]、乙醇[11]和D-乳酸[12]等产物的发酵之中,并取得了不错的效果。如本实验室构建的ptsG基因缺陷菌株E.coliSZ470P能同时利用葡萄糖和木糖发酵产乙醇,产量提高了14.32%[11],构建的ptsG缺陷菌株E.coliJH-15也能同时利用木糖和葡萄糖[12],且D-乳酸产量提高了25.86%。
本研究在前期获得了一株高产丙氨酸(糖酸转化率>95%)的工程菌株基础上,基于利用混合糖发酵丙氨酸的目的,拟通过Red同源重组(Red homologous recombinatioin)技术[13]构建ptsG基因缺陷菌株,以减弱混合糖发酵丙氨酸时的葡萄糖效应从而提高发酵效率,为利用木质纤维素这种可再生的原料生产丙氨酸提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
出发菌为大肠杆菌(Escherichiacoli)基因工程菌JH-B2[2](ΔfrdBC,ΔadhE,Δpta,ΔpflB::alaD),可以高效利用葡萄糖和木糖产丙氨酸,由本实验室前期构建并保存;E.coliJH-B3是通过Red同源重组技术获得的ptsG基因缺陷菌株。质粒pKD4含有包含了硫酸卡那霉素(kanamycin,Kan)抗性基因的FRT-kan-FRT阅读框和氨苄青霉素(ampicillin,Amp)抗性基因,pKD46包含编码Red重组系统的基因和Amp抗性基因[14],两种质粒均由武汉天一辉远生物技术有限公司购得。实验所需引物均由武汉天一辉远生物技术有限公司合成,引物名称和序列见表1。
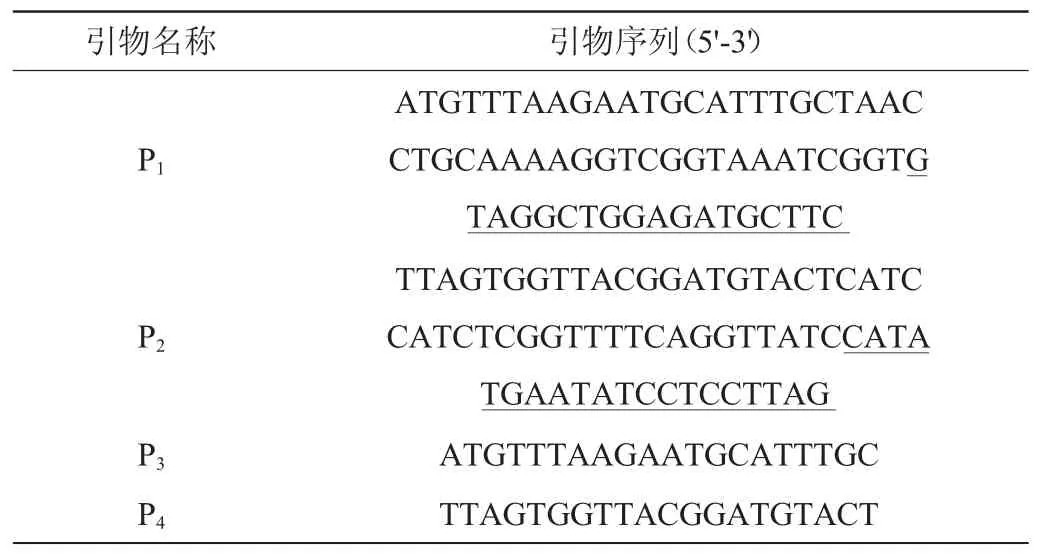
表1 扩增及验证引物Table 1 Primers used for amplification and verification
根据质粒pKD4和ptsG的两侧基因序列设计了扩增引物P1、P2,靠近5'端未加下划线的序列分别与ptsG基因两端序列同源,靠近3'端加下划线的序列分别与质粒pKD4上Kan基因两侧序列互补。又根据扩增引物P1、P2设计了验证引物P3、P4,验证引物序列与扩增引物上ptsG两侧各20 bp序列相同。
1.1.2 化学试剂
CaCl2·2H2O(分析纯)、L-阿拉伯糖(生化试剂)、醋酸钠(分析纯):国药集团化学试剂有限公司;琼脂糖(生化试剂):香港基因有限公司;DL 20000 DNA Maker、PCR Master Mix:美国Fermentas公司;溴化乙锭(分析纯):广州赛国生物科技有限责任公司;10×TE溶液、卡那霉素、氨苄青霉素:浙江Mersco工贸有限公司。
1.1.3 培养基
Luria-Bertabi(LB)培养基:10 g/L蛋白胨,5 g/L氯化钠,5 g/L酵母粉,20 g/L琼脂粉。
卡那抗性筛选培养基:LB固体培养基中加入氨苄青霉素50 mg/L。
种子培养基:LB液体培养基中加入20g/L葡萄糖或木糖。
发酵培养基为LB液体培养基:100 g/L葡萄糖,100 g/L木糖和100 g/L混合糖(50 g/L葡萄糖和50 g/L木糖)。
上述培养基均在121 ℃条件下灭菌20 min。
1.2 仪器与设备
DYY-6C电泳仪:北京六一仪器厂;MTV-12V6HE-R凝胶自动成像仪:美国Major Science公司;My Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪、MicroPulser电转仪:美国Bio-Rad公司;Waters e2695高效液相色谱仪:美国Waters公司;Sartorius BB-8846880发酵罐:德国Sartorius Stedim Biotech公司;SBA-40D生物传感仪:山东省科学院生物研究所。
1.3 方法
1.3.1 大肠杆菌工程菌E.coliJH-B3菌株构建
以pKD4质粒为模板,用扩增引物P1、P2进行聚合酶链式反应(PCR),以获得带有卡那抗性基因的PCR扩增片段,然后用3 mol/L的醋酸钠和体积分数95%的乙醇沉淀和纯化卡那抗性基因PCR扩增片段。PCR扩增体系:无菌水22μL、模板1 μL、引物P1和P2各1 μL、PCR Master Mix 25 μL。PCR反应条件:95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,循环30次。
用CaCl2法[15]将pKD46 转化到E.coliJH-B2 细胞中,经过氨苄青霉素抗性平板筛选后以获得阳性转化子E.coliJH-B2/pKD46,在氨苄平板上纯化2~3代;挑取E.coliJH-B2/pKD46的单菌落至含2%L-阿拉伯糖的LB 液体培养基培养,30 ℃、200 r/min条件下培养至菌液的光密度值(OD600nm值)达到0.5~0.6,将菌液转移至已提前预冷的50 mL离心管中并置于冰上30 min;冰浴后于4 ℃、5 000 r/min条件下离心10 min,去除上清液,用已灭菌的超纯水反复洗涤细胞沉淀4次,最后用转移至1.5 mL预冷的EP管中于4 ℃、5 000 r/min条件下离心10 min,去掉上清液,并用100 μL超纯水重悬;将E.coliJH-B2/pKD46的重悬菌液和10 μL卡那抗性基因PCR扩增片段混合均匀后置于冰上20 min,再转入已预冷的电击杯中,连接电转仪,在2 000 V条件下电击4~5 ms;向电击杯中加入1 mL已预冷的无氯化钠的LB培养基,转移至1.5 mL EP管中,于30 ℃、150 r/min条件下复苏培养3 h;将复苏培养液涂布于含卡那霉素的LB 平板上,于37 ℃恒温条件下培养24 h,筛选阳性转化子命名为E.coliJH-B3。
1.3.2 重组菌株JH-B3的验证
分别以E.coliJH-B2和JH-B3的菌落为模板,用验证引物P3、P4进行PCR 扩增获得片段,然后将两者的PCR扩增片段与卡那抗性基因PCR扩增片段以及20 000 bp DNA Marker进行电泳和凝胶成像,通过比三者条带的大小来验证ptsG基因是否敲除成功。若成功,则在含卡那霉素LB固体培养基(含50 mg/L卡那霉素)的无氧管中将E.coliJH-B3连续培养10代,筛选阳性转化子用于后续发酵实验。
1.3.3 发酵实验
将菌株E.coliJH-B2和JH-B3分别在7 L发酵罐中进行厌氧发酵,碳源依次为10%葡萄糖、10%木糖及10%混合糖(5%葡萄糖+5%木糖),转速恒定在200 r/min,发酵温度恒定在37 ℃,发酵pH恒定在6.80,以26%的氨水为发酵中和剂。每隔固定时长取样,并检测葡萄糖、木糖和丙氨酸含量,对比两种菌株利用葡萄糖和木糖的能力,以及产丙氨酸的能力。每次发酵实验进行3次平行实验,同一发酵时间点的数据视为一组平行数据并取平均值。
1.3.4 分析检测
葡萄糖:采用生物传感仪检测法[16];木糖:采用高效液相色谱分析法。其色谱条件为Bio-Rad HPX 87H色谱柱(300mm×7.8mm),流动相为4mmol/LH2SO4,流速0.4mL/min,柱温45 ℃,检测器为示差检测器[17];
丙氨酸:采用高效液相色谱法。其色谱条件为依利特C18色谱柱(5 μm,4.6 mm×250 mm),流动相为0.05 mol/L的Na2HPO4溶液,用磷酸调节pH至6.5,CH3OH和Na2HPO4溶液体积比为1∶9;流速0.80 mL/min;紫外检测器,检测波长210 nm,温度30 ℃,进样量5 μL[18]。
2 结果与分析
2.1 ptsG基因缺陷菌株JH-B3验证
ptsG基因自身长度约1 434 bp,则以对照菌株E.coliJH-B2为模板通过验证引物P3、P4(约20bp)得到的PCR扩增片段理论大小约为1 434 bp;FRT-kan-FRT阅读框约1 477 bp,则以pKD4质粒为模板通过扩增引物P1、P2(约65 bp)得到的卡那抗性基因PCR扩增片段理论大约为1 567 bp;当利用同源重组将菌株JH-B2上ptsG基因置换为卡那抗性基因PCR扩增片段而获得菌株JH-B3后,再以JH-B3为模板通过引物P3、P4得到的PCR扩增片段理论大小约为1 567 bp,与卡那抗性基因PCR扩增片段相同,并与JH-B2的PCR扩增片段长度相差约133 bp。分别对DNA Maker、JH-B2的PCR扩增片段、JH-B3的PCR扩增片段以及卡那抗性基因的PCR扩增片段进行凝胶电泳和成像,其结果见图1。
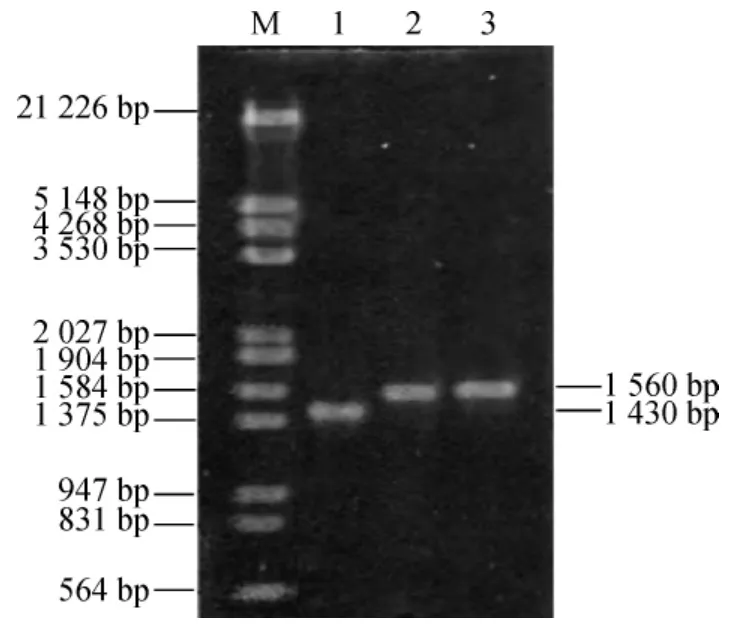
图1 ptsG基因缺陷菌株JH-B3的PCR鉴定Fig.1 Identification of ptsG gene-deficient strain JH-B3 by PCR
由图1可知,经凝胶电泳成像后,JH-B2 的PCR扩增片段大小约1 430 bp,JH-B3的PCR扩增片段和卡那抗性基因的PCR扩增片段大小约1 560 bp,两者基本相同且与JH-B2的PCR扩增片段相差约130 bp,实验结果与理论结果基本一致,由此可知ptsG基因缺陷菌株E.coliJH-B3构建成功。
2.2 两种菌株利用葡萄糖的能力对比
对照菌株JH-B2和ptsG基因缺陷菌JH-B3 在分别以10%葡萄糖为碳源下发酵产丙氨酸情况见图2。
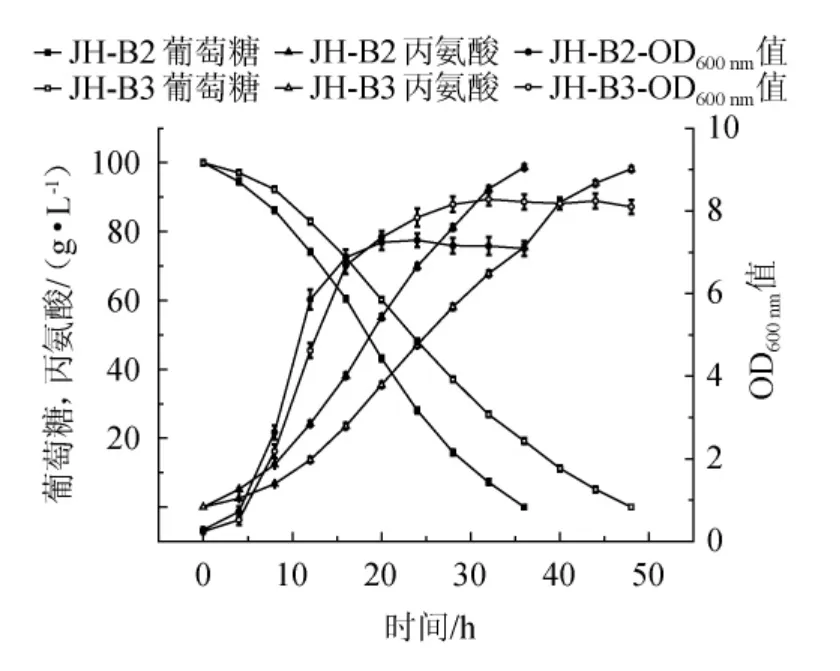
图2 两种菌株利用葡萄糖发酵产丙氨酸能力比较Fig.2 Comparison of alanine production fermented by two strains with glucose
由图2可知,在菌体生长方面,菌株JH-B2的生物量(OD600nm值)在发酵20 h后进入稳定期,OD600nm值最大为7.29,而ptsG基因缺陷菌株JH-B3在28 h后进入稳定期且OD600nm值最大为8.26;在20 h之前菌株JH-B2的生物量高于菌株JH-B3,而20 h之后菌株JH-B3的生物量都高于菌株JH-B2。在利用葡萄糖方面,菌株JH-B2在36 h发酵结束,平均耗糖速率为2.78 g/(L·h),而菌株JH-B3在48 h发酵结束,平均耗糖速率为2.08 g/(L·h),两者后期耗糖速率都变慢,这可能是后期丙氨酸产生反馈抑制导致的[19]。菌株JH-B3较JH-B2利用葡萄糖的平均速率降低了25.18%,发酵周期延长了33.33%。在生产丙氨酸方面,菌株JH-B2最终生产丙氨酸98.7 g/L,生产强度2.74 g/(L·h);JH-B3最终产生产丙氨酸98.2 g/L,生产强度为2.05 g/(L·h),JH-B3较JH-B2的生产强度降低了25.18%。
结果表明,ptsG基因的敲除可以明显的降低大肠杆菌摄取利用葡萄糖的能力,并且ptsG缺陷菌株JH-B3的生物量高于对照菌,这可能是因为ptsG的敲除减少了乙酸的积累从而有利于菌体生长,以及JH-B3摄取的葡萄糖较多地用于菌体生长[20],导致JH-B3具有更高的生物量,也导致了JH-B3的丙氨酸产量略低于JH-B2。
2.3 两种菌株利用木糖能力对比
对照菌株JH-B2和ptsG基因缺陷菌JH-B3 在分别以10%葡萄糖为碳源下发酵产丙氨酸情况见图3。由图3可知,在菌体生长方面,在发酵48 h后菌株JH-B3和JH-B2的生物量都进入稳定期,OD600nm值最大分别为6.3和6.42,两者的生长趋势几乎相同。在利用木糖方面,菌株JH-B2在216 h发酵结束,平均耗糖速率为0.46 g/(L·h);菌株JH-B3在218 h发酵结束,平均耗糖速率为0.46 g/(L·h),两者利用木糖情况基本相同。在生产丙氨酸方面,菌株JH-B2发酵最终生产丙氨酸89.9 g/L,生产强度为0.42 g/(L·h)。JH-B3发酵最终产生产丙氨酸89.6 g/L,生产强度为0.41 g/(L·h),两者产丙氨酸情况也基本相同。
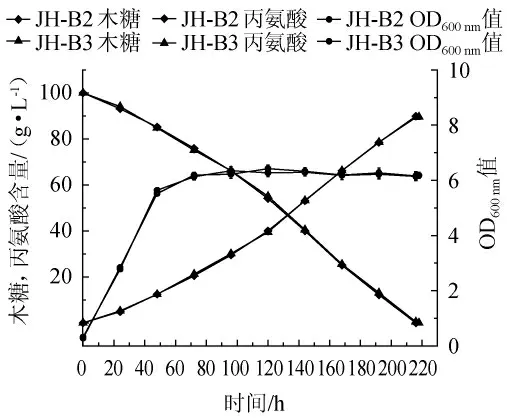
图3 两种菌株利用木糖发酵产丙氨酸能力比较Fig.3 Comparison of alanine production fermented by two strains with xylose
结果表明,在以木糖为唯一碳源时,敲除ptsG基因对菌株发酵产丙氨酸无明显的影响,这是因为大肠杆菌内木糖有独立于葡萄糖的转运和分解代谢途径,ptsG基因编码的转运蛋白只转运葡萄糖而不转运木糖。
2.4 两种菌株利用混合糖能力对比
在以10%混合糖(5%葡萄糖+5%木糖)发酵时,对照菌株JH-B2和ptsG基因缺陷菌株JH-B3的菌体生长情况、耗糖情况及丙氨酸产量见图4。由图4A可知,在24 h之前,菌株JH-B2的生物量(OD600nm值)均比菌株JH-B3大,而24 h之后菌株JH-B3的生物量(OD600nm值)反超JH-B2且始终比JH-B2大;菌株JH-B2的生物量在28 h之后进入稳定期,最大的OD600nm值为6.58,而JH-B3的生物量在40 h后进入稳定期,最大的OD600nm值为7.32。结果表明,ptsG基因缺陷菌株JH-B3所摄取的糖更多的用于菌体生长,因而具有更高的生物量。其生长趋势与在10%葡萄糖培养基中相一致。
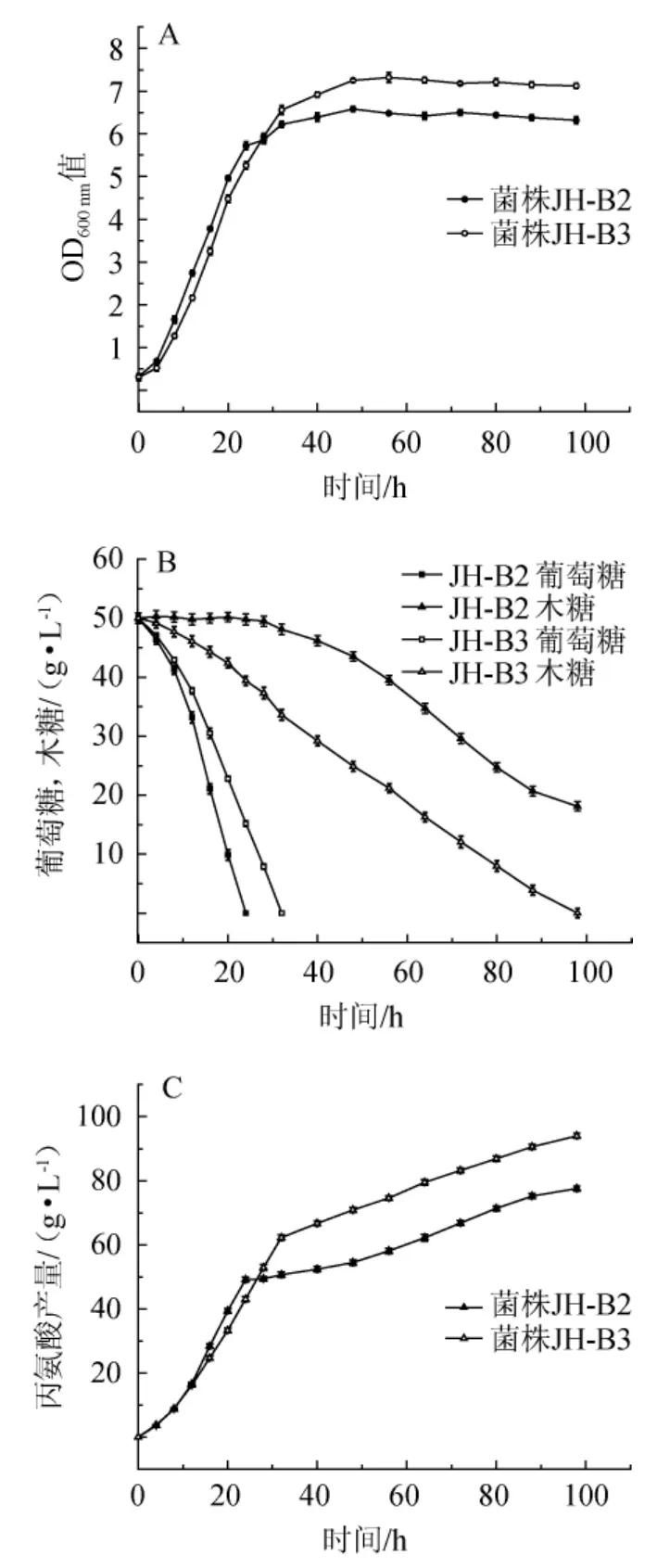
图4 菌株JH-B2和JH-B3在混合糖中的生长曲线(A)、耗糖(B)及丙氨酸产量(C)Fig.4 Growth curves (A),sugar consumption (B) and alanine production(C)of strain JH-B2 and JH-B3 in mixed sugar
由图4B可知,菌株JH-B3同时开始利用葡萄糖和木糖,发酵32 h时利用完葡萄糖,发酵至98 h利用完木糖,而菌株JH-B2利用完葡萄糖后才开始利用木糖,发酵24 h利用完葡萄糖,发酵28 h时开始利用木糖且至98 h还剩余18.1 g/L木糖未利用。菌株JH-B2和JH-B3消耗葡萄糖的速率分别为2.08 g/(L·h)和1.56 g/(L·h),消耗木糖的速率分别为0.33 g/(L·h)和0.51 g/(L·h)。结果表明,敲除ptsG基因在降低大肠杆菌摄取利用葡萄糖的能力同时,变向增强了其对木糖的摄取利用能力,使大肠杆菌在混合糖发酵中能同时利用葡萄糖和木糖,大幅地减弱了葡萄糖效应带来的不利影响。由图4C可知,在发酵24 h之前,菌株JH-B2的丙氨酸产量都高于菌株JH-B3,这是因为在24 h之前,虽然菌株JH-B3同时在利用葡萄糖和木糖产丙氨酸,但利用木糖的速率还很慢,而菌株JH-B2虽然不能利用木糖,但利用葡萄糖产丙氨酸的速率却大于菌株JH-B3利用葡萄糖和木糖产丙氨酸的速率之和;在发酵24 h之后,菌株JH-B3的丙氨酸产量却逐渐超过菌株JH-B2,这是因为两种菌株在利用完等量葡萄糖的过程中,菌株JH-B3利用木糖产丙氨酸的能力却远大于菌株JH-B2;在发酵32 h之后,两种菌株产丙氨酸的速率基本相同,这是因为32 h时菌株JH-B3的葡萄糖也被利用完,两者利用木糖的速率基本相同。发酵至98 h,菌株JH-B2丙氨酸产量为77.6 g/L,转化率为94.7%,生产强度为0.79 g/(L·h),而菌株JH-B3丙氨酸产量为94.1 g/L,转化率为94.1%,生产强度为0.96 g/(L·h),菌株JH-B3的生产强度较菌株JH-B2提高了21.5%,这是因为此时菌株JH-B3已经利用完所有糖,而菌株JH-B2尚剩余18.1 g/L的木糖未转化成丙氨酸。
3 结论
大肠杆菌在混合糖(葡萄糖+木糖)发酵过程中,会优先摄取利用葡萄糖,待葡萄糖利用完后停滞一段时间才开始利用木糖,这种现象被称为CCR效应,也被称为葡萄糖效应。因此决定混合糖发酵周期和效率的关键因素是菌株对木糖的利用速率。大量研究表明,葡萄糖效应与PTS转运系统有关。PTS系统负责特异性地将葡萄糖转运至细胞内,并将其磷酸化成葡萄糖-6-磷酸。PTS系统中的ptsG基因编码EIICBGlc在葡萄糖的转运和磷酸化中起到重要的作用。理论上敲除ptsG基因可以降低大肠杆菌转运葡萄糖的速率和降低磷酸化水平,从而抑制葡萄糖效应[21]。
本实验以大肠杆菌基因工程菌JH-B2为出发菌株,通过Red同源重组技术,敲除了磷酸转移酶系统中的关键基因ptsG,得到了ptsG基因缺陷菌株JH-B3。在以10%混合糖(5%葡萄糖+5%木糖)发酵产丙氨酸时,JH-B3能同时利用葡萄糖和木糖,大幅度减小了葡萄糖效应所带来的不利影响,其木糖利用速率和丙氨酸生产强度较对照菌JH-B2的分别提高了54.5%和21.5%,并且其转化率高达94.1%。本次实验为利用廉价的木质纤维素产丙氨酸提供了理论基础。

