高浓度下溶剂热法制备锂离子电池富锂正极材料
李文汭 王兴尧 张梦远

摘 要:溶剂热法因具有操作简单、封闭体系易于控制等特点已然成为目前实验室制备富锂正极材料的一种高效方法。目前报导的实验室制法往往在低浓度下进行,限制了实际生产需求。高浓度下利用溶剂热法制备优良性能的富锂正极材料得到了实现,同时利用扫描电子显微镜、透射电子显微镜、能谱分析、激光粒度分析和恒电流充放电测试等研究了不同浓度对其结构和电化学性能的影响。结果表明:乙酸锂浓度为1.0 M时制备的材料具有良好的六边形结构,粒径小,分布均匀,0.1 C时放电比容量高达296.1 mA·h/g。50次循环后,库仑效率仍保持在97%以上。
关 键 词:溶剂热法;高浓度;富锂正极材料;锂离子电池
中图分类号:TM 912.9 文献标识码: A 文章编号: 1671-0460(2019)04-0661-05
Abstract: The solvothermal method has become an efficient method for preparing Li-rich cathode materials in the laboratory due to the simple operation and easy control of the closed system. Currently reported laboratory processes are often carried out at low concentrations, limiting the actual production requirements. In this paper, the preparation of Li-rich cathode material by solvothermal method at high concentration was realized, the effect of different concentrations on the structure and electrochemical performances was also investigated by Scanning Electron Microscope, Transmission Electron Microscopy, Energy Dispersive Spectrometer, Laser Particle Size Analysis, Galvanostatic Charge-Discharge Test, etc. The results showed that, the material exhibited the well-ordered hexagonal shape with smaller particle size and uniform distribution when the concentration of lithium acetate was 1.0 M and a discharge capacity was up to 296.1 mA·h/g at 0.1 C. The coulombic efficiencies were mostly over 97% during the following 50 cycles.
Key words: Solvothermal; High concentrations; Li-rich cathode; Lithium-ion batteries
全世界范圍内,超过1/5的二氧化碳排放量是因运输中使用化石燃料造成的,这推动了电动汽车行业的发展。 锂离子电池因其具有高能量密度和环境友好性,而被认为是一种有前途的储能技术。目前已经市场化的锂离子电池正极材料有层状LiCoO2、橄榄石型LiFePO4[1]、尖晶石型LiMn2O4和三元材料。然而上述材料的放电比容量偏低,不能够满足市场需求,需要进行包覆[2]或掺杂改性以达到容量需求。相比之下,富锂层状正极材料Li1.2Mn0.54Ni0.13Co0.13O2,具有超过250 mA·h/g的放电比容量,且毒性低,安全性佳,更具应用前景[3-5]。
制备富锂正极材料的方法众多,常用的制备方法有共沉淀法[6]、溶胶凝胶法[7]、聚合物热解法[8]等。以上制备方法虽然可以制得富锂正极材料,但因其对设备要求较高,或是反应过程剧烈等原因,使之生产成本提高、应用性欠佳。例如共沉淀法大多利用连续搅拌反应釜(CSTR),配合蠕动泵的使用同时控制螯合剂和沉淀剂的进料速度,过程中对反应体系内的pH值同样有严格要求[9]。而溶剂热法的制备过程操作简单、封闭体系易于控制且产品分散性好,已然成为目前实验室制备富锂正极材料的一种高效方法。但目前报导的实验室制法往往在低浓度下进行:Zeng J等[10]在乙酸锂的浓度小于0.5 M的条件下制得,Fu F等[11]在乙酸锂的浓度小于0.3 M的条件下制得,而实际生产过程中会因浓度过低占用更多体积使产能下降,造成不必要的空间浪费,限制了实际生产需求。
本文中采用溶剂热法,以乙醇作为溶剂,以草酸作为沉淀剂,通过更加简单的操作过程制备出高性能的富锂正极材料. 不仅如此,在乙酸锂浓度0.2 至1.4 M的范围内进行一系列材料的制备,研究了浓度对材料形貌、电化学性能方面的影响,筛选出制备富锂正极材料的最佳条件,为实现高性能富锂正极材料的实际生产提供了一种可行的方法。
1 实验部分
1.1 试剂
乙酸锂、乙酸镍、乙酸钴、乙酸锰、草酸,N-甲基吡咯烷酮,天津光复精细化工研究所;无水乙醇,天津江天化工技术有限公司;聚偏二氟乙烯,乙炔黑,天津艾维信化工科技有限公司;铝箔,深圳福来顺有限公司;锂片,北京有色金属研究总院;锂离子电池电解液,山西力之源电池材料有限公司。
1.2 仪器
磁力搅拌器(CJJ 78-1),不锈钢高压釜100 mL,山东鄄城华鲁电热仪器有限公司;循环水式真空泵(SHB-III),天津科诺仪器设备有限公司;电热恒温干燥箱(DG202-BS),电热真空干燥箱(DG-201),天津市天宇实验仪器有限公司;高温箱式电阻炉(管式炉)(XY-1400),南阳市鑫宇电热元器件制品有限公司;电子分析天平(AUW120D),Japan SHIMADZU Corporation;压片机,深圳市永兴业精密机械模具有限公司;手套箱(Lab2000),特克斯惰性气体系统(北京)有限公司;封口机(YS-160),深圳市永兴业精密机械模具有限公司。
1.3 表征
X射线衍射分析(XRD),荷兰Panalytical公司X'Pert Pro帕纳科铜靶;场发射扫描电子显微镜(SEM),日本日立公司S-4800;场发射透射电子显微镜(TEM),高分辨率透射电子显微镜(HR-TEM),日本电子JEM-2100F;能谱仪(EDS),日本日立公司S4800型;激光粒度分析,英国马尔文Nano ZS;恒电流充放电测试,武汉市金诺电子公司CT2001A蓝电系统。
1.4 实验过程
1.4.1 富锂正极材料的制备
将乙酸锂溶于50 mL无水乙醇中,分别得到0.2、0.4、0.6、0.8、1.0、1.2、1.4 M的乙酸锂的乙醇溶液,后按照Li1.2Mn0.54Ni0.13Co0.13O2的化学计量比依次加入对应量的乙酸镍、乙酸钴、乙酸锰,完全溶解后加入对应化学计量的草酸,磁力搅拌3 h后转移至100 mL不锈钢反应釜中,200 ℃反应24 h,后冷却至室温,抽滤,用无水乙醇洗3次后80 ℃烘干,得到淡粉色粉末前驱体;后置于管式炉中450℃焙烧6 h,900 ℃焙烧12 h,得到最终产物Li1.2Mn0.54Ni0.13Co0.13O2,不同浓度下制得的样品分别记为0.2、0.4、0.6、0.8、1.0、1.2和1.4 M。
1.4.2 扣式电池的组装
将制得的活性物质Li1.2Mn0.54Ni0.13Co0.13O2、乙炔黑和PVDF以质量比8∶1∶1的比例,以NMP作为溶剂混合均匀,得到均匀的糊状正极浆,均匀涂布在铝箔上,先于80 ℃下烘干,用裁片机裁下圆片,后于120 ℃下真空干燥12 h,得到正极片。以锂片作负极,在手套箱中组装CR2032型扣式电池,封口,静置12 h后即可进行测试。
2 结果与讨论
2.1 XRD表征
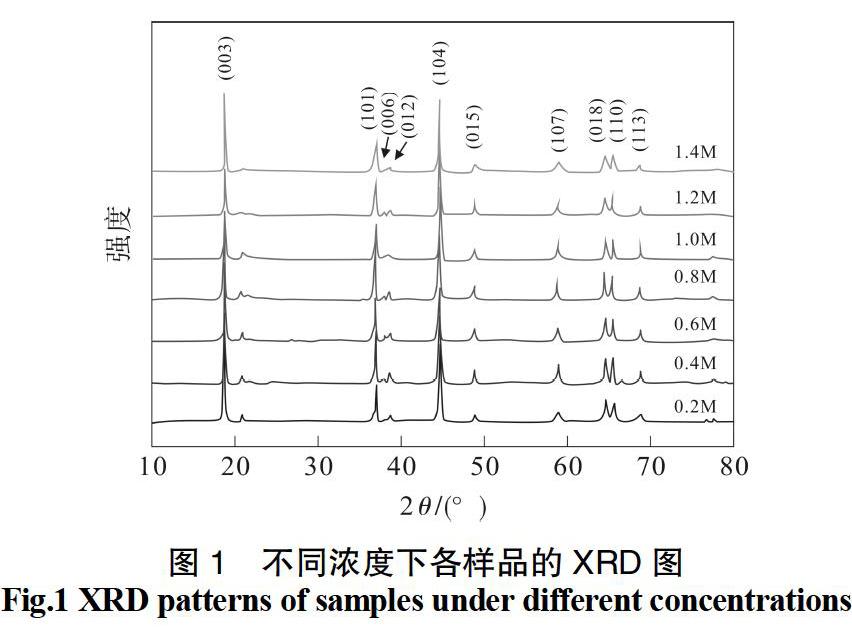
图1为不同浓度下制得样品的XRD谱图,七个样品的衍射峰形相似且均十分尖锐,说明结晶程度良好,进行图谱分析可知材料为α-NaFeO2 型层状结构[12],属于R3 ?m空间群。20°~25°之间的微弱衍射峰属于C2/m空间群,说明作为固溶体的富锂正极材料中具有Li2MnO3结构[13]。分裂尖锐的(006)/(012)峰和(108)/(110)峰说明不同浓度下制得的材料均具有高度有序的层状结构[14,15]。
2.2 SEM和粒度表征
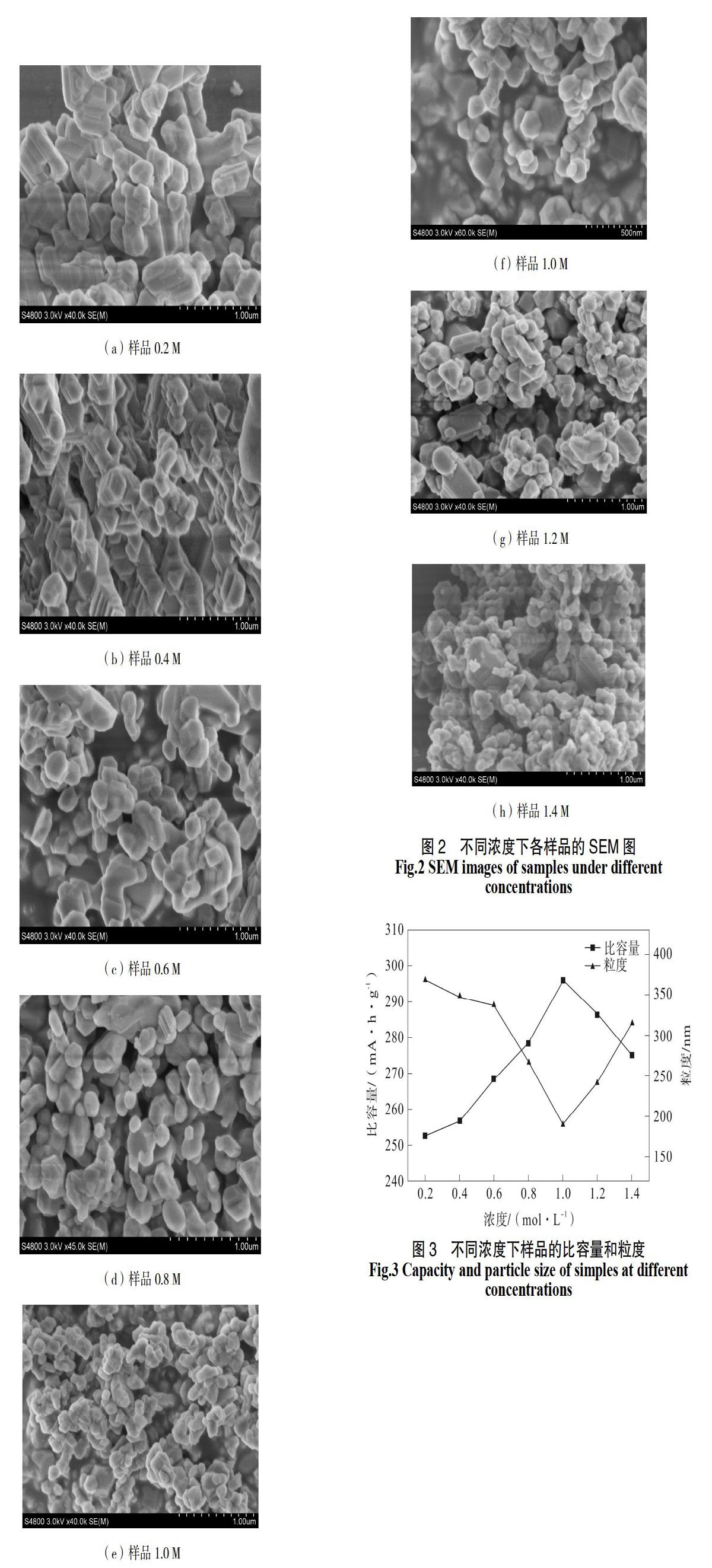
图2为各样品的SEM图,可以清楚的看到图2(a)-(d)中的颗粒大小不均匀,直径约为200~400 nm,团聚现象严重,但随浓度的增加,颗粒直径逐渐变小,团聚现象降低,图2(d)中开始出现直径约100 nm的小颗粒。图2(e)中的颗粒分布均匀且分散,直径约100 nm,由图2(f)可知样品1.0 M是具有良好的六边形结构的纳米粒子。图2(g)、(h)中的初级粒子更小,但随浓度增大团聚现象也更加严重。为了更准确的把握各样品的粒子直径,进行图3中的粒度分析:样品0.2,0.4,0.6, 0.8, 1.0, 1.2和1.4 M 的粒度分别为 368, 348, 337, 267, 190, 241和315 nm,显然样品1.0 M具有最低的粒子直径,与SEM结果一致。因此样品1.0 M具有更小的粒子直径和更均匀的粒子分布。
2.3 TEM和HRTEM表征
从图4(a)中可以清楚的看到样品1.0 M具有清晰的六边形结构,从图4(b)高分辨率透射电子显微镜所得到的图像可以得知(003)面的晶面间距为0.47 nm,是典型的R3 ?m层状结构[16],(110)面和(020)面的晶面间距分别为0.41nm和0.42 nm,且呈59.8°角近似于60°,这表明样品中具有Li2MnO3组分[17]。结合上述SEM表征的结果,说明制得样品符合富锂材料的特征,材料得到了成功制备。
7组充放电曲线形状相仿,且充电曲线均在4.5 V处出现平台[18],这是从层状Li2MnO3晶格中同时脱离出Li和O原子的结果,同时也是xLi2MnO3·(1-x)LiMO2类层状化合物的重要特征[19]。样品0.2, 0.4, 0.6, 0.8, 1.0, 1.2和1.4 M 的首次放电比容量依次为 252.6, 256.7, 268.6, 278.3, 296.1, 286.6, 275.1 mA·h/g,结合上述对各样品粒度的分析,由图3清楚地表明样品1.0 M粒度最小,首次放电比容量最高。
这是因为粒度偏大粒子通常会使锂离子的扩散路径增长,从而降低了电化学性能[20]。相反,分散均匀且粒度偏小的纳米粒子可以缩短锂离子的扩散路径,这对于形成良好的电化学动力学起到关键性作用[21]。
图6中针对各样品进行循环和倍率性能的表征,图6(a)给出了7个样品50次循环内的放电比容量,可以明显得看出,7个样品的放电比容量均有衰减趋势,其中样品0.2,0.4,0.6,0.8,1.2,1.4 M的放电比容量随循环次数的增加衰减严重,而样品1.0 M体现出较好的循环性能。由图6(b)可知样品1.0 M首次充放电比容量分别为380.8和296.1 mA·h/g,初始库伦效率为77.76%,可见首次充放电过程中有大量的容量损失,这归因于首次充放电中产生的不可逆的氧化物离子空位,是富锂正极材料的普遍特征[20]。在随后的50次充放电循环中库仑效率大多在97%以上, 且充放电容量下降缓慢,经50次循环后,样品1.0 M的放電容量和库伦效率分别保持在231.7 mA·h/g和92.69%。图6(c)给出了样品1.0 M在0.1~5 C下的首次放电曲线,当倍率分别为0.1、0.2、0.5、1.0、2.0和5 C时,样品的初始放电容量分别为296.1、245.9、218.3、176.2、131.7和98.8 mA·h/g。结果表明,随着电流密度的增加,放电容量逐渐减小,高倍率下的容量降低主要是由于材料在高电流下的高度极化,这是众多材料的共同特点[19],但性能优于文献报道中的结果:0.1 C下223 mA·h/g,1 C下152.2 mA·h/g,5 C下89.8 mA·h/g [16],说明在高浓度下制得的材料依然可以表现出优良的倍率性能。
3 结 论
为满足实际生产的需求,采用溶剂热法在高浓度下制备富锂正极材料,比较了不同浓度下材料的形貌和放电比容量,结果表明,以乙醇作溶剂,当乙酸锂浓度为1.0 M时,具有最小的粒径190 nm,最高的初始放电容量296.1 mA·h/g (0.1 C),颗粒呈規整的六边形结构,即使在较高的放电倍率下,放电容量仍可保持在98.8 mA·h/g。与多数实验室中低浓度下制得样品相比,高浓度条件下制备的纳米富锂正极材料颗粒均匀,电化学性能同样优异,制备方法更加简单,为实现高性能富锂正极材料的实际生产提供了一种可行的方法。
参考文献:
[1]南宁,周春生,侯新刚,等. 锂离子电池正极材料 LiCoPO4的改性研究[J]. 当代化工,2017,46 (12): 2400-2403.
[2]李昊然,安长胜,李炀,等. 中空八面体锂离子电池正极材料LiFePO4的制备及电化学性能[J]. 当代化工,2017,46 (10): 1998-2004.
[3]Wu Y,Manthiram A. Effect of Al3+ and F- doping on the irreversible oxygen loss from layered Li[Li0.17Mn0.58Ni0.25]O2 cathodes[J]. Electrochemical Solid-State Letters,2007,10 (6): A151-A154.
[4]Wang Y X,Shang K H,He W,et al. Magnesium-doped Li1.2 [Co0.13Ni0.13Mn0.54]O2 for Lithium-ion battery cathode with enhanced cycling stability and rate capability, [J]. ACS Applied Materials & Interfaces,2015,7 (23): 13014-13021.
[5]Jiang Y,Yang Z,Luo W,et al. Facile synthesis of mesoporous 0.4Li2MnO3·0.6LiNi2/3Mn1/3O2 foams with superior performance for lithium-ion batteries[J]. Journal of Materials Chemistry,2012,22: 14964 ?14969.
[6]Zhang J M,Wu X B,Yang Y. A comparison of preparation method on the electrochemical performance of cathode material Li[Li0.2Mn0.54Ni0.13Co0.13]O2 for lithium ion battery[J]. Electrochimica Acta,2011,56(8):3071-3078.
[7]Zhao T L,Chen S,Li L,et al. Amine, Synthesis, characterization, and electrochemistry of cathode material Li[Li0.2Co0.13Ni0.13Mn0.54]O2 using organic chelating agents for lithium-ion batteries[J]. Journal of Power Sources,2013,228:206-213.
[8] He W,Qian J,Cao Y,et al. Al2O3 coating on Li1.256Ni0.198Co0.082Mn0.689O2.25 with spinel-structure interface layer for superior performance lithium ion batteries[J]. Rsc Advances,2012,2:3423-3429.
[9]Wu F,Wang H,Bai Y,et al. Hierarchical microspheres and nanoscale particles: effects of morphology on electrochemical performance of Li1.2Mn0.54Ni0.13Co0.13O2 cathode material for lithium-ion batteries[J]. Solid State Ionics,2017,300:149-156.
[10]Zeng J,Cui Y,Qu D,et al. Facile synthesis of plate like hierarchical Li1.2Mn0.54Ni0.13Co0.13O2 with exposed {010} planes for high-rate and long cycling-stable lithium ion batteries[J]. ACS Applied Materials & Interfaces,2016,8(39):26082-26090.
[11]Fu F,Wang Q,Deng Y P,et al. Effect of synthetic routes on the rate performance of Li-rich layered Li1.2Mn0.56Ni0.12Co0.12O2[J]. Journal of Materials Chemistry A,2015,3:5197-5203.
[12]湯雁,刘攀,徐友龙. 锂离子电池正极材料的研究现状与发展趋势[J]. 电子元件与材料,2014,33 (8):1-6.
[13]杨瑞娟. 高容量富锂相层状固溶体锂离子电池正极材料[D]. 天津:天津理工大学,2012.
[14]Lu Z H,Beaulieu L Y,Donaberger R A,et al. Synthesis, structure, and electrochemical behavior of Li[NixLi1/3-2x/3Mn2/3-x/3]O2[J]. Journal of the Electrochemical Society,2002,149(6):A778-A791.
[15]Zhang Y,Hou P,Zhou E,et al. Pre-heat treatment of carbonate precursor firstly in nitrogen and then oxygen atmospheres: A new procedure to improve tap density of high-performance cathode material Li1.167(Ni0.139Co0.139Mn0.556)O2 for lithium ion batteries[J]. Journal of Power Sources,2015,292 (1):58-65.
[16]Yan W,Jiang J,Liu W,et al. Synthesis and evaluation of microspherical Li1.2Mn0.54Co0.13Ni0.13O2 through carbon dioxides-assisted co-precipitation method for lithium-ion battery[J]. Electrochimica Acta,2016,212(10):16-24.
[17]Fu F,Deng Y –P,Shen C-H,et al. A hierarchical micro/ nanostructured 0.5Li2MnO3·0.5LiMn0.4Ni0.3Co0.3O2 material synthesized by solvothermal route as high rate cathode of lithium ion battery[J]. Electrochemistry Communications,2014,44: 54-58.
[18]Shi S J,Tu J P,Tang Y Y,et al. Preparation and characterization of macroporous Li1.2Mn0.54Ni0.13Co0.13O2 cathode material for lithium-ion batteries via aerogel template[J]. Journal of Power Sources,2013,240 (15): 140-148.
[19]Hou X,Huang Y,Ma S,et al. Facile hydrothermal method synthesis of coralline-like Li1.2Mn0.54Ni0.13Co0.13O2 hierarchical architectures as superior cathode materials for lithium-ion batteries[J]. Materials Research Bulletin,2015,63: 256-264.
[20]Fu F,Huang Y,Wu P,et al. Controlled synthesis of lithium-rich layered Li1.2Mn0.56Ni0.12Co0.12O2 oxide with tunable morphology and structure as cathode material for lithium-ion batteries by solvo/ hydrothermal methods[J]. Journal of Alloys and Compounds,2016,618: 673-678.
[21]Liu J,Chen H,Xie J,et al. Electrochemical performance studies of Li-rich cathode materials with different primary particle sizes[J]. Journal of Power Sources,2014,251: 208-214.

