基于群体感应的单增李斯特菌生物膜形成与控制研究进展
刘昀阁,罗 欣,2,3,董鹏程,朱立贤,毛衍伟,梁荣蓉,杨啸吟,韩广星,张一敏,2,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.国家牛肉加工技术研发专业中心,山东 泰安 271018;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095;4.国家肉牛牦牛产业技术体系临沂站,山东 临沂 276000)
生物膜是指附着于物体表面,由细菌和自身分泌的胞外聚合物(extracellular polymeric substances,EPS)组成的多糖蛋白复合物。其中,多种EPS(多糖基质、纤维蛋白、脂蛋白等)组成了生物膜三维结构的基本骨架,其对细菌在固体表面黏附以及连接起到关键的作用[1]。细菌生物膜可以在食品表面(如农产品或动物胴体)或与食品接触的底层(如设备和加工环境)附着并生长,已经在食品工业中引起了特别的关注[2]。此外,生物膜为微生物提供栖身之所,微生物对环境压力具有很强的抵抗力,如对消毒剂和抗微生物处理的耐受[3]。因此,在肉类、鱼类、乳制品和家禽加工中与生物膜形成相关的问题是司空见惯的。
食源性致病菌在食品加工接触面形成生物膜是一个动态演变过程,根据生物膜中菌群聚集的规律,其形成过程可分为以下5 个阶段[4-6]:1)浮游态阶段,细菌表面的黏附蛋白对物体表面进行特异性识别,进而黏附在物体表面上;2)可逆黏附阶段,细菌在经过第一步的黏附后,进行分泌胞外多糖的代谢活动,形成一定的细菌群落,对此阶段的黏附菌体施加温和的作用力就可使其从接触表面脱落;3)不可逆黏附阶段,随着胞外多聚糖基质的不断合成分泌,逐渐形成有一定组织形态的生物膜结构,此时的黏附菌体与接触表面间连接牢固,温和的外界作用力不能轻易地使其从接触表面脱离;4)生物膜成熟阶段,此阶段的生物膜分泌大量的EPS,菌体不断繁殖,形成了具有一定空间结构的细菌群体,此阶段细菌内部的功能基因开始表达并伴随产生特定的代谢产物;5)生物膜的主动分散阶段,此阶段生物膜内部细菌开始凋亡,同时细菌分泌的酶类物质会使生物膜结构分解;作为生物膜生命周期的最后一步,活的细菌可分散到周围的环境中去,重新变为浮游状态[7]。
食源性病原体在食品接触面产生的生物膜持续存在,关于其影响食品质量和安全的报道相当多。与生物膜有关的病原体暴发案例通常与单增李斯特菌(Listeria monocytogenes,Lm)、小肠结肠炎耶尔森菌、空肠弯曲杆菌、沙门氏菌、葡萄球菌和大肠杆菌O157:H7有关[8]。在乳品加工中,与引起腐败的假单胞菌和蜡状芽孢杆菌相比,Lm在乳品加工的各个环节均有检出[9],Lm在冷藏环境中的耐受性强,Simões等发现Lm在乳品加工设施中存在可长达7 年之久[10]。
影响生物膜形成过程的调节因素可分为环境条件(温度、底物性质、营养物质可利用性、pH值、水分活度和胁迫剂等)和微生物特征(菌株、细胞表面、生长期和代谢活性等)[11]。生物膜可以在食品加工环境中作为持久的交叉污染和微生物污染物的储库,导致食源性疾病发生的风险更高,并且降低食品保质期。在食品工业和环境中,要采取控制措施,预防生物膜形成或根除现有的生物膜,以尽量降低因食用受污染食品而广泛传播致病菌株的潜在风险。
1 Lm生物膜特性
Lm为革兰氏阳性、兼性厌氧型、无芽孢短杆菌,是一种常见的食源性致病菌。Lm引起的疾病可以导致坏血病、脑膜炎或引发孕妇流产,是一种高住院率、高病死率的严重疾病,这种食源性感染主要影响小孩、老人、孕妇和免疫受损的个体[12-13]。据统计,超过99%的人感染Lm的患者是由于食用了受污染的食品,特别是冷藏食品和即食食品(如熟肉制品、乳制品、熏鱼和海鲜)[14-15]。Lm是一种嗜冷菌,极易在食品或加工环境中残留,与大部分食源性致病菌相比,Lm可耐受食品加工环境中各种不利条件(如低温、高渗透压和低pH值等),它可以在pH 4.6~9.5、水分活度低至0.92的条件下生长,甚至在温度低于0 ℃条件下仍可繁殖[16]。根据Carpentier等的研究表明,Lm的控制之所以成为食品工业的难题,主要归因于其较强的生物膜形成能力[16]。生物膜结构赋予细菌对于消毒剂更强的耐受性,据报道,Lm生物膜在食品加工设备、传送带、管道、地板等场所能够持续附着数月甚至数年,造成交叉污染和器械腐蚀等后果[17],Lm生物膜独特的持久性也与其在低温环境下的生存和繁殖能力有关。Lm生物膜在食品工业的设备和环境中,特别是在不利条件下长期持续存在的能力,自上个世纪末期就引起了科学界的研究兴趣。
Lm生物膜主要形成于亲水性表面(不锈钢和玻璃等),在疏水性表面(聚四氟乙烯、尼龙和丁腈橡胶等)形成能力较弱[18]。Lm在接触表面上生物膜的形成能力强是由于其在较短接触时间内可以利用鞭毛、膜蛋白附着,且附着能力良好。Lm生物膜在接触表面的黏附是由疏水相互作用、范德华力和静电作用引起的,这些作用受鞭毛形成、纤维产生以及胞外多糖合成的影响[19],如鞭毛的产生影响静电斥力作用,增强了细胞向非生物或生物表面特定附着点的运动[20]。此外,Tresse等研究发现在pH 5.0下鞭毛蛋白合成下调对Lm在聚苯乙烯表面黏附能力的影响,结果表明鞭毛形成对pH值具有敏感性[21]。
最初研究表明,Lm的生物膜结构为三维蘑菇状(图1A)[20]。随后,Rieu等通过激光共聚焦显微镜观察,发现在动态条件下LmEGD-e菌株的生物膜为三维球形网链状结构(图1B)[22]。Pan等使用扫描电子显微镜(图1C)、荧光显微镜、原子力显微镜和激光共聚焦显微镜等成像技术研究了Lm生物膜的形成和发展过程[23]。研究表明,Lm在不同培养条件下产生的生物膜结构不同,包括贴壁细胞单层结构、三维结构、多层结构、蜂窝状结构、蘑菇状结构、针织链结构、无组织聚集结构等[24-25]。
Lm生物膜的EPS由蛋白质、多糖、核酸和脂类组成,它们为细菌群落提供保护、隔离金属和毒素、防止生物杀菌剂进入并可作为生物膜形成过程中的基质[26]。研究表明,Lm具有产生EPS的能力,这是其生物膜形成的标志之一[27]。而Lm产生的EPS中存在核酸(胞外DNA)和蛋白质是生物膜成熟的标志[28]。其中,胞外DNA会调节酸碱作用以增强Lm在不同接触表面的初始黏附[15]。生物膜相关蛋白是Lm形成EPS中的另一个重要组成部分,如(p)ppGpp合成酶(RelA和Basl)在细胞间通信中起重要的作用[29]。在生物膜发育过程中,很多蛋白表达被上调,如丙酮酸脱氢酶、30S核糖体蛋白(YvyD和RpsB)、传感蛋白(CysK)、6-磷酸果糖激酶、超氧化物歧化酶、DNA修复蛋白(RecO)和细胞分裂起始蛋白(DivIVA),它们在应激反应、碳水化合物代谢、DNA修复、细胞增殖和群体感应(quorum sensing,QS)调节中起着重要作用[1]。

图 1 Lm在不锈钢表面形成生物膜的扫描电子显微镜及激光共聚焦图像(2 d)[20,22,24]Fig. 1 Observation of L. monocytogenes biofilm formation on stainless steel on the 2nd day[20,22,24]
2 生物膜与QS系统
2.1 QS概述
细菌生物膜的形成分为5 个阶段,细菌在接触表面一旦进入不可逆黏附阶段,参与细胞表面蛋白表达和EPS生成的基因就会通过一种称为“QS”的过程被激活,该过程用于细胞间的通信[30]。QS是细胞与细胞之间的一种交流,这种交流是由特定的信号分子(即自诱导物(auto-induce,AI))完成的,积累到一定水平的信号分子可与细胞内的特定受体结合,进而调控相应基因的表达,从而转变为多个细胞之间共同协作的生理特性[31]。QS效应与细菌生物膜的形成、毒力侵袭特性和应激响应等生理特性密切相关。QS主要作用于生物膜形成的聚集阶段,细菌在受到不利外界条件胁迫后,会通过QS系统发出信号,使细菌聚集并形成生物膜[32]。
为了抵御环境的变化,细菌已经发展出一些机制来感知周围的环境,整合信号并使其在波动条件下繁殖。在这些机制中,细菌在细胞之间交换信息的能力已经成为过去40 年来微生物学家感兴趣的一个动态领域[32]。QS赋予细菌通过感应特定信号分子积累来识别菌落密度的能力。只有当菌落密度高时,信号在细胞外环境中的积累才足以激活应激响应。在结构上,QS信号分子的分子质量较低并且属于多种化学类别,包括酰基高丝氨酸内酯(N-acylhomoserine lactone,AHL)、呋喃糖基硼酸二酯(autoinducer-2,AI-2)以及寡肽自诱导因子(autoinducing peptide,AIP)。细菌以合作方式完成生物膜的发育,是其最常见的合作过程之一[33]。
生物膜是微生物的群落,它们附着于表面或相间,并嵌入自我产生的细胞外基质中。在生物膜内部,细菌可以免受环境压力,如干燥、免疫系统攻击、原生动物摄入和抗菌剂[34]的影响。在考虑生物膜发育与QS之间的关系时,首先应关注细菌密度是否达到使QS信号参与生物膜调节的阈值水平,初始黏附阶段细菌密度无法触发信号分子,因为此阶段的细菌涌动能力较强。当附着的细菌分裂并形成微菌落时,群体密度增加,QS信号分子达到足够的水平以协调并激活生物膜的成熟和解体[35]。由于QS调控网络通常非常复杂,包括多个影响生物膜在不同阶段发育的基因,因此QS最终触发生物膜的机制尚不清楚。
2.2 Lm种间信息传递和自诱导
在Lm等革兰氏阳性菌中,QS自诱导物分为AI-2和AIP[36]。其中AIP是革兰氏阳性菌所特有的信号分子[37],而AI-2则为革兰氏阴性菌与革兰氏阳性菌所共有[31]。
2.2.1 AI-2系统
AI-2型QS系统最早是在海洋细菌哈氏弧菌中发现的[36]。在该系统中,核苷酶和S-核糖同型半胱氨酸酶(S-ribosylhomocysteinase,LuxS)两种酶将S-腺苷高半胱氨酸(S-adenosyl homocysteine,SAH)转化成同型半胱氨酸和4,5-二羟基-2,3-戊二酮[38]。AI-2信号分子既存在于革兰氏阴性细菌也存在于革兰氏阳性细菌中,没有种族特异性,也是目前所知的唯一能进行种内和种间交流的通用信号[39]。
目前在Lm基因组中尚未发现完整的AI-2的检测和信号传递系统,Belval等研究发现luxS缺失株累积了AI-2的前体物质S-核糖基高半胱氨酸(S-ribosyl homocysteine,SRH)和SAH,用体外合成的AI-2互补突变体菌株对生物膜形成没有影响,但是添加外源性SRH增加了附着细胞的数量。因此推测AI-2可能是甲基活化循环的副产物,仅扮演代谢SAH从而去除SAH毒性的作用,而在细胞QS系统信号传递中不起作用[36]。相反,AI-2的前体物质SRH在生物膜形成中扮演重要作用,有可能参与细胞之间的通信[40]。
2.2.2 双组分信号转导系统
→Ten boys competed against each other,two of whom came from our school.
在革兰氏阳性菌中,基于寡肽AIP QS系统的多个通道已被研究证实[41-42](图2A)。附属基因agr系统最早在金黄色葡萄球菌中被提出,经证实该系统与金黄色葡萄球菌的许多毒性因子的产生及生物膜的形成有关[43](图2B)。在金黄色葡萄球菌中,AIP是通过双组分信号转导系统产生的,其中AgrC蛋白是膜结合的组氨酸激酶,AgrA蛋白是反应调节器。磷酸化AgrA蛋白分别激活P2和P3启动子进而编码agr启动子(即RNA II)和RNA III。RNA III转录后激活毒力因子的产生,抑制rot(毒素的抑制因子)的表达,从而使毒力因子的表达不被抑制[44]。有充分的证据表明,在金黄色葡萄球菌等革兰氏阳性菌中,QS相关基因表达调控涉及到毒力因子的表达[45],当到达生物膜成熟阶段,RNA III刺激α-及β-溶血素、肠毒素等多种分泌毒力因子表达,同时降低几种表面黏附基因的表达,从而导致毒性增加和生物膜形成减少[46]。

图 2 革兰氏阳性菌中肽介导的QS系统模型[35,41-43,47]Fig. 2 Models of peptide-mediated regulatory QS systems found in Gram-positive bacteria[35,41-43,47]
Lm的4 个基因agrB、D、C、A具有与葡萄球菌agrB、D、C、A操纵子相似的调控机制,其中agrB和agrD编码跨膜蛋白和前肽AgrD[48]。AgrB蛋白参与将AgrD加工成环状AIP并将其运输到细胞外。基因agrC和agrA编码双组分系统AgrC/AgrA的传感器激酶和反应调节器[49]。研究表明,基因agrD或agrA缺失的LmEGD-e菌株的成膜能力和毒力与母本相比均受到显著影响[50]。Riedel发现,在∆agrD突变体中,其毒力受到了良好的调控,毒力相关基因(hlyA、actA、plcA、prfA和inlA)的表达下调[49]。Lm中重要的毒力基因是通过毒力转录因子PrfA调控的,PrfA调控毒力因子如李斯特菌溶血素(listeriolysin,LLO)、特异性磷脂酶C(phosphatidylcholine-specific phospholipase C,PC-PLC)和磷脂酰肌醇特异性磷脂酶等,有报告表明,Lm生物膜的形成与LLO、PC-PLC等毒力因子有关[51]。
尽管有些革兰氏阳性菌的agr系统在许多蛋白质水平、遗传特性和表型性状的调节存在相似性,但已知的agr系统在基因调控机制方面存在差异[52]。在葡萄球菌中大量的agr依赖性基因受RNA III调节,而在广泛的生物信息学调查和转录分析中尚未发现Lm中RNA III的调节作用[53]。因此,在葡萄球菌中由RNA III调控的毒力因子表达及生物膜形成的类似机制,在Lm中仍需进一步探究。
3 Lm生物膜的抑制
现有Lm生物膜的抑制策略包括机械活性、天然和合成化合物的应用、酶解、抗菌药物的使用、QS的抑制以及对营养物和空间的竞争抑制[51,54]。
3.1 物理方法
物理方法对生物膜的抑制可以有效避免抗生素带来的细菌抗药性问题。有研究表明,外加电场对细菌细胞形态、糖蛋白和膜蛋白均有影响,外加电场增强了细菌与接触表面的静电斥力,从而导致生物膜的分离[55]。据报道,在温度为28 ℃和31 ℃下,40 kV/cm的脉冲电场可以使牛乳和鸡蛋中的Lm失活从而降低其黏附[56]。外加电场与抗生素协同使用可提高对生物膜的破坏效果。
超声处理也是去除生物膜的传统物理方法,然而结合化学方法(抗生素和消毒剂)在特定频率和强度下进行超声处理是一种新思路,可以更好地破坏生物膜EPS基质并杀死细菌细胞,这是由于超声使细胞膜通透性增加,促使抗生素和消毒剂发挥更佳效果[57]。Torlak等研究表明,室温下超声处理虽可减少聚苯乙烯表面Lm生物膜的附着,但与氯化苯扎溴铵联合使用可显著降低生物膜形成量[58]。单纯物理或机械方法并不能完全减少或消除生物膜的黏附,因此使用化学方法或生物杀菌剂与物理方法相结合可有效减少或消除生物膜,是一种极具发展前景的方法。
3.2 化学方法
化学消毒剂,如碱、酸、表面活性剂、酶和金属离子通过干扰未成熟生物膜的附着和发育来阻止生物膜的形成[59]。化学消毒剂的效果取决于使用的消毒剂的种类、使用量、接触时间、pH值、生物活性类型以及表面类型等因素[60]。
化学方法在Lm生物膜去除的应用中存在各自不同的优缺点,在后续的研究中需要扬长避短,研究出更加有效且危害低的生物膜抑制剂。
3.3 植物提取物法
随着传统抗生素抗性菌株的出现,天然植物提取物的利用已成为食品工业中抑制食物病原体传播的一种趋势[70]。植物提取物不仅具有抗菌活性,而且可以抑制生物膜的产生和发展[71]。
精油是芳香植物中产生的天然挥发性酚类化合物,作为次生代谢物产生,如丁香精油、肉桂精油、百里香精油、麝香草精油、柠檬草精油和牛至精油,具有抗菌和抗生物膜的特性[72-73]。研究表明,从香辛料中提取的肉桂醛、丁香酚、香芹酚和百里酚能够有效地控制Lm生物膜的生成[63,74]。de Oliveira等用肉桂精油处理大肠杆菌和Lm混合培养的生物膜16~20 min,结果表明,除精油使用量和处理时间外,pH值对消毒效果也有显著影响[75]。蓍草精油可以有效抑制Lm在不锈钢表面的黏附,并抑制其生物膜的生长,且随着处理时间的延长其抑制效果越明显。有趣的是,在0.5 倍最小抑制浓度(minimal inhibit concentration,MIC)下蓍草精油抑制Lm生物膜形成的效果要显著优于2.0 倍MIC,这与浮游菌的抑制存在显著差异[76]。Liu Qianjin等研究发现,肉桂醛、丁香酚、麝香草酚与链霉素协同作用对Lm生物膜的抑制效果更好,此结果表明植物精油可以促进抗生素进入细菌生物膜,这可能是由于植物精油可以影响细菌间的信号交流,从而影响其生物膜的稳定[77]。
天然植物提取物是减少或消除浮游细菌细胞和生物膜商用化学杀菌剂的有效替代品。在多数情况下,这些天然化合物的活性相当于甚至优于化学杀菌剂。
3.4 植物提取物对细菌QS的抑制
目前,植物提取物中断QS系统的能力逐渐得到人们的关注,它可以成为抵御细菌入侵的有效机制。植物性食物提取物或植物化学物质之所以被认为是理想的QS抑制剂,是由于其作为抗生素替代品化学稳定性强、分子质量低,且对人体健康无害[78-79]。
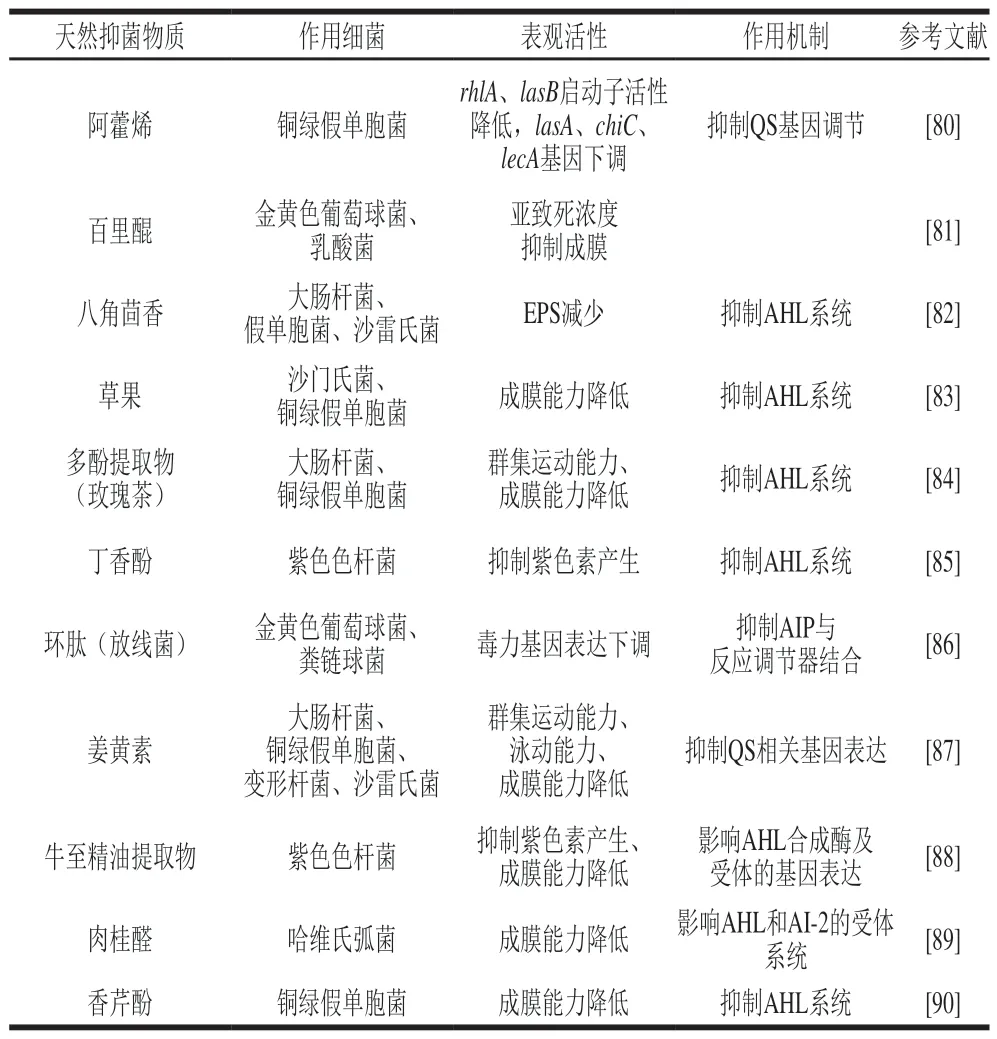
表 1 天然抑菌物质对细菌QS的抑制Table 1 Inhibition of bacterial QS by natural antimicrobial substances
由表1可以看出,目前使用天然抑菌物质对于Lm生物膜抑制的研究还大多停留在表观研究,对于其抑制机理的研究较少,特别是从QS角度阐明其生物膜抑制机制的研究更是鲜有报道。因此,基于QS对天然抑菌物质抑制Lm生物膜的研究将成为该领域进一步研究的热点及方向。
4 结 语
食源性致病菌形成生物膜黏附于物体表面且难以清除,可以抵抗逆性环境,是导致食源性致病菌持续污染食品的重要因素之一。因此,研究Lm生物膜的形成和抑制机制对于食品加工中微生物的安全控制具有重要意义。目前研究表明QS系统可能参与生物膜形成和毒力因子表达的调控,研究LmQS系统与生物膜形成和毒力因子表达的潜在机制将成为一个重要的研究方向,将为群体猝灭手段彻底清除Lm生物膜和研制新型抗菌物质提供参考,对控制Lm食源性污染及其危害形成机制研究具有重要的意义。

