溶菌酶的修饰、功能特性及其在食品保鲜中的应用研究进展
孙 浩,石玉刚,*,朱陈敏,张润润,陈建设,Rammile ETTELAIE
(1.浙江工商大学食品与生物工程学院,浙江 杭州 310018;2.利兹大学食品科学与营养学院,英国 利兹 LS29JT)
溶菌酶(lysozyme,LZ),又称N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrase),是一种能特异性水解细菌细胞壁肽聚糖的糖苷水解酶。不同来源的LZ,其作用底物的种类及位点均有差异。蛋清LZ因来源广泛、成本低廉等特点,应用范围广阔。蛋清LZ是由129 个氨基酸组成的一条单一肽链,含4 对二硫键交联结合,结构稳定,在较大pH值范围内活性不受影响[1-2]。它的活性中心(Glu-35和Asp-52)可催化水解N-乙酰胞壁酸和N-乙酰葡萄糖胺间的β-1,4糖苷键。Glu-35作为质子供体,攻击底物C—O—C糖苷键的氧,而Asp-52共同参与稳定产生的瞬时C—O正离子再与离子化水分子生成的—OH发生反应[3-4]。通过N-乙酰胞壁质聚糖水解酶活性,破坏肽聚糖,导致细胞壁破裂、内容物泄露而使细菌溶解,从而实现杀菌。LZ的主要作用对象是革兰氏阳性菌(G+)的细胞壁。
作为大多数哺乳动物的先天免疫防御因子,LZ可增强巨噬细胞的吞噬和消化功能,与细菌脂多糖(lipopolysaccharides,LPS)结合,减少内毒素的释放,提高机体抵抗力。欧盟食品添加剂标准(E1105)已将其视作具有抑菌、溶菌和杀菌活性的功能因子,且美国药物管理局将其列为常规安全组分[5]。我国已允许将LZ用作婴儿奶粉的添加剂,以提高婴儿肠道抗感染能力,促进婴儿肠道中双歧杆菌的增殖。此外,基于LZ的保鲜剂对水产品具有良好的防腐效果[6]。但由于革兰氏阴性菌(G-)的细胞壁外存在LPS层,对自然溶菌酶(natureal lysozyme,NLZ)具有抗性,故NLZ对G-几乎无抑菌作用。为了拓宽LZ在食品抑菌方面的应用范围,近20 年来国内外学者们不断尝试对LZ进行各类修饰与改性,使LZ可以透过G-的LPS或与其相互作用,进入细胞,继而裂解细胞,扩展LZ的抗菌谱。目前LZ的分离纯化及传统修饰等方面综述已有一定的报道[2,7-10]。本文结合本课题组的前期工作,参考国内外有关的最新研究报道,重点就目前LZ的增效技术进行了详细综述,特别是结合了纳米及材料技术后的发展动态,着重关注了改性LZ在食品贮藏与保鲜等领域中的应用,以期为LZ的深度开发和综合利用提供可靠理论依据。
1 化学修饰
对LZ分子的化学修饰,是通过利用小分子或大分子化合物对LZ的侧链氨基酸基团进行处理,以获得具有特殊功能特性的蛋白质分子。目前用于LZ分子的表面化学修饰的化合物主要为有机小分子、多糖及其他分子。其中主要有机小分子包括脂肪酸、酚酸(醛)等;多糖包括半乳甘露聚糖、葡聚糖、甘露聚糖、壳聚糖等。
1.1 小分子修饰
利用有机小分子对LZ进行亲脂化修饰是LZ增效的重要手段之一(表1)。疏水性有机小分子与LZ的赖氨酸残基(氨基)共价结合后,起到疏水性载体的功能,将LZ送至质膜层。Ibrahim等[11]早在1990年就着手开展LZ的亲脂化修饰研究。将棕榈酸与蛋清LZ结合,发现酶活力基本不变,而修饰后LZ对大肠杆菌(Escherichia coli,E. coli)和迟缓爱德华氏菌(Edwardsiealla tarda,E. tarda)等G-表现出一定的抑菌活性,但过量结合棕榈酸分子将导致LZ抗菌活性丧失[11]。改用中短链饱和脂肪酸替代,可有效解决上述因棕榈酸的过量结合而导致的抗菌活性损失问题。随短链脂肪酸结合数量的增加,抗菌活性增强,但酶活力损失也随之增大。于是,在亲脂化修饰前,先利用美拉德反应对LZ实施糖基化修饰,既可避免酶活力损失(酶活力回收率从47.4%提升至82.4%),产物又对E. coli表现出极强的抗菌活性[12]。Takahashi等[13]亦将葡萄糖硬脂酸单酯与LZ通过Maillard反应共价交联,交联物的等电点降低至6~7,增加了LZ在酸性环境中的溶解度,并使其变性温度提升至74 ℃,但对E. coli并无抑菌效果,对G+菌抑制活性只保留了70%。
自身具有抑菌活性的酚酸(醛)类有机小分子也常被用于LZ的共价修饰。LZ中约0.5~4 个氨基可与紫苏醛偶联,保留了LZ的酶活力(>70%),且交联物使E. coli和金黄色葡萄球菌(Staphylococcus aureus,S. aureus)的存活率分别从80%与40%降至20%和10%[14]。肉桂醛与LZ(物质的量比为1∶3)偶联后产物(LC-3)的抑菌效果最佳,对E. coli和S. aureus的抑菌性能较NLZ分别提高了35.29%和72.73%,经LC-3(125 μg/g)处理28 d后,菌落总数降低至7.4×108CFU/g[15]。阿魏酸(ferulic acid,FA)修饰LZ的偶联产物(FA-LZ)的酶活力略有下降,但对G-的抑菌作用增强,修饰酶对E. coli和肠炎沙门氏菌(Salmonella enteritidis,S. enteritidis)的最小抑菌浓度(minimal inhibit concentration,MIC)均为0.5 mg/mL,对S. aureus的抑菌作用略有下降[16]。本课题组前期研究了经酚酸系列物(咖啡酸、阿魏酸、芥子酸等)修饰后LZ的抑菌特性变化,并总结出了抑菌特性与修饰物分子结构间的相互关系。此外,还可通过含氨基的活性分子与LZ的羧基共价结合。如Ramezani等[17]将LZ与氨基葡萄糖和碳化二亚胺分别按1∶1∶1质量比混合反应。交联物热稳定性提高了140%,高pH值环境下溶解度依然保持在82%以上,乳化稳定性等也有所改善。
1.2 多糖修饰
天然多糖及其衍生物在食品工业中既可作为凝胶、增稠剂、乳化剂和稳定剂,又可作为镀膜和涂层物质减缓食品的变质。在一定条件下,多糖分子还原末端的醛基可与蛋白质分子中氨基酸侧链的自由氨基(主要是赖氨酸侧链上的ε-NH2)发生Maillard反应,生成蛋白质-多糖共价复合物,能够增强蛋白质的功能特性,如溶解性、凝胶性、乳化性、起泡性等。其中,LZ的Lys-1末端氨基和Lys-98的ε-NH2基团是其与多糖交联的两个结合位点[18]。
Ibrahim等[11]在多糖与LZ间的Maillard反应与交联产物性能评价等方面做了较多贡献(表1)。LZ与半乳甘露聚糖的Maillard反应产物(图1)(质量比1∶1、pH 9.5、60 ℃、相对湿度79%),在50 ℃、40 min内可将E. coliIF0 12713全部杀灭;且50 mg/mL交联物可在60 min内可将E. tarda的存活率降低80%[19]。LZ与葡聚糖交联产物的热稳定性、溶解度和乳化性得到了极大的提高[20]。
此外,在50 mmol/L亚硫酸钠或半胱氨酸的存在下,利用葡聚糖、甘露聚糖、半乳甘露聚糖与LZ反应,发现当LZ与多糖以1∶5的物质的量比在60 ℃、pH 8.5时反应7 d后,达到最佳糖基化程度[21]。Hashemi等[22]研究发现LZ与黄原胶(xanthan gum,XG)(质量比1∶1、pH 8.5、60 ℃、相对湿度79%)通过Maillard反应得到交联物XG-LZ(400 µg/mL)可将E. coli与S. aureus的菌落总数分别减少3(lg(CFU/mL))和2(lg(CFU/mL))。黄芪胶由脂溶性成分黄蓍胶糖和水溶性成分黄蓍质(tragacanthin,TRG)物理混合构成。最适反应条件下(质量比5∶1、pH 8.5、60 ℃、相对湿度79%,8 d),大约2 mol TRG与1 mol LZ发生交联。TRG-LZ(4 000 µg/mL)交联物的抑菌效果显著提高,对S. aureus E. coli、蜡样芽孢杆菌(Bacillus cereus,B. cereus)和伤寒沙门氏菌(Salmonella typhi,S. typhi)的抑制率分别为90%、50%、80%和40%,但酶活力降低了约20%,这或许是由于多糖附着在蛋白质表面的自由赖氨酸产生了空间位阻而阻碍了酶底物复合体的形成[23],这与Nakamura[19]、Johnson[24]、Yadav[25]等的报道一致。TRG-LZ交联物的溶解性随着交联时间的延长而提高,且随pH值的增大而减小;乳化活性(较NLZ提高了84%)与泡沫活性均被提高,但乳化稳定性在反应2 d后缓慢下降。阿拉伯胶(acacia gum,AG)与LZ的交联物在酸性条件下具有更好的溶解性、热稳定性、乳化性和发泡性。此外,AG-LZ能显著地抑制体外和蛋黄酱中的S. aureus和E. coli的生长,将杀菌时间从10 d缩短为3~5 d[26]。Alahdad等[27]发现硫酸葡聚糖与LZ交联后对溶壁微球菌的溶解活性降低了31%,位阻增大和正电荷减少可能是交联后酶裂解活性下降的主要原因。
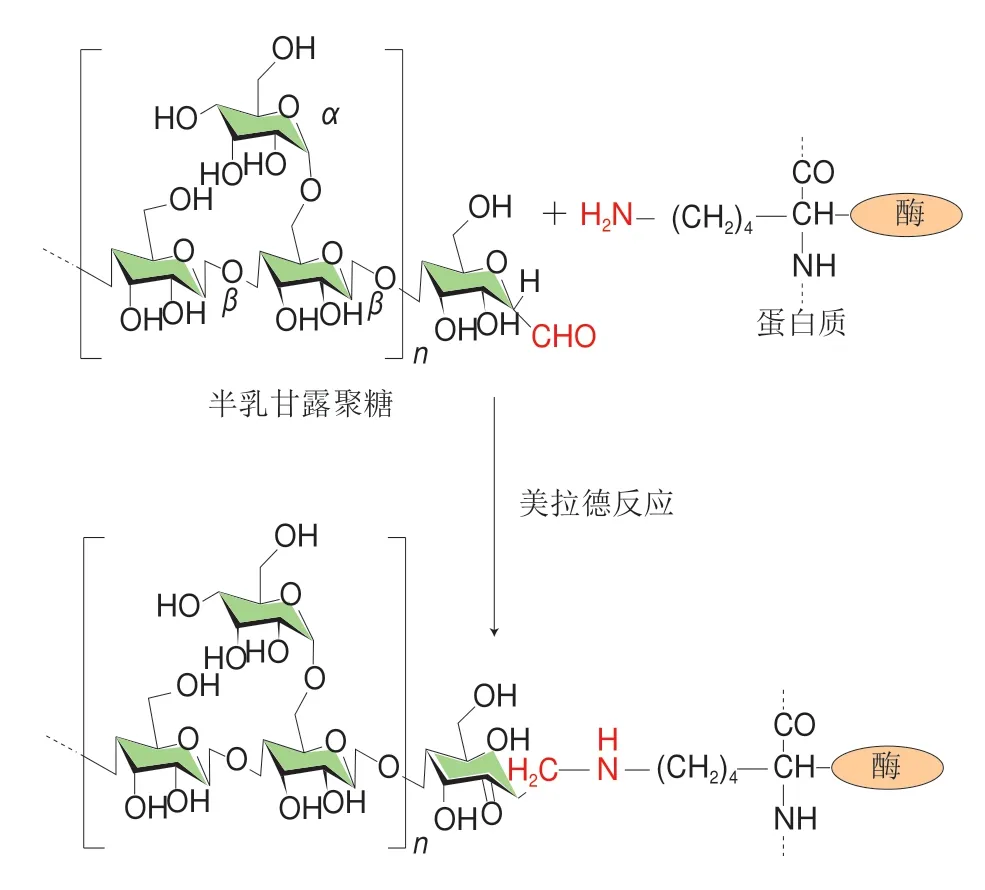
图 1 多糖与蛋白质结合方式的美拉德反应示意图[21,28]Fig. 1 LZ-polysaccharide conjugate was prepared via a Maillard-type reaction[21,28]
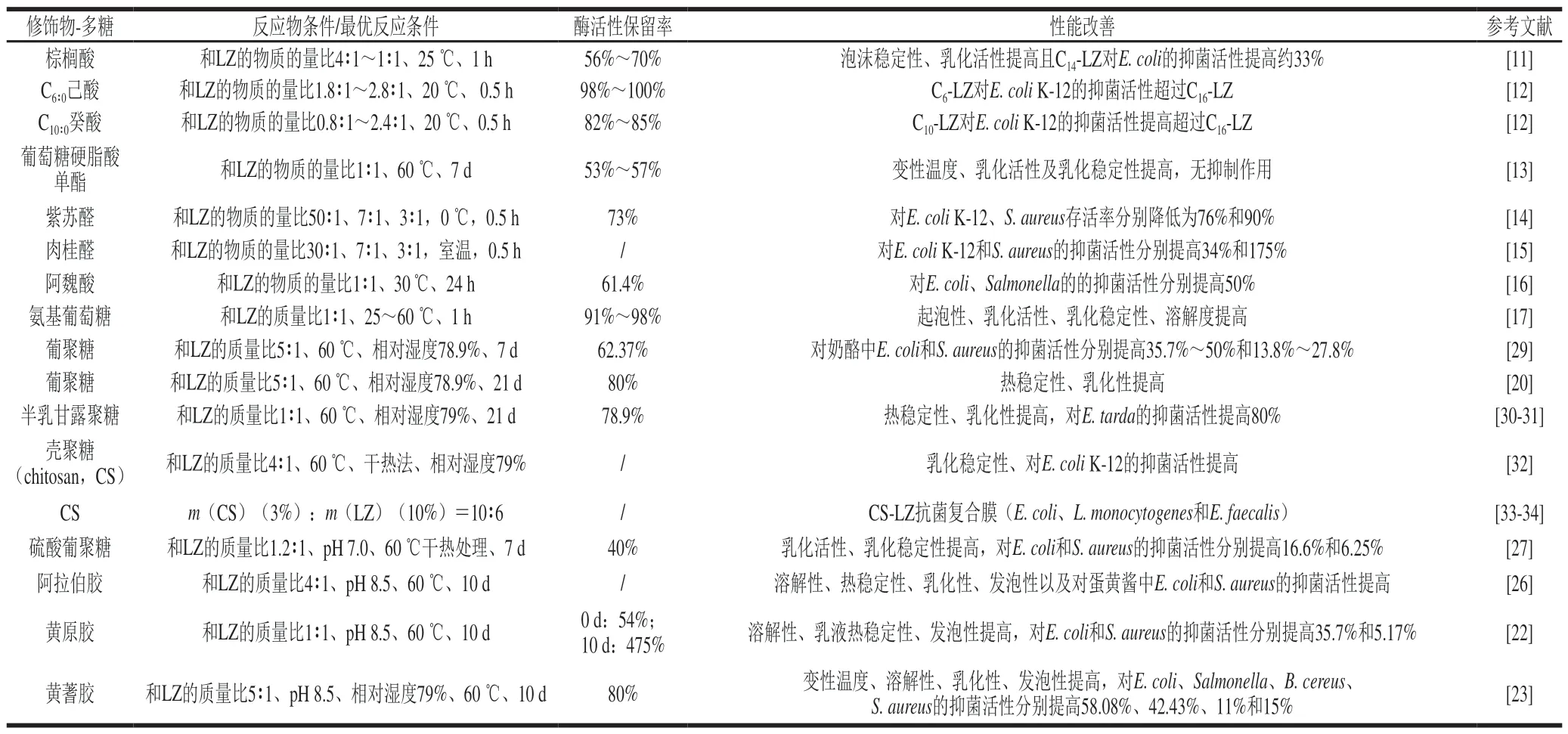
表 1 有机小分子及多糖修饰LZ及其功能改善情况Table 1 Improved properties of modified LZ with small organic molecules or polysaccharides
1.3 其他改性方法
Nodake等[35]用聚乙二醇(polyethylene glycol,PEG)化学修饰LZ,提高了LZ在碱性环境中的溶解性和对蛋白酶的水解抗性,修饰后的LZ能更好地与G-的LPS结合,导致细菌细胞外膜破损。Freitas等[36]又利用PEG的衍生物(聚乙二醇单甲醚-p-硝基苯基碳酸盐)对LZ进行修饰,修饰物在pH 6~10范围内仍保留完整的酶活性,且在50 ℃下仍有活性。这类修饰方法可使LZ适用于温度和pH值变化较大的食品加工过程中。Touch等[37]利用半胱氨酸的巯基与LZ的二硫键交换,由此引入新的巯基,使LZ结构更加灵活,表面疏水性增加,与S. enteritidis的LPS层连接更紧密,穿透细菌外膜能力增强,具有比LZ或仅热处理溶菌酶(heated lysozyme, HLZ)更显著的抗菌活性,对S. enteritidis的MIC比LZ和HLZ分别下降99.3%和96%,效果堪比一些抗生素。
2 物理改性
化学修饰法自身存在的缺点限制了其在食品中的应用范围,如化学试剂的毒性、修饰物引入而导致的食品感官变化等;而物理改性是通过热、压力、机械能等手段改变蛋白质分子构象和聚集,从而强化LZ的抑菌活性,更适于在食品体系中应用。
2.1 热处理
升高温度有利于氨基酸的疏水性位点暴露,从而增加热处理衍生物(heat-denatured lysozyme derivative,HDLZ)低聚体的表面疏水性,以及微生物(如E. coliK-12)细胞膜的结合能力,尤其与细胞内膜,致使细胞膜破损而使细胞死亡。Ibrahim等[28]发现LZ的热处理(pH 7.2、80 ℃、20 min)衍生物HDLZ仍保留54%的活性。尽管HDLZ活性随处理温度升高而降低,而对E. coli的抑制活性却增强。上述热处理后LZ中三段肽(T8、T9、T13)消失,出现4 个全新的尖峰。说明通过环状亚胺的形成,三段肽转为β构象。由此证实,加热引起了LZ的构象变化[10,38]。Derde等[39]通过测定最大斜率和滞后时间,对比了LZ与干热处理溶菌酶(dry heat treatment lysozyme,DHLZ)对E.coliML-35p细胞内外膜通透性的影响,也证实了DHLZ的亲膜活性更高,致使其对E. coli的杀菌效果更强。该课题组也探讨了DHLZ对G-的作用机制,结合表面压力和原子力显微镜(atomic force microscope,AFM)成像技术分析了LZ与磷脂间的相互作用[40],发现DHLZ(80 ℃、7 d)的物理化学性质(正电荷与柔变性)变化促进了其插入细胞膜的程度,进而诱导脂质重组和增大膜破坏度,最终强化了其杀菌性能。此外,DHLZ疏水性高、表面活性强,且所带正电荷增多,更易与外膜结合作用而使细胞膜产生更多更大的孔穴;与内膜作用而形成更多离子通道,这都增加了其对细胞膜的吸附与穿透能力[41]。
Cegielska-Radziejewska等[42]利用化学改性和热化学改性的方式制备了4 种LZ改性物。这些修饰方法均减小了LZ的水解活性,但对荧光假单胞菌(Pseudomonas fluorescens,P. fluorescens)的抑制活性均有所提高。其中,经体积分数1%双氧水改性的LZ在6 h内可降低GP. fluorescens3.3(lg(CFU/mL)),4 种改性物对G+表皮葡萄球菌(Staphylococcus epidermidis,S. epidermidis)均表现出很强的杀菌效果,6 h后菌落总数小于1.5(lg(CFU/mL)。将体积分数1%双氧水改性的LZ应用于猪肉糜的贮藏保鲜,猪肉糜中添加入CT2(5 mg/150 g),4 ℃贮藏144 h后,发现对假单胞菌属(Pseudomonasspp.)、肠杆菌(Enterobacteriaceae)和乳酸菌均具有较好抑制作用,这是因为热处理(pH 4、70 ℃、15 min)显著提高了酶分子的疏水性[43]。
2.2 高压处理
高压技术是一种非热食品加工技术,在常温或较低温下采用100~900 MPa压力下进行[44]。经高压处理后,不仅破坏了蛋白质分子间的氢键、离子键等非共价键,还引起了理化性质的改变。Vannini等[45]研究了高压均质(high pressure homogenization,HPH)对脱脂牛奶中的LZ的抑菌活性的影响。HPH(100~130 MPa、37 ℃)处理3 h可明显减少脱脂奶中单增李斯特菌(Listeria monocytogenes,L. monocytogenes)、E. coli和S. enteritidis的活菌数。HPH与LZ之间的相互作用关联着蛋白的构象改变。LZ经HPH处理后,对植物乳杆菌(Lactobacillus plantarum,L. plantarum)具有抑制作用,但LZ无此效果,进一步证明HPH促使LZ活性中心结构改变。研究人员还通过将HPH(100 MPa)与短时热处理结合,成功强化了LZ对牛乳中L. monocytogenes的抑菌效能,扫描电子显微镜(scanning electron microscope,SEM)结果显示,HPH-LZ使L. monocytogenes细胞膜大面积破损,细胞质内容物泄漏[46]。Tribst等[47]对比研究了HPH(<190 MPa)和高压处理(high pressure process,HPP)(<600 MPa)对LZ酶活力及抑菌活性的影响。两种高压条件下酶活力均提高(HPH提高29%、HPP提高17%),但仅HPP能提高LZ对B. cereus和嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus,G. stearothermophilus)的抑菌活性,分别提高50%和66%,而对E. coli和粪肠球菌(Enterococcus faecalis,E. faecalis)的抑制效果不明显。高压处理对LZ的抑菌活性的调节机制可能是:1)对细胞壁或外膜的直接破坏作用;2)随后胞内酶透过破损细胞膜的泄漏量增加;3)高压技术使蛋白质空间结构发生变化,充分暴露了疏水区,使蛋白不易发生凝聚,与细胞膜结合作用增强。
3 生物改性
生物改性也是一种提升LZ抑菌性能的方法,将疏水肽或抗菌肽直接引入LZ分子结构中,增强其对G-的抑菌活性。如Kato等[48]将定点突变后的LZ编码序列导入酵母细胞中,使平均分子质量为75 kDa的聚甘露醇-LZ衍生物(R2lT)在酵母表达系统中产生。为了提高对E. coli的抑菌活性,利用DNA重组技术将疏水肽(Phe-Val-Pro(H3)Phe-Phe-Val-Ala-Pro(H5)、Phe-Phe-Val-Ala-Ile-Ile-Pro(H7))基因序列插入至LZ cDNA的Leu 129 C-末端。改性后LZ保持了75%~80%的酶活性,但对E. coli的抑菌活性增强,并进一步指出疏水肽链长度与催化区对疏水肽融合LZ的抗菌活性起重要作用[49],这是其对E. coli细胞内膜的电化学势能的破坏与LZ对外膜和肽聚糖共同作用的结果[50](图2)。此外,Zhu Dewei等[51]利用可抑制G-菌生长的抗菌肽(shorter peptide,SP)(A-W-V-A-W-K)对野猪溶菌酶(Sus scrofalysozyme,SSL)的C-末端和N-末端进行融合,制备了5 种重组结构(图3)。发现N-末端融合重组体(SP-SSL和6SP-SSL)对G-表现出更强的抗菌性能,特别是6SP-SSL,并指出增加N-末端融合SP的重复单元,有利于提高其抑菌效果,这是因为改善了酶的疏水性,更有利于疏水性细胞膜相互作用。未来将更多关注肽链-LZ融合物的晶体结构分析,这有利于探究其抑菌作用机制,寻找到LZ抑菌活性的理性调控策略。
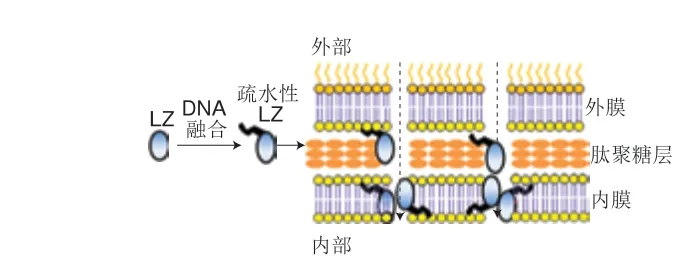
图 2 LZ蛋白质结构中加入一个外露的疏水结构域[49-50]Fig. 2 Interaction between cell membrane and hydrophobic peptidefused LZ[49-50]
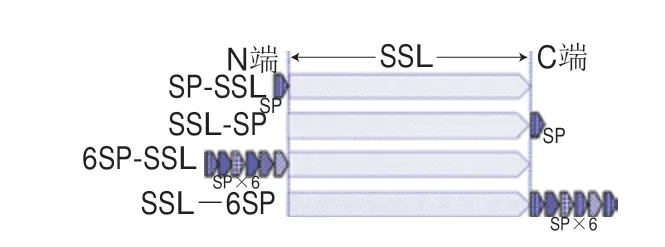
图 3 抗菌肽修饰LZ产物的结构[51]Fig. 3 Schematic illustration of five recombinant constructs for modified LZ with antibacterial peptides[51]
4 含LZ的新型抗菌材料
近年来,纳米与材料技术的蓬勃发展为新型抗菌材料的制备与应用提供了一条广阔途径。目前的研究主要集中在开发一类制备方法简单、无毒、多功能复合、易回收的高效抗菌新材料,如抗菌膜,可作为功能因子的载体,通过活性成分的可控释放,实现抗氧或抑菌的长效表现。
4.1 静电纺丝纳米纤维抗菌膜
静电纺丝是一种简单高效的纳米纤维制备方法。产品自身的细孔结构和高比表面积更有利于抗菌成分从包装材料向食品表面持续释放[52]。Zhang Tingting等[53]运用层层自组装技术(lay-by-lay self-assembly technique,LBL)将带正电荷的LZ与带负电荷的果胶层层交替地附着于纤维素纳米纤维垫上(图4)。随着外层包覆膜厚度的增加,纤维素垫的抑菌活性提高。其中,(LZ/果胶)10.5LBL多层(LZ占据外表面)包覆纳米纤维素垫具有最强的抑菌活性,对E. coli和S. aureus的抑菌圈直径分别为6.7 mm和8.6 mm;这是因为带正电荷LZ易于吸附在带负电的细胞表面,有利于进攻肽聚糖;其次,果胶通过增加黏度提高对G+的抑菌活性。Feng Kun等[54]将LZ与肉桂精油(cinnamon essential oil,CEO)作为抑菌剂,结合聚乙烯醇(cinnamon essential oil,PVA)与环糊精(β-cyclodextrin,β-CD)制备出新型静电纺丝纳米抗菌膜(PVA/β-CD/CEO/LZ);当上述两种抑菌剂质量分数分别为0.25%和2%时,抗菌膜对L. monocytogenes和S. enteritidis表现出最强抑菌活性,MIC为0.8~1 mg/mL,最小杀菌浓度(minimum bactericidal concentration,MBC)为6~7 mg/mL。对Aspergillus niger和Penicillium也表现出卓越的抗真菌效果。因此,该静电纺丝纳米抗菌膜可被用于食品的贮运与包装。
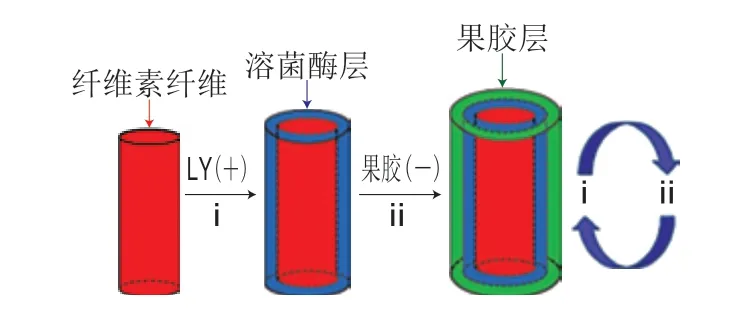
图 4 纳米纤维垫上的LZ/果胶层层自组装过程[53]Fig. 4 Schematic diagram of LZ/pectin LBL modification through layer-by-layer self-assembly on nanofibrous mats[53]
4.2 可食用抗菌膜
活性抗菌膜在防治食源性致病微生物引起的食品污染中的优势作用亦引起学者们的极大兴趣,学者们尤其热衷于制备无毒、可生物降解、原材料天然且成本低廉、可食用的抗菌膜[52,55-58]。Khairuddin等[56]通过溶液浇铸技术制备了LZ/小麦淀粉膜。48 h后,可将E. coli和枯草芽孢杆菌(Bacillus subtilis,B. subtilis)的数量分别减小至1.74(lg (CFU/mL))和3.48(lg (CFU/mL))。Silva等[57]运用水悬液溶剂浇铸技术制备了由支链淀粉(pullulan,PL)和LZ纳米纤维(lysozyme nanofibers,LNFs)构成的透明、光滑的可食用保鲜纳米复合膜(PL/LNFs),其具有较好的机械性能(1.91~2.50 GPa)和热稳定性(>225 ℃)。LNFs的引入强化了膜的抗氧化及抑菌活性,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)的消除活性为77%(LNFs质量分数15.0%),对S. aureus的抑菌效果随着LNFs的含量增加而增强。Zimoch-Korzycka等[52]利用羟丙基甲基纤维素(hydroxypropyl methyl cellulose,HPMC)水溶液和壳聚糖(chitosan,CS)作为铸膜材料,将血清胱抑素(cystatin,C)/LZ(C/LZ)用作抗菌剂,制备出一种可食用抗菌膜(HPMC/CS/C/LZ);发现提高CS与C/LZ含量可增加抗菌膜对黄色微球菌(Micrococcus flavus,M. flavus)和无名假丝酵母(Candida famata,C. famata)的抑制活性;因制备过程简易,且热机械性和抑菌活性良好,其有望被广泛应用于肉制品的包装与贮藏过程。Wang Zhe等[55]利用胶原蛋白与LZ制备4 种组成不同的可食用膜(CL1~4),并将其用于三文鱼切片的保鲜。结果表明4 种可食用膜能明显提升三文鱼切片在4 ℃保藏15 d后的产品品质;尤其是CL4(0.007 g/mL LZ、0.04 g/mL胶原蛋白)可明显减少总挥发性盐基氮含量,又能显著抑制三文鱼冷藏中微生物的生长。Benelhadj等[58]利用钝顶螺旋藻分离蛋白(arthrospira platensis,API)与LZ复合制备了一种用于食品贮藏的可食用LZ/API抗菌膜。膜中LZ的释放动力学特性受pH值影响,其中pH 7时LZ的释放率较低,这是由此时带正电LZ与带负电API间的强相互静电吸引作用所致,进一步影响可食用膜的抑菌效能。
4.3 杂化抗菌膜
有机-无机杂化膜是在有机网络中引入无机质点,改善了网络结构和修饰膜的孔结构和分布,提高了膜的综合性能。如Sun Junfen等[59]采用原位合成法制备CS/羟基磷灰石(hydroxyapatite,HAP)杂化膜(CS/HAP),用于吸附LZ。在pH 10.0、LZ平衡质量浓度1.96 mg/mL时,CS/HAP杂化膜最大吸附量可达203.9 mg/g。Yu Wuzhong等[60]先将CS/Ag/HAP杂化膜通过电化学聚集技术固定在表面,再将LZ膜附着其上,以此提高杂化膜(LZ/CS/Ag/HAP)的抗菌性能。12 h后杂化膜对E. coli和S. aureus的抑制效率分别为95.28%和98.02%,且持续5 d后的抑菌效能仍为95.42%和97.46%。Li Xiang等[61]将LZ/累托石(rectorite,REC)复合物与CS溶液混合,制成具有抑菌活性的杂化薄膜(CS/REC/LZ)。杂化膜对E. coli和S. aureus的生长抑制率分别为45.12%和92.67%。这是由于REC有利于吸附和固定细菌;其次,CS单链的聚集增加了单位体积的正电荷,对G-的抗菌活性更强(E. coli表面的负电荷密度大于S. aureus,更容易被带正电的杂化膜吸附杀灭)。近年来,基于碳纳米管的膜材料方面研究不断的深入。将LZ与埃洛石纳米管(halloysite nanotubes,HNTs)结合后制得LZ/HNTs纳米复合物,经高能球磨法将该复合物与聚乳酸(polylactic acid,PLA)制成厚度为150 µm的抗菌膜(PLA/HNTs/LZ)。或将HNTs-LZ纳米复合物与聚己内酯(polycaprolactone,PCL)组合,通过热压铸膜技术制备出抗菌膜(PCL/HNTs/LZ)。这些膜均对Bacillussp.有抑制作用[5]。
4.4 其他纳米复合材料
通过吸附、包覆和表面交联等技术将LZ固定在纳米材料上,调整改变纳米包装材料的形态,有效调节了LZ的释放速率。
自组装超薄膜的结构及制备工艺相对简单。构建大尺寸的自组装结构需要借助于模板,在模板和组件层之间的静电相互作用是层层修饰过程的驱动力。通过LBL自组装技术,可将LZ和单宁酸(tannic acid,TA)交替地沉积在Fe3O4纳米粒子表面[62]。通过聚电解质多层膜扩散可将Ag+与TA酚羟基结合作用,原位还原制得新型纳米银磁性复合材料(LZ/TA)n-Ag(图5)。TA中丰富的羰基和酚官能团能与LZ分子间形成良好的氢键,从而提高薄膜的稳定性。同时,(LZ/TA)5-Ag磁性颗粒表现出极强的抗菌活性,其中纳米银磁性纳米复合材料(magnetic nanocomposite arming with silver nanoparticles,AgNPs)浓度从1.5 mmol/L增加到3.5 mmol/L,E. coli和S. aureus的抑菌圈直径增大3~4 mm,表明膜的抗菌性能主要取决于纳米Ag含量。并进一步解释了(LZ/TA)n5-Ag对E. coli的作用机制,即(LZ/TA)n5-Ag可改变细胞膜的通透性,破坏细胞结构的完整性,导致细胞释放胞质β-半乳糖苷酶增多。雷文茜等[63]以聚丙烯酸(polyacrylic acid,PAA)和聚乙烯亚胺(polyethyleneimine,PEI)为构筑单元,运用LBL自组装技术制备了一种“动态”聚电解质多层膜(PEI/PAA)n。该复合膜独特的海绵结构在饱和水蒸气的处理下可闭合回归成致密膜结构,借助简单的毛细作用将LZ负载并固定于多层膜中。此抗菌膜可有效抑制S.aureus,且同时负载LZ和乳铁蛋白的多层膜还可提升对E.coli的杀菌效果。
蛋白质通过共价交联结合在纳米材料表面,同时保持其自身的结构、功能和稳定性,是生物纳米材料制备技术中的一个重要过程,也是蛋白质固定化领域的重要应用。如Borzooeian等[64]通过碳化二亚胺交联剂将LZ固定在具有羰基功能团的单壁碳纳米管(single walled carbon nanotubes,SWCNTs)上,在70 ℃,pH 3.0~10.0范围内表现出卓越的稳定性。Liburdi等[65]使用戊二醛交联剂将LZ共价结合在可食用CS珠上,并研究了交联物在真实白酒体系中的抑菌活性。结果表明,尽管共价修饰酶在白酒中的抑菌活力较NLZ有所下降,但酶活力稳定性提高,且抑菌活性并未受到白酒中自由SO2及总酚浓度的影响。杨龙平等[66]为了提高LZ的稳定性及对G-的抑菌性能,以Au纳米颗粒为核,通过表面定向修饰LZ,制备了LZ-Au纳米抑菌颗粒。并发现与未修饰的纳米Au及NLZ相比,LZ-Au纳米颗粒对S. aureus和E. coli的抑菌效果均显著增强,且有协同抑菌作用;LZ-Au纳米颗粒(0.1 g/L)可以彻底杀死两种细菌,并且具有持久抑菌性及良好的生物相容性。
深度共熔溶剂(deep eutectic solvents,DES)由于其自身独特物化性质被人们视为可能比离子液体更为绿色的非水介质而被广泛应用于各个领域。最近,Silva等[67]报道了一种基于DES的LZ纳米纤维的高效制备方法。LZ(约70 000 U/mg)溶解于含有20 mmol/L甘氨酸的HCl缓冲溶液(pH 2、10 mmol/L)中,与体积分数10%深度共熔溶剂(氯化胆碱、乙酸体积比1∶1)混合均匀,50 ℃和70 ℃培养。最终获得了长0.5~1 µm、厚0.02~0.1 µm的LNFs。
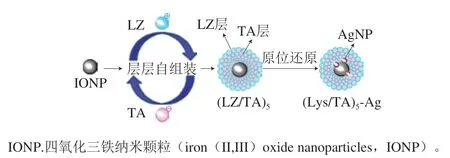
图 5 层层自组装制备(LZ/TA)n- Ag的过程及其抑菌性能分析[62]Fig. 5 Schematic illustration of the fabrication process of (LZ/TA)n-Ag nanoparticles through layer-by-layer self-assembly and assessment of their antibacterial properties[62]
5 结 语
LZ因其独特的生物学功能,在食品等领域具有巨大的应用价值和广阔的开发前景。通过化学、物理和生物改性方法,以及结合纳米与材料技术或新型绿色溶剂技术等对LZ实施分子结构修饰,突破其自身的局限性,提高其对G-的抑菌效能,扩大抑菌谱,有着重大的科学和现实意义。主要改性方法有:1)引入修饰分子,提高LZ的疏水性(亲脂性),或是与修饰物自身的抑菌效果协同增效;2)借助机械能或环境条件变化(温度、压力、pH值、介质极性等),调整LZ分子构象或聚集状态,暴露更多的氨基酸疏水性活性位点;3)提高修饰后LZ自身正电荷分布;4)借助纳米与材料技术,提高LZ的抑菌作用效率与时长,拓展基于LZ的新型纳米材料在食品中的应用范围。未来研究人员仍会持续关注纳米制备新技术与纳米新材料在LZ增效应用中的可行性,并将修饰LZ安全有效地应用于食品领域。同时,对LZ分子进行更理性地构效调节也将是一个重要领域,深入结合化学或基因重组技术对LZ进行定点改造。这些研究能为LZ研究开发和综合利用提供理论依据和有效途径。

