热处理对α-乳白蛋白变性及其与其他乳蛋白相互作用影响的研究进展
赵 烜,李向莹,秦于思,陈 笛,王存芳*
(齐鲁工业大学(山东省科学院)食品科学与工程学院,山东 济南 250353)
热处理是乳制品生产加工中至关重要的环节,可以保证产品的生物安全性,延长乳制品的货架期,还可以改善乳制品的加工性能[1-2]。α-乳白蛋白(α-lactalbumin,α-La)是乳清蛋白中主要成分之一,经热处理发生变性,伴随着其天然结构的破坏和与其他乳蛋白的相互反应,导致乳的性能和乳中蛋白形态发生改变[3]。本文阐述了α-La在热处理过程的自身变化和与其他乳蛋白之间的相互作用,可以为液态乳的加工提供理论依据。
1 典型的热处理方式
目前对乳的热处理方式有巴氏杀菌、高温灭菌。巴氏杀菌旨在除去乳中的有害微生物,尽量保留乳中的营养物质[4];灭菌的目的是实现商业无菌,主要是使最耐热的致病菌肉毒杆菌芽孢失活,一般最低灭活条件为121 ℃、3 min[5]。灭菌乳又可分为保持灭菌乳和超高温灭菌(ultra-high temperature,UHT)乳两类。保持灭菌是将经过巴氏杀菌、均质、灌装入容器并密封等处理之后,然后乳连同容器再次灭菌。UHT工艺包括:预热(80~95 ℃)、预热温度的保持、升温至灭菌温度、灭菌温度的保持、冷却和无菌灌装。嗜温微生物孢子灭活的有效性和控制化学变化的有限化,分别界定了灭菌温度和保持时间组合的下限和上限[6]。表1总结了典型的热处理方式及其特点[7-8]。热变性程度受到热处理温度和持续时间的影响,温度越高,持续时间越长,变性程度越高。乳清蛋白各成分的变性温度不同,例如α-La在66 ℃开始变性,β-乳球蛋白(β-lactoglobulin,β-Lg)的变性温度则在75 ℃。因此,若热处理方式不同,达到的温度不同,可能引起蛋白质变性的程度不同。
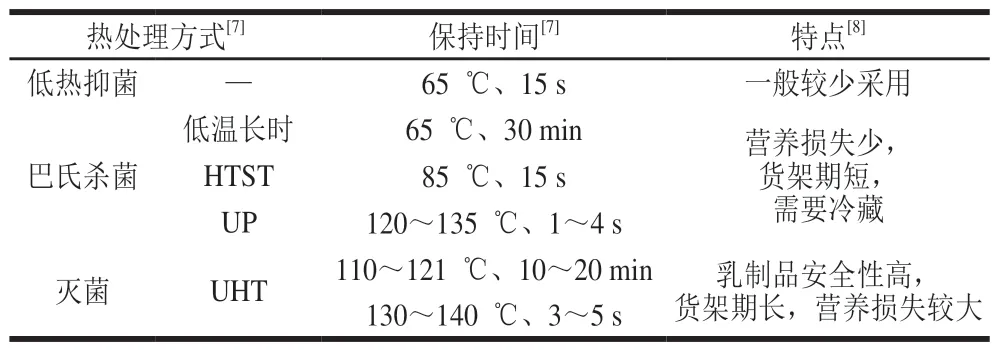
表 1 不同的热处理方式及其特点Table 1 Different heat treatment methods and their characteristics
2 不同乳源中的主要乳清蛋白
乳清蛋白中各蛋白组分的含量及所含有的二硫键(S—S)、巯基(—SH)个数是乳蛋白聚集的基础,其具体机制是在达到蛋白的变性温度后,—SH和S—S暴露,—SH具有反应活性,通过—SH/S—S的交换反应连接蛋白质,形成蛋白聚集体。不同乳源乳清蛋白中各蛋白组分的含量具有一定的差异,如表2所示,山羊乳中β-Lg在乳清蛋白中含量最高,而牛乳中含量较高的乳清蛋白组分为α-La。不同乳源乳清蛋白中α-La、β-Lg、SA含量的差异,导致在实际生产中不同乳源会出现蛋白聚集体的差异,从而对不同乳源的乳品品质产生较大的影响。

表 2 不同乳源的主要乳清蛋白及特殊化学键Table 2 Major whey proteins and special chemical bonds from different milk sources
3 α-La的结构
α-La是低分子质量的球形乳清蛋白,约为14.2 kDa[13]。天然的α-La的结构由两个部分组成:一个大的α-螺旋结构域和一个小的β-折叠结构域,它们通过钙结合环连接[14]。α-La是金属结合蛋白,每分子结合1 个Ca2+。Ca2+结合在蛋白质的10 个序列氨基酸之内,称之为转角结构,它形成一个由二硫键连接残基73和残基19包围的环状部分。转角结构中有5 个天冬氨酸(Asp)残基存在,其中有3 个参与Ca2+的结合[12]。α-La通过4 个分子间二硫键(6-120、61-77、73-91和28-111)保持其结构的稳定,α-La中最活跃的S—S是处在蛋白结构表面的Cys6-120,一旦被切割开,就可以与其他分子上的—SH发生—SH/S—S反应[15]。α-La有两种构象,在乳正常pH值时天然构象为N构象,当pH<5.0时,会由N构象向A构象(酸构象)转变[12]。
4 热处理对α-La及其与其他乳蛋白相互作用的影响
4.1 热处理对α-La结构的影响
α-La热变性的本质是蛋白结构的去折叠化,三级结构被破坏,暴露出包埋在分子内部的二硫键,形成改性单体蛋白。由于α-La不含有游离的—SH,变性的α-La不具有反应活性,不能发生巯基-二硫键的交换[15],因此自身不能形成聚合物及良好的凝胶结构。Schokker等[16]的研究证实了这一点,其对α-La溶液(10 g/L)进行75 ℃、70 min的热处理,未生成聚合物。α-La的热力学转变温度为66 ℃,即在66 ℃时有部分发生变性,其变性温度为96 ℃[17-18]。在60~120 ℃下,其变性程度与热敏指标糠氨酸、乳果糖含量均存在很强的相关性(R2>0.99),可作为高温热处理的指示物[19]。
由于Ca2+的存在,α-La会反复发生一种热力学转变现象[20]。当α-La与Ca2+相结合时具有较好的稳定性,表现为即使发生变性,冷却后仍可复性。当1 molα-La中含有的Ca2+低于1 mol时,热力学转变温度从66 ℃降低到34 ℃左右,但若提高体系中Ca2+含量,热转变温度回升至60 ℃左右[21]。α-La与Ca2+的结合常数与pH值有关,热力学转变现象也受到pH值的影响。pH 6~8时,α-La与Ca2+的结合常数恒定;当pH值小于4时,结合常数快速降低;pH值小于3.5时,环境中高浓度的H+会与Ca2+竞争在蛋白上的结合位点,减弱了Ca2+与α-La的结合,使α-La的构象发生酸转变,钙结合位点处的Asp残基发生质子化,α-La失去结合Ca2+的能力。此时,α-La在较低温度时便可发生变性,且不能复性[22]。α-La对Ca2+具有较高的亲和力,一旦与Ca2+重新结合,α-La就可重新获得天然构象,复性程度可达80%~90%[22-24]。Anema等[25]的研究表明,即使α-La与Ca2+的结合常数恒定,α-La的热变性也受pH值调控。90 ℃热处理α-La 20min,随着pH值从6.5升高到6.9,α-La的变性比例从90%升高到接近100%。说明在同一加热时间,pH值越高,α-La的变性程度越高。
α-La的变性程度与温度也有关。Jeanson等[26]研究发现,在65 ℃下处理60 min,α-La依然没有发生热力学转变,基本没有发生变性;当加热至75~85 ℃,变性速率随着加热时间延长明显加快;当温度升高到85 ℃时,α-La的变性比例进一步升高,在加热40 min时,α-La几乎全部变性;在90 ℃加热30 min就可使天然α-La完全变性。α-La热变性随着温度的升高和冷却可以分为5 个阶段(表1)。在30 min内对牛乳中天然α-La进行不同温度的热处理,结果表明,加热温度越高,蛋白发生变性的比例越高(图1)。若以10%的天然α-La残存率为标准,温度越高,则所需时间越短[26](图1)。

表 3 α-La热变性的5 个阶段[27-29]Table 3 Five stages of α-La thermal denaturation[27-29]
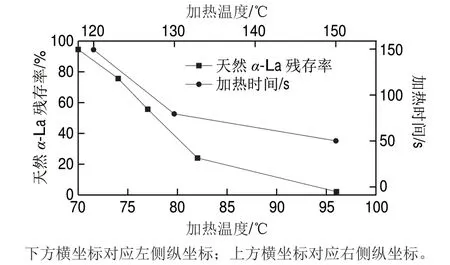
图 1 不同温度下30 min热处理与天然α-La残存率的关系、当残存率为10%时加热温度与加热时间的关系[26]Fig. 1 Effect of heat treatment for 30 minutes at different temperatures on residual rate of natural α-La and relationship between heating temperature and heating time at residual rate of 10%[26]
总之,α-La的变性程度受到pH值、加热温度、加热时间的影响。当pH值不影响α-La与Ca2+结合常数时,随着pH值升高,蛋白的变性程度增大,变性速率加快。若α-La与Ca2+结合常数受pH值的影响,则α-La的复性能力减弱。加热温度越高,则蛋白变性程度越高,所需热处理时间越短。同样地,加热时间越长,在能导致蛋白变性的温度下,变性程度越高。
4.2 热处理导致的α-La与β-Lg的结合
β-Lg存在的情况下,热变性的α-La能与β-Lg的—SH发生—SH/S—S交换而形成聚集体,可以推测β-Lg在蛋白聚集的反应中起到主导作用。天然β-Lg以二聚体的形式存在,其热转变温度高于α-La,且受热后解聚成单体,进一步受热则暴露出分子内部的—SH和疏水侧链,易于发生—SH/S—S反应并形成疏水键,此时再与1分子未变性β-Lg内的S—S反应形成分子间二硫键,同时释放出一个新的具有反应活性的—SH[30]。若对α-La和β-Lg的混合溶液进行热处理,蛋白高度变性后出现4 种聚集体:β-Lg聚集体、α-La/β-Lg二聚体、α-La/β-Lg聚合物和α-La二聚体。Schokker等[16]阐明了α-La与β-Lg加热产物的反应机制:天然β-Lg受热变性后暴露出—SH具有反应活性继而发生聚合,形成了β-Lg聚集体(二聚体、三聚体、多聚体);热变性的α-La暴露出分子内部的二硫键,与1分子具有反应活性的β-Lg发生—SH/S—S交换生成α-La/β-Lg二聚体;1分子β-Lg三聚体先与1分子去折叠化的α-La形成中间产物,另一分子去折叠化的α-La结合到中间产物的α-La上形成α-La/β-Lg聚合物;当β-Lg三聚体从α-La/β-Lg聚合物上脱落,剩下的部分即为α-La二聚体(图2)[12,16,31]。α-La只有在β-Lg存在时才会发生聚合反应,Dalgleish等[32]的研究证实:当少量的β-Lg加入到α-La溶液中进行热处理,仅生成数量相当少的聚合物,提高溶液中β-Lg的含量,聚合物的含量也随之增加。β-Lg不仅起到催化作用,并且提供了游离—SH与α-La分子内的S—S(可能是Cys6-Cys120)发生—SH/S—S交换作用。这也充分说明,β-Lg在与α-La的聚合反应中起到了关键作用。
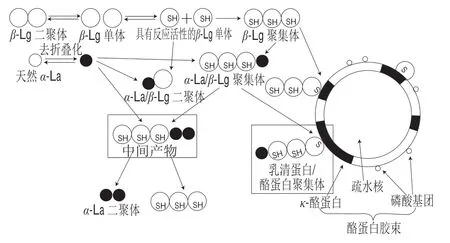
图 2 α-La、β-Lg与酪蛋白胶束结合示意图[12,16,31]Fig. 2 Binding mechanism of α-La and β-Lg to casein micelles[12,16,31]
α-La与β-Lg的反应受到热处理温度和时间影响。王立枫等[33]对α-La与β-Lg混合溶液60~90 ℃加热10、20、30 min,结果表明,60 ℃时,还未达到β-Lg的变性温度,已有部分α-La发生变性并与β-Lg形成极少量α-La/β-Lg二聚物;70 ℃时,α-La/β-Lg二聚物生成率上升到1.63%;80 ℃时,达到了β-Lg的热转变温度,α-La与其形成了蛋白聚合物,蛋白聚合率为16.95%,而α-La/β-Lg二聚物的生成率持续降低,当时间延长到30 min,蛋白聚合物的生成率随着时间延长稍有增加;90 ℃时,温度明显高于β-Lg的变性温度,蛋白聚合物的生成率达到23.10%,此时α-La/β-Lg二聚物的生成率降到1.23%,延长加热时间使蛋白聚合物增幅更明显。因此随着温度的升高以及时间的延长,α-La/β-Lg二聚物的质量分数下降,而α-La/β-Lg聚合物的质量分数明显增加(图3)。
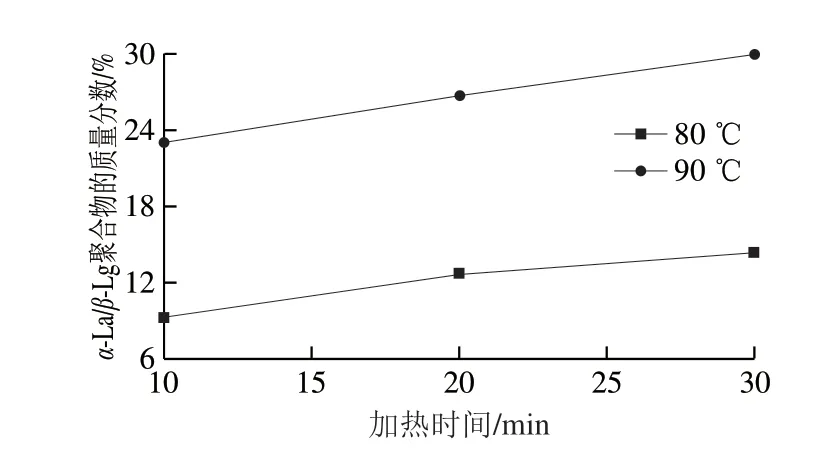
图 3 不同加热温度和时间下α-La/β-Lg聚合物的质量分数变化[32]Fig. 3 Variation in α-La/β-Lg complex concentration at different heating temperatures and times[32]
王立枫等[33]从β-Lg含有—SH的角度解释了α-La与β-Lg的聚合反应主要受温度影响的原因,β-Lg暴露出—SH的临界温度为70 ℃。在60~70 ℃加热乳清蛋白10 min,基本未检测到释放出的—SH,但在80 ℃加热1 min,—SH的释放量则大幅度增长。在高温下,α-La分子内S—S的断裂也会略有助于—SH的释放。在产生α-La/β-Lg蛋白质聚合物的过程中,这两种蛋白含量都显示出不同程度的降低,其中β-Lg含量减少尤为明显,且高于α-La,表明在聚合作用中β-Lg的主导地位。采用HTST巴氏杀菌热处理原料乳,形成的可溶性α-La/β-Lg乳清蛋白聚合物具有高电荷、结构致密的特点,可用于生产低黏度、低浊度和高溶解性的蛋白饮料[34]。
4.3 热处理导致的α-La与酪蛋白胶束的结合
在乳的加热过程中,α-La和β-Lg的聚合物表现出与κ-酪蛋白(κ-casein,κ-CN)的反应性[17]。在乳的热加工过程中,最主要的反应是乳清蛋白与κ-CN的聚合,这种聚合由β-Lg主导,伴随着α-La的参与。目前的研究大多以乳清蛋白为整体来探究与κ-CN的聚合反应,κ-CN以毛发状附着在酪蛋白胶束表面[35],α-La与酪蛋白胶束的结合依赖β-Lg的存在[36]。在α-La/β-Lg聚集体中,带有活性—SH的β-Lg结合到κ-CN上,实现了α-La与酪蛋白胶束的间接反应。因此,α-La、β-Lg与酪蛋白胶束结合形成的聚集体有两种:第一种是β-Lg聚集体与κ-CN结合;第二种是α-La/β-Lg聚合物的首端β-Lg与κ-CN结合[37]。
至今有两种有关α-La、β-Lg与κ-CN的热聚合机制被提出。第一种机制是:κ-CN先从酪蛋白胶束上解聚下来进入乳清相,然后与α-La/β-Lg聚集体、β-Lg聚集体通过—SH/S—S交换发生相互作用形成聚集体[38]。第二种机制是:乳清蛋白与位于酪蛋白胶束表面的κ-CN发生聚合,形成不溶性聚合物(图2)[31]。另外αs2-CN也可以与乳清蛋白发生反应,但是由于αs2-CN处在胶束内部,难以与乳清蛋白接近,只有胶束结构被破坏才会暴露出来[39]。具体哪种聚合机制处于主导地位至今尚不明确,许维怡[40]的研究证明可能是第二种机制占主导。乳清蛋白/酪蛋白胶束聚合物机制中,pH 6.8是一个临界值,此时结合在酪蛋白胶束上的不溶性聚合物开始解聚进入乳清相。在pH值从6.8上升至7.2的过程中,α-La、κ-CN和β-Lg在乳清相中的质量分数均升高,这表明形成的聚合物(含α-La、κ-CN和β-Lg)从酪蛋白胶束表面解聚进入了乳清相中,形成了可溶性的乳清蛋白/κ-CN聚合物;当pH值大于7.2时,乳清相中的α-La、β-Lg和κ-CN形成的聚合物含量出现小幅度下降,目前导致这种变化的原因还不清楚[41-43],可能是由于在碱性条件下,αs2-CN和β-CN也逐渐从胶束中解离,与κ-CN发生竞争,导致了α-La、β-Lg和κ-CN三者形成的聚合物减少。在70~110 ℃的热处理条件下,对这种聚合物的结构影响不大,但在超高温处理下,聚合物遭到一定程度的破坏[40]。α-La、β-Lg与κ-CN的相互作用产生的两种聚合物可以有效缩短酸凝乳的凝乳时间,使酸凝乳具有更致密、均匀的凝胶微结构,可溶性聚合物的作用要优于乳清蛋白/胶束聚合物。在热加工时调节pH值也不会影响酸凝乳的最终pH值,可将该现象运用到酸凝乳生产中,用于提高生产效率、改善产品性能[40]。采用75 ℃/15 min的条件处理原料乳,将pH值控制在7.0左右,既可以减少能耗,也可利用此反应提高酸凝乳的特性[40,43]。
4.4 热处理导致的α-La与血清白蛋白的结合
血清白蛋白(serum albumin,SA)是形成凝胶的一个重要蛋白,变性温度为62 ℃。在80 ℃时,变性速率比β-Lg快50~100 倍[43]。SA在Cys34处有一个—SH,分子内有17 个二硫键。SA受热变性可分为两个阶段:第一阶段是在高于变性温度时会可逆地形成熔融态SA,第二阶段是缓慢地向另一个熔融状态不可逆转变,此时的熔融状态具有更高的表面疏水性,分子间的疏水作用力更强,分子内部的—SH暴露从而具有反应活性[44]。SA与α-La的反应结合机制和α-La与β-Lg的反应机制较为相似。Havea等[45]研究了牛血清白蛋白(bovine serum albumin,BSA)与α-La可能的聚合途径:具有反应活性的BSA之间相互作用,通过—SH/S—S交换反应形成二聚体、三聚体;熔融态的α-La和具有反应活性的BSA可以通过疏水键不可逆地缔合形成络合物;进一步加热则发生—SH/S—S键交换,形成α-La/BSA的聚合物,从而使得α-La分子(Cys6或Cys120)获得游离—SH基团使反应继续进行。由于SA含有比β-Lg更多的二硫键,热处理乳中α-La/BSA聚合物的数量可能多于α-La/β-Lg[46]。HTST处理乳中生成的α-La/BSA聚合物的凝胶性强于BSA单独加热后的凝胶性,因此,α-La/BSA聚合物可作为食品添加剂改善产品的凝胶结构。
4.5 热处理导致的α-La与IgG的结合
牛乳中α-La的氨基酸残基与人乳α-La具有74%的同源性,6%的残基具有相似的化学性质,但α-La仍是乳中主要的过敏原之一[47-49]。α-La具有3 个与免疫球蛋白G(immunoglobulin G,IgG)结合的位点,并且能被半数以上的过敏人群识别。加热可以诱导蛋白结构的变化,防止过敏反应的发生,从而降低乳的致敏性。α-La结合IgG抗原表位的关键氨基酸序列为6~20、21~35、36~50和86~100,关键氨基酸为Phe9、Leu15、Pro24、Try26和His32[50]。α-La与IgG的结合能力可反映热处理后变性过敏原蛋白的抗原性变化。在60~80 ℃的热处理条件下,α-La与IgG的结合能力呈上升趋势,但在60~75 ℃范围内,结合能力都小于未经热处理的对照组,60 ℃时的下降幅度最大,与对照组相比下降了0.11%,与IgG的结合能力最低。需要说明的是,温度达到75 ℃时,α-La的抗原性升高到与对照组α-La相同的水平。温度达到80 ℃时,这种结合能力升高到最大值,抗原性较对照组α-La增加了5%[49]。在温度上升到90 ℃的过程中,抗原性随着温度的升高继续增加,并在90 ℃时达到最大。温度继续上升,抗原性则呈显著下降趋势;当温度上升至120 ℃,加热时间为20 min时,抗原性下降到低于对照组α-La的水平[51]。因此,将热加工温度控制在60~75 ℃(HTST)或120 ℃以上(UP、UHT),在此条件下α-La与IgG的结合水平低于未经热处理的原料乳,从而可控制α-La的抗原性,有效降低乳制品的致敏性。
5 结 语
不同程度的热处理导致α-La的变性程度不同,与其他蛋白成分的相互反应也处在不同的阶段。可通过控制热处理条件达到不同的需求,例如降低乳的致敏性、改善酸凝乳的凝胶特性。对乳进行热处理时,发生的最重要的反应是α-La/β-Lg聚集体与κ-CN的可溶性聚合物的生成,α-La/β-Lg聚集体与κ-CN的可溶性聚合物的生成有利于缩短生产发酵乳的时间,改善酸乳凝胶结构,对生产优质凝固型酸奶具有重要的实际意义和借鉴价值[52-54]。HTST是原料乳生产最常用的杀菌方式,可在保留营养价值的同时发生一些有利反应,形成的α-La/β-Lg聚集体可用于生产低黏度、低浊度和高溶解性的蛋白饮料,α-La/BSA聚合物具有良好的凝胶结构。α-乳白蛋白与IgG的结合能力在HTST、UP和UHT处理条件下强于原料乳,可以用于降低乳品的致敏性。
α-La不仅在乳的热加工中具有重要的地位,并且可以单独运用于食品工业中,具有安全、天然、营养的特点,能满足消费者对食品安全和营养的需求。α-La具有良好的乳化性,可添加到β-胡萝卜素乳液中增强其溶解度,亦能提高其营养价值[55]。在婴幼儿配方乳粉中添加α-La使其含量接近母乳水平,以完善婴幼儿乳粉的营养结构[56]。在实际生产中,可以根据需要选择不同的热处理方式,把握好安全与营养的平衡[57],利用一些有益反应提高产品质量和生产效益。随着科学技术和加工工艺的不断发展,相信α-La在食品领域中会有更多的应用[58]。因此深入开展热处理对α-La及与其他乳蛋白相互作用的研究具有重要意义。

