天然非蛋白氨基酸的生物活性机制研究进展
许 凯,毕晶晶*,张继昊
(1.河南师范大学生命科学学院,细胞分化调控省部共建国家重点实验室培育基地,河南 新乡 453007;2.河南师范大学化学化工学院,河南省有机功能分子与药物创新重点实验室,精细化学品绿色制造河南省协同创新中心,河南 新乡 453007)
蛋白氨基酸包括在蛋白质翻译过程中由特定密码子编码的22 种基本氨基酸(包括硒代半胱氨酸和吡咯赖氨酸),以及蛋白质翻译后基本氨基酸残基修饰和交联产生的氨基酸[1-2]。非蛋白氨基酸是指通常不存于蛋白质中、缺乏专一性tRNA和密码子的氨基酸;或者是基本氨基酸通过合成后的修饰、但也不存在于蛋白质中的基本氨基酸类似物或取代衍生物[3]。目前,在天然产物中分离得到的氨基酸类化合物大概有700多种,除了少数的蛋白氨基酸外,绝大多数为非蛋白氨基酸[4]。这些天然非蛋白氨基酸主要存在于植物和微生物中,而在动物中较少发现[5]。在动植物体内广泛存在的一些非蛋白氨基酸是它们的初级代谢中间产物或终产物,如尿素循环中的鸟氨酸和瓜氨酸,血清素的前体5-羟基色氨酸等。而绝大多数存在于植物和微生物体内的非蛋白氨基酸为它们的次级代谢产物[6]。这些非蛋白氨基酸在生物体内起多种多样的作用。如在许多植物和低等海洋生物体内,一些非蛋白氨基酸起到储氮或储能的作用[7]。而植物和微生物体内的一些非蛋白氨基酸可作为其化学防御物质,对竞争者和捕食者起到毒害作用[8]。
已发现的天然非蛋白氨基酸数量庞大,但对其中的大多数尚未进行深入研究,对于它们的活性、作用机制和潜在应用知之甚少[9]。本文综述了一些迄今为止对人类影响较大、研究较为深入的天然非蛋白氨基酸的来源、已知生物活性及其作用机制,以探讨这类天然化合物对人类的启示和潜在应用价值。
1 具有生物活性的天然非蛋白氨基酸及其作用机制
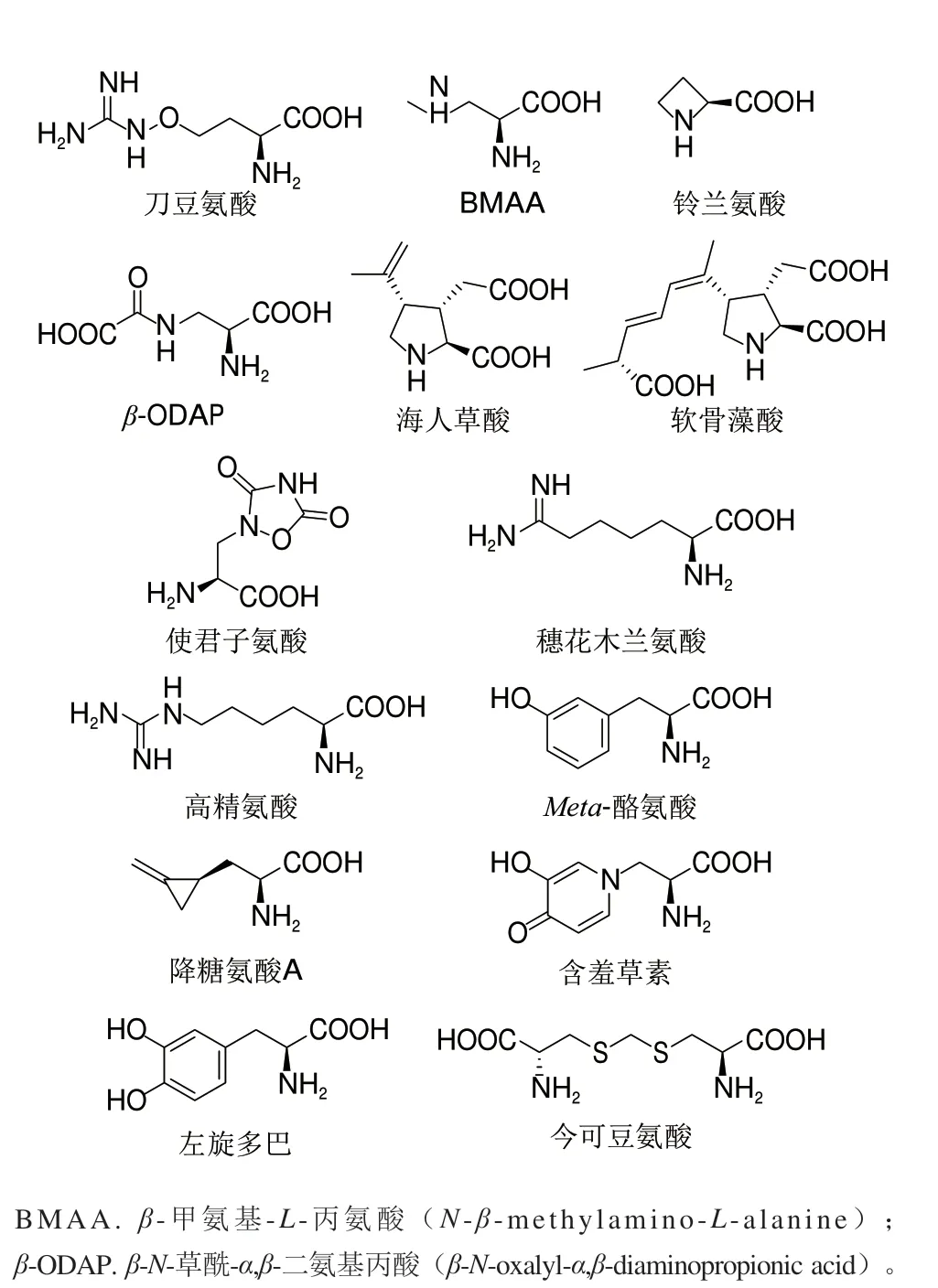
图 1 具有生物活性的天然非蛋白氨基酸Fig. 1 Bioactive natural non-protein amino acids
非蛋白氨基酸的生物活性最早在20世纪60年代初开始研究,研究者发现许多非蛋白氨基酸对微生物的生长具有抑制作用。而其活性主要是源于其与20 种常见的基本蛋白氨基酸在结构与所带电荷的相似性[10]。这种相似性使得它们能够作为蛋白氨基酸的类似物在相关代谢过程中替换蛋白氨基酸,如错误掺入到蛋白质合成,或作为激活剂、抑制剂与相关受体结合,亦或作为底物类似物与酶结合。天然非蛋白氨基酸除作为20 种常见基本蛋白氨基酸的类似物发挥其生物活性外,还有许多其他的作用机制。例如,有些非蛋白氨基酸可作为金属螯合剂抑制一些依赖金属离子的酶,还有些非蛋白氨基酸的代谢产物具有生物活性。图1为部分天然非蛋白氨基酸结构式。
1.1 错误掺入蛋白质导致蛋白质构象改变的天然非蛋白氨基酸
天然非蛋白氨基酸的第一种活性机制是它们能够在蛋白质合成中替换蛋白氨基酸,导致异常蛋白或非天然蛋白质的形成[9]。这些非蛋白氨基酸在大小、形状和电荷分布上类似于某种蛋白氨基酸,使其可以逃脱相应的氨酰tRNA合成酶的“门禁”作用,被酯化结合到tRNA上,通过蛋白质翻译过程掺入到新合成的蛋白中[11]。这些非蛋白氨基酸被称为蛋白氨基酸类似物[12]。通常蛋白氨基酸比其类似物对相应同源氨酰tRNA合成酶具有更高的亲和力,在一定浓度下非蛋白氨基酸的浓度与其掺入蛋白质的水平之间存在线性相关性。非蛋白氨基酸不会靶向特定蛋白质,但某些蛋白质可能更易受到肽链中错误掺入的氨基酸影响。如结构简单或无序的蛋白质可能更容易发生功能变化或水溶性降低[13]。而对于这些非蛋白氨基酸的生产者,其可通过进化出能够识别亲本蛋白氨基酸和其类似物的氨酰tRNA合成酶防止自毒效应[9]。
刀豆氨酸主要存在于一些豆科植物的种子与幼苗中,如洋刀豆(Canavalia ensiformis)和紫花苜宿(Medicago sativa)[4]。刀豆氨酸是精氨酸的类似物,具有多种抗代谢活性。对于产生刀豆氨酸的植物,刀豆氨酸可作为其化学防御物质抵御某些生物对其的侵害[14]。与L-精氨酸相比较,L-刀豆氨酸δ位亚甲基上的碳原子被替换为氧原子,这使其胍基的pKa发生了很大的改变(刀豆氨酸pKa为7.01,精氨酸pKa为12.48)[15]。L-刀豆氨酸可代替L-精氨酸掺入到蛋白中形成刀豆氨酸蛋白,而两种氨基酸R基带电荷的差异会导致蛋白的结构和功能改变,进而抑制细胞生长并导致细胞凋亡[16]。L-刀豆氨酸错误掺入蛋白还可能改变蛋白的免疫原性,因而可能导致一些自身免疫疾病的发生,如全身性红斑狼疮[17]。
BMAA最早是在关岛查莫罗人食用的一种由苏铁(Cycas micronesicaHill)种子制成的面粉中发现的[18]。BMAA可由多个种属的蓝藻合成,有些产生BMAA的蓝藻与某些植物的根形成共生关系,导致BMAA在植物体内蓄积,并可通过食物链在动物体内富集。多项研究指出BMAA与关岛和马里亚纳群岛的居民中多发的一种神经退行性疾病肌萎缩侧索硬化/帕金森综合征相关[19]。Glover等[20]采用体外实验证实BMAA在蛋白翻译过程中可以替代丝氨酸错误掺入到形成的蛋白质中,且使用人源DNA模板比使用大肠杆菌DNA模板的错误掺入率更高。错误掺入BMAA会导致合成蛋白的错误折叠[21]。在神经细胞中,一些错误折叠的蛋白更难以被降解,而错误折叠蛋白的聚集会导致肌萎缩侧索硬化症和阿尔茨海默病等神经退行性疾病的发生[13]。此外,最新的研究表明游离的BMAA可通过抑制某些酶干扰蛋白折叠,并可通过非共价结合蛋白影响蛋白的构象和功能[22]。可见,BMAA可能是导致一些神经退行性疾病的重要因素。
铃兰氨酸最早是从铃兰植物(Convallaria majalis)中分离得到的一种亚氨酸[23]。L-铃兰氨酸是脯氨酸的类似物,脯氨酸带有氮杂环戊烷结构,而铃兰氨酸则带有氮杂环丁烷结构。在不合成L-铃兰氨酸的生物体内,L-铃兰氨酸可与脯氨酸竞争错误掺入到蛋白中[24]。天然蛋白质中脯氨酸残基常常在脯氨酰顺反异构酶的作用下由反式转变为顺式,对于蛋白质的构象起到非常关键的作用[25]。而L-铃兰氨酸代替L-脯氨酸错误掺入蛋白质中会导致脯氨酰顺反异构酶无法识别,从而导致正确的蛋白构象无法形成,影响蛋白的结构、功能和免疫原性[26]。L-铃兰氨酸在甜菜(Beta vulgarisL.)中也有较高含量。甜菜生产蔗糖的副产品常被用作饲料,其中含有的L-铃兰氨酸会污染乳制品及肉制品,通过食物链影响人类健康[27]。一些富含脯氨酸的蛋白易受L-铃兰氨酸的影响而改变其功能和免疫原性,进而引发与之相关的一些疾病。多项研究将L-铃兰氨酸的摄入与多发性硬化的发生相关联,指出L-铃兰氨酸的摄入可能会导致髓鞘碱性蛋白上带有的脯氨酸抗原决定基结构改变,并最终成为一种抗原[24],随后免疫机制被触发并逐渐破坏髓鞘[26]。Ataxin-2是一种富含脯氨酸蛋白,其作为锌指蛋白的辅助调节因子影响转录活性[28]。摄入L-铃兰氨酸引发的Ataxin-2功能异常,可导致大量蛋白质的异常拼接而引起多种疾病,如自闭症、肌萎缩性脊髓侧索硬化症、II型糖尿病等[5]。
1.2 兴奋性天然非蛋白氨基酸
L-谷氨酸是中枢神经系统中的主要兴奋性神经递质,可与谷氨酸受体结合介导哺乳动物中枢神经系统中的突触兴奋,进而介导神经信号转导。谷氨酸受体分为两类:一类为离子型谷氨酸受体(iGluRs),这类受体与神经细胞膜上的Na+、K+和Ca2+离子通道偶联,形成受体通道复合物,介导快信号传递;另一类为代谢型谷氨酸受体(mGluRs),它们与膜内G蛋白偶联,并通过第二信使介导信号转导,具有较缓慢但更持久的功能,例如与学习和记忆功能相关[29]。L-谷氨酸是谷氨酸受体的主要激动剂,许多非蛋白氨基酸在结构上与谷氨酸相似,可作用于谷氨酸受体产生类似谷氨酸的神经信号转导作用,这类氨基酸被称作兴奋性氨基酸。许多已知的兴奋性氨基酸源于天然产物中[30]。
β-ODAP是从家山黧豆(Lathyrus sativusL.)中分离到的一种非蛋白氨基酸,其对高等动物具有强烈的神经毒性[31]。食用家山黧豆可导致山黧豆中毒,引起人类不可逆的下肢瘫痪[32]。家山黧豆是最为广泛栽培的山黧豆属植物,是世界上较贫困地区如非洲和亚洲的一些干旱和半干旱气候地区食物和饲料的宝贵来源[33]。作为固氮豆类,该植物无需施加氮肥即可在贫瘠的土壤上茁壮成长,且抗旱能力很强,在其他作物绝收的大灾之年依然能够有较好的收成。在食物严重匮乏时,家山黧豆常被作为粮食被人类食用,因此山黧豆中毒常爆发于饥荒时期[34]。研究发现,β-ODAP是引起山黧豆中毒的主要成分之一。β-ODAP是一种谷氨酸类似物,在神经细胞中可作为谷氨酸受体的激动剂,作用于α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionicacid receptor,AMPAR)影响细胞内Ca2+流动,破坏细胞内稳态,引起神经毒性[32]。Tan Ruiyue等[34]在人神经胶质瘤细胞的体外体系中发现β-ODAP可通过细胞外基质-受体相互作用通路引起β1整合素过表达和黏着斑激酶磷酸化,提出了相对完整的黧豆中毒相关信号通路。在溶液中部分β-ODAP可发生结构重排,转化为其异构体α-ODAP,得到两种同分异构体的混合物。α-ODAP无谷氨酸受体的激动剂活性,毒性较低。水煮等烹饪方式可促使家山黧豆中的β-ODAP转化为α-ODAP,降低其毒性[35]。
海人草酸是一种兴奋性神经毒素,最初在海人草(Digenea simplex)中分离出[36]。这种海藻在日本传统医学中被用作驱蛔虫的草药。此后,海人草酸在世界各地多种海洋藻类中发现[37]。海人草酸具有双羧基结构,是谷氨酸的类似物,可作为一系列谷氨酸受体的激动剂。海人草酸可作为神经生理学研究的工具药物,在神经医学研究中具有重要地位[38]。
软骨藻酸最早从树枝软骨藻(Chondria armata)中分离出[39]。该藻与海人草类似,在日本传统医学中同样被用作驱肠虫剂。此后发现其在拟菱形藻属(Pseudonitzschia)和菱形藻属(Nitzschia)的某些藻类中也可产生[40]。软骨藻酸与海人草酸的结构与作用方式类似,是一种比海人草酸更为强效的兴奋性氨基酸。它可通过食物链在鱼类贝类等生物体内富集,并对鸟类、哺乳类等海洋动物以及人类造成威胁。1987年,加拿大东部爱德华王子岛爆发因食用贻贝引起的记忆缺失性贝类中毒(amnesic shellfish poisoning,ASP),调查发现毒素来源于贻贝摄入的尖刺拟菱形藻(Pseudonitzschiapungens)。软骨藻酸引起的ASP和β-ODAP引起的山黧豆中毒是神经元过度兴奋的常见模式,均可导致永久性的神经系统功能丧失[30]。
使君子是我国传统药材,具有驱杀体内寄生虫以及健脾胃等功效。现代研究发现其种子中含有的使君子氨酸是其发挥驱肠虫作用的活性成分[41]。使君子氨酸是一种兴奋性氨基酸,能作用于多种兴奋性氨基酸受体,如AMPA受体、海人草酸受体以及I型mGluRs,常作为神经生理学研究的工具药物[42]。
1.3 干扰代谢通路的天然非蛋白氨基酸
除上文掺入蛋白形成异常蛋白外,在动植物体内L-刀豆氨酸作为精氨酸的类似物还可抑制特定的酶而干扰多胺代谢[43]。同时,L-刀豆氨酸可作为诱导型一氧化氮合酶的选择性抑制剂,干扰NO的合成。并可造成氧化应激产生活性氧和活性氮,因而可被用作研究精氨酸依赖型活性氮形成的工具药物[44]。在精氨酸酶的催化下,刀豆氨酸可分解为副刀豆氨酸和尿素。副刀豆氨酸可抑制依赖VB6的酶,因此也具有毒性。此外,刀豆氨酸还可能是一些植物中氨基氰的来源[45]。L-刀豆氨酸高效的抗代谢作用使其能够作为潜在的抗肿瘤药物,在体内、体外实验中对多种恶性肿瘤均有抑制作用,如乳腺癌、白血病、宫颈癌和肝癌等[4]。
穗花木兰氨酸出现在一些木蓝属(Indigofera)植物中[46]。与L-刀豆氨酸类似,穗花木兰氨酸也是L-精氨酸的类似物。在结构上与精氨酸的不同之处在于其C6位置上是一个亚甲基而不是氨基。穗花木兰氨酸可作为底物类似物抑制精氨酸酶与NO和一氧化氮合酶的活性[47]。此外,穗花木兰氨酸可抑制精氨酰-tRNA的形成,阻碍精氨酸掺入蛋白质,但其本身并不掺入其中[48]。这种非蛋白氨基酸在反刍动物及小鼠、大鼠和兔子等动物中都具有致畸性和肝毒性。然而用穗花木兰的种子饲喂鸟类未见其发生肝脏损伤,因此有人提出排尿酸的动物比排尿素的动物对穗花木兰氨酸的耐受性更高[48]。哺乳动物对穗花木兰氨酸的敏感性也会存在很大差异,如马对其耐受性比狗要高出许多。常有狗因食用含有穗花木兰氨酸的马肉或骆驼肉而死于严重肝损伤的案例发生,而提供肉的马和骆驼生前均未发现明显的肝损伤[49]。
另一种天然精氨酸类似物高精氨酸最先从山黧豆属植物红山黧豆(Lathyrus ciceraL.)和家山黧豆(Lathyrus sativusL.)中分离得到[50]。然而在此之前,Stevens等[51]就已经通过化学合成得到了高精氨酸并检测其生物活性,结果表明其是大鼠精氨酸酶的底物。高精氨酸与精氨酸不同的是其主链上多了一个亚甲基。高精氨酸可抑制细菌生长,但未见其掺入到蛋白合成[10]。在高等动物中,高精氨酸是在肾脏中合成的内源性非蛋白氨基酸[9]。高精氨酸可在肝脏精氨酸酶的作用下水解为赖氨酸和尿素,因此食物中的高精氨酸可作为赖氨酸的来源。然而据报道,用高精氨酸替代食物中的赖氨酸可减少动物的摄食行为,并降低其大脑中鸟氨酸、赖氨酸和精氨酸的浓度[52]。高精氨酸影响哺乳动物体内NO的合成,它可以与精氨酸竞争结合阳离子氨基酸转运体,从而抑制精氨酸的细胞摄入并增加精氨酸的细胞流出,通过剥夺一氧化氮合酶的底物来抑制NO的合成。此外,高精氨酸本身可作为一氧化氮合酶的底物,分解产生NO和L-高瓜氨酸,但与一氧化氮合酶的亲和力较低[53]。另外,高精氨酸也是血液中骨骼碱性磷酸酶的有效抑制剂,可能与骨骼型山黧豆中毒的发生相关[54]。
meta-酪氨酸(meta-tyrosine,m-Tyr)在细叶羊茅(Festuca rubraL. ssp.commutata)和大戟属植物(EuphorbiaL.)中被分离出[55]。m-Tyr在结构上与苯丙氨酸类似,是一种有效的生物除草剂,实验表明其可作为化感物质对超过50 种杂草和作物的幼苗具有生长抑制作用[56]。实验表明,在哺乳动物细胞以及细菌体系中,m-Tyr可在苯丙氨酸-tRNA合成酶催化下替代苯丙氨酸错误掺入到蛋白质结构中,导致异常蛋白质的形成,致使细胞快速死亡[57]。在最近的一项研究中发现,用μmol/L级浓度的m-Tyr处理番茄(Solanum lycopersicumL.)等高等植物的幼苗可以提高其活性氧的水平,并影响活性氮的形成与积累[58]。这些研究表明,在高等植物中m-Tyr不仅是氧化应激的标志,而且本身可导致植物幼苗氧化应激的发生。动物组织中也可形成内源性的m-Tyr,其在哺乳动物骨骼肌和其他组织中的积累被认为是氧化应激的生物标志物[59]。
降糖氨酸A最初是从西非荔枝(Blighia sapida)未成熟的果实中分离出来的一种氨基酸[60]。这种植物原产于非洲,传入牙买加后其果实作为一种水果被当地人食用。降糖氨酸A在未成熟的西非荔枝果实中可达干质量的0.1%,成熟果实中由于日光的降解作用,降糖氨酸A的质量分数大幅降低[61]。食用未成熟的西非荔枝果实可引起牙买加呕吐症,中毒者的血糖水平会从正常值(80~100 mg/dL)急剧下降到10 mg/dL以下[62]。近年来,印度季节性爆发不明原因的急性中毒性脑病被证实与荔枝果中含有的降糖氨酸A及其类似物有关[63]。研究表明,降糖氨酸A的活性主要来源于其肝脏的代谢物亚甲基环丙基乙酸(methylenecyclopropylacetic acid,MCPA)。MCPA可阻断脂肪酸的β氧化,导致机体增加对葡萄糖作为能量来源的依赖,加速血糖的消耗。同时,由于糖异生途径被抑制,血糖水平无法回升[64]。此外,降糖氨酸A可以通过与亮氨酸竞争而错误掺入到蛋白质中导致蛋白的错误折叠,可致大鼠等动物胚胎畸形[65]。
1.4 具有金属螯合活性的天然非蛋白氨基酸
含羞草素最早从含羞草(Mimosa pudica)幼苗与根中分离出来,随后从银合欢(Leucaena glaucaB)的叶片和种子中也分离出来,高达其干质量的8%~10%[66]。摄入银合欢的叶片和种子可导致人和动物脱发、脱毛。Crounse等[67]发现,投喂银合欢种子或含羞草素可使小鼠毛发生长受到抑制,证实含羞草素是银合欢脱发作用的活性成分。含羞草素可作为二价金属离子螯合剂,抑制多种金属酶,如核糖核苷酸还原酶、碱性磷酸酶和多巴胺-羟化酶。此外,由于在结构上与左旋多巴、酪氨酸及苯丙氨酸等物质类似,含羞草素还可作为底物类似物抑制胱硫醚合酶、胱硫醚酶、天冬氨酸转氨酶、酪氨酸脱羧酶、酪氨酸酶及左旋多巴脱羧酶等[66]。此外,含羞草素也是苯丙氨酰-tRNA合成酶的底物,能够替代苯丙氨酸错误掺入蛋白。含羞草素对这些酶的抑制会引起动物和人的各种生理异常,包括不育、脱发和畸形等。含羞草素可诱导细胞G1/S期阻滞,抑制细胞周期,因而可作为细胞周期研究的工具化合物[68]。近年来的研究表明,含羞草素是治疗恶性胶质瘤的一个潜在化疗药物,且具有很好的抗炎作用,是阿司匹林潜在的替代药物;同时,作为一种丙基羟化酶抑制剂,其在再生牙科领域也有潜在的应用价值[69]。
L-DOPA在豆科植物中广泛存在,占藜豆(Mucuna pruriens)种子干质量的6%~9%[70]。由于含有较高含量的L-DOPA,藜豆对害虫耐受性很高,并且可以抑制杂草生长[71]。L-DOPA在结构上与L-酪氨酸类似,可以替代L-酪氨酸掺入蛋白合成[72]。在一项研究中,Ozawa等[73]采用无细胞蛋白质表达系统用L-DOPA替换L-酪氨酸,结果表明,当暴露于蛋白质外侧的L-酪氨酸残基被L-DOPA取代时,蛋白质保持其溶解度;然而,用L-DOPA替换蛋白质内部L-酪氨酸残基则导致蛋白质溶解度降低。这可能是由于L-DOPA分子上的邻苯二酚结构具有较强亲水性,导致蛋白质先前埋藏的疏水区域外翻,并导致蛋白错误折叠,溶解度下降[13]。除了能够在蛋白质合成中替换蛋白质氨基酸酪氨酸外,L-DOPA分子上的邻苯二酚结构可螯合二价金属[74]。贻贝的足丝蛋白中L-DOPA质量分数高达30%,赋予其强力的附着能力,这种强力黏合剂的主要机制是L-DOPA与岩石表面中的过渡金属结合[75]。Golisz等[76]发现,用L-DOPA处理拟南芥6 h后,与包括铜、三价铁和锌转运相关的超过10 个基因表达显著上调,证实了其金属螯合性质对植物的毒性。在动物中,L-DOPA是多巴胺、去甲肾上腺素和肾上腺素等神经递质的重要前体。L-DOPA是用于治疗帕金森综合征的主要药物,其药理是多巴胺脱羧酶将L-DOPA转化为多巴胺能神经元中的神经递质多巴胺[77]。但近年由于L-DOPA长期使用可能增加患者罹患诸多运动并发症的风险,如左旋多巴诱发的异动症,其长期临床应用受到限制[78]。
1.5 具有肾毒性的天然非蛋白氨基酸
今可豆氨酸最早从东南亚的金龟豆(Archidendron pauciflorum)中分离出来,后发现其在豆科植物含羞草亚科(Mimosaceae)以及金合欢属(Acacia)植物中广泛存在[79]。金龟豆的种子中含有约占其干质量1%~2%的今可豆氨酸,主要以游离的状态存在。其化学结构类似于胱氨酸,但在两个硫原子之间含有一个亚甲基。金龟豆在东南亚被当地人食用,人类摄入含有今可豆氨酸的种子后约2~12 h可导致金龟豆中毒,症状包括腹痛、恶心、呕吐、排尿困难和血尿。但在个体之间对其敏感性和症状的严重程度存在显著差异[80]。研究发现今可豆氨酸是一种强力的肾毒素,在酸性条件下其溶解度下降,形成针状结晶,导致肾小管和泌尿道的机械损伤[81]。除造成上述急性症状外,长期摄入今可豆氨酸也存在风险。Shukri等[82]进行了为期90 d的研究,结果显示长期摄入较低水平的今可豆氨酸可能导致大鼠心脏、肝脏、胰腺和肾脏受损。烘焙处理(180 ℃、6 min)可去除金龟豆中的今可豆氨酸,大幅降低其毒性[81]。
2 天然非蛋白氨基酸的应用价值
2.1 在农业与生态环境应用
一些植物产生的非蛋白氨基酸可作为化感物质对其产生者周边的竞争者产生抑制作用[83]。如前文所述细叶羊茅根系分泌物中含有的m-Tyr就是一种强效的化感物质[55]。m-Tyr在μmol/L级浓度下即可抑制大多数植物根茎的生长,可作为广谱的除草剂应用于农业生产和市政绿化工程。而豆科植物中广泛存在的L-DOPA也是高效的化感物质,对许多植物的半数抑制浓度仅25 mmol/L。研究表明其化感作用具有植物特异性,对十字花科、田基麻科、葫芦科植物的抑制作用较强,而对豆科和禾本科植物抑制能力相对较弱。这种特性可应用到农业生产,例如将一些产生L-DOPA的豆科植物与水稻和玉米间作,不但不会影响水稻与玉米的生长,还能通过固氮和L-DOPA的除草效果提高它们的产量[71]。除此之外,含羞草素、刀豆氨酸、铃兰氨酸、5-羟基色氨酸、γ-氨基丁酸等均为已知的氨基酸类化感物质。此外,一些研究表明,一些豆科植物根系分泌的非蛋白氨基酸类化感物质可能对植物与根瘤菌建立共生关系有至关重要的作用。
许多植物源的天然非蛋白氨基酸可作用于微生物和植食性的昆虫,起到抵御病虫害作用[9]。L-刀豆氨酸也是种强效的杀虫剂,即使在亚致死浓度下也可对多种害虫的幼虫有生长抑制作用[84]。而一些豆科农作物的种子中含有L-DOPA和5-羟基色氨酸,其往往对昆虫有毒害作用,却对人畜无害[6]。
2.2 在食品安全领域的应用
许多非蛋白氨基酸对人类是有危害的,其中不少存在于食物中[85]。食物中对人类健康有害的非蛋白氨基酸主要来源于两个方面:一是作物本身产生的,如洋刀豆以及苜蓿中的刀豆氨酸、家山黧豆中的β-ODAP、西非荔枝未成熟果实中的降糖氨酸A、金龟豆中的今可豆氨酸等;二是由其他物种产生,通过食物链在食物中积累的,如记忆缺失性贝素软骨藻酸与神经退行性疾病肌萎缩侧索硬化/帕金森综合征相关的BMAA、污染乳制品和肉类诱发多发性硬化的L-铃兰氨酸等。
控制含有害非蛋白氨基酸食物的摄入量、合理处理减少食物中的有害非蛋白氨基酸以及对食物中的有害非蛋白氨基酸进行监测均可以防止中毒的发生。例如,包括我国在内的许多国家限制了家山黧豆的种植,大范围的由β-ODAP引起的山黧豆中毒事件已经极少出现[86]。许多国家规定了贝类等海鲜中软骨藻酸含量的标准。此外,基因工程等方法也可用来培育新的作物品系,降低其中有害非蛋白氨基酸的含量[87]。
2.3 在营养和医药领域的应用
许多天然非蛋白氨基酸由于在人类体内可作为一些生理活性物质或必需氨基酸的前体而具有一定的营养和保健作用。如5-羟基色氨酸是神经递质血清素的前体,适量摄入可改善睡眠、影响食欲、性欲并带来愉悦感和幸福感[88]。L-高精氨酸在肝脏中代谢为L-赖氨酸,可作为这种必需氨基酸的来源。而茶叶中的L-茶氨酸不但影响茶叶的品质与口感,还有增强学习与认知能力以及提高免疫力的功效[89]。
在医药领域,一些具有生物活性的天然非蛋白氨基酸本身可作为药物。如L-DOPA是多巴胺的前体,已经作为上市药物用于治疗帕金森综合征[78]。刀豆氨酸和含羞草素等一些具有抗代谢活性的氨基酸是具有潜力的化疗药物。同时,种类繁多的天然非蛋白氨基酸给制药领域提供了大量的先导化合物,也给多肽类药物的研发提供了丰富的构件单元[90-91]。
此外,在临床上,一些内源的非蛋白氨基酸可作为某些疾病或健康状况的生物标志物。临床研究表明,血液中L-高精氨酸水平与血压的收缩压之间存在正相关关系,血液中低水平高精氨酸浓度被认为是心血管和肾脏疾病以及中风危险的标志物[92]。m-Tyr被发现在阿尔茨海默病、糖尿病、白内障和动脉粥样硬化等多种衰老相关疾病患者体内累积,被认为是氧化应激和人类衰老的生物标志物[59]。
3 结 语
天然非蛋白氨基酸来源丰富、数量庞大,至今人类对其中大多数化合物复杂的作用机制仍知之甚少。天然非蛋白氨基酸已知的活性机制主要是其作为蛋白氨基酸的类似物错误掺入到蛋白中,以及作为底物类似物抑制酶的活性和过度刺激神经受体,有些还具有金属螯合活性或者肾脏毒性。许多天然非蛋白氨基酸通过食物链对人类的健康造成威胁,亦有一些具有潜在的营养和保健功能。许多天然来源非蛋白氨基酸具有良好的应用前景,如作为安全的除草剂、杀虫剂应用于农业、牧业等产业;开发为药物或作为先导化合物以及多肽类药物的构件单元,在医药领域发挥重要作用;作为内源性的生物标记物应用于疾病诊断等。天然非蛋白氨基酸作用机制有待更加深入的研究,以阐明它们与人类健康的关系,拓展这类化合物的应用。

