邻苯二甲酸二丁酯的光敏毒性作用及机制
李志军,包海鹰*
(吉林农业大学药用菌物资源及开发利用重点研究室,食药用菌教育部工程研究中心,吉林 长春 130118)
邻苯二甲酸酯(phthalate esters,PAEs)是邻苯二甲酸的酯化衍生物。作为塑化剂,PAEs被广泛应用于塑料、涂料、油墨的生产中,同时也可添加于驱虫剂、发胶喷雾剂、指甲油和火箭燃料中,但PAEs对人类健康具有严重危害[1]。PAEs是全球最普遍的环境激素类污染物,在食品、饮用水、人体体液中被不同程度检出[2]。美国国家环保局将PAEs列为环境优先污染物,同时其也被人们称为“第二个全球性多氯联苯污染物”。PAEs经口进入人体后主要以水解产生单酯的形式被吸收,单酯被认为是产生毒性的主要化合物。哺乳动物肠黏膜细胞中的肠酯酶及小肠中的细胞外膜可将PAEs水解成单酯[3],如邻苯二甲酸二丁酯(dibutyl phthalate,DBP)进入体内后可水解为邻苯二甲酸单丁酯(mono-n-butylphthalate,MBP)。PAEs被吸收后主要以蛋白结合体的形式通过血液分布于全身各器官[4]。PAEs类化合物感染大鼠后,在大鼠肝脏、肾脏、心脏、肺、睾丸等各脏器中均可检出其原型及代谢产物,甚至还可以通过血脑屏障在脑组织中检出[5]。研究表明,MBP生物活性更高、毒性更强,其不仅对生殖、发育、体内激素、核受体、炎症和肥胖等方面都能产生影响,甚至还可以致死、致畸、致突变[6];因此MBP成为PAEs毒性研究的新热点[7-11]。MBP灌胃染毒大鼠后,肝脏和肾脏中活性氧(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)含量较高,谷胱甘肽(glutathione,GSH)含量较低。MBP的暴露与大鼠肝脏和肾脏组织的氧化损伤存在直接联系[12-13]。据Cao Yuchun[14]和白璐[15]等报道,在食用胶质菌中含有天然的PAEs类物质并具有光敏活性,但目前尚鲜见对DBP导致的光敏体内药代动力学及机制的研究。本研究以DBP为对象,从自由基损伤和肝脏、肾脏毒性角度探讨DBP的光敏毒性、致毒机制和体内代谢过程,以期为全面评价PAEs对人体健康的影响提供更丰富的信息,为全面了解PAEs毒性提供依据,为安全性评价和毒性机制的研究提供参考资料。
1 材料与方法
1.1 动物、材料与试剂
雄性Wistar大鼠(体质量200~220 g)购自吉林大学标准试验动物中心,生产许可证号:SCXK(吉)2016-0003。
DBP标准品、MBP标准品(纯度≥99.0%) 美国Sigma公司;甲基叔丁基醚(纯度≥99.0%) 国药集团化学试剂有限公司;冰醋酸、三氯乙酸、氯仿(均为分析纯)、甲醇(色谱纯) 美国Tedia公司;其他试剂均为国产分析纯。
1.2 仪器与设备
2695型高效液相色谱仪 美国Waters公司;1K15高速离心机 美国Sigma公司;MVS.1漩涡混合器 北京北德科学器材有限公司;KQ-250DE型数控超声波清洗器昆山市超声仪器有限公司;ME204E型万分之一天平梅特勒-托利多(常州)称重设备系统有限公司;电子轰击质谱仪 美国Thermo Fisher公司;电喷雾离子源浙江好创生物技术有限公司;RM2126RT切片机德国Leica公司;BX51光学显微镜(附带DP75数码相机) 日本Olympus公司。
1.3 方法
1.3.1 DBP和MBP质量浓度的测定
色谱柱:C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相A:甲醇,流动相B:体积分数0.1%甲酸-水溶液。梯度条件:0~5 min,80%~95% A;5~9 min,95%~100% A;9~10 min,100% A;10~13 min,100%~80% A;13~15 min,80% A。流速:0.25 mL/min;检测波长:254 nm;柱温:25 ℃;进样量:10 μL。
1.3.2 DBP体外实验
对6 只健康Wistar雄性大鼠眼眶取血10 mL,置于肝素化的离心管中,3 000×g离心15 min,吸取血清4 mL作为空白。分别取40 mg DBP溶于2 mL生理盐水和2 mL大鼠血清中,避光30 ℃放置12 h(避光组);分别取40 mg DBP溶于2 mL生理盐水和2 mL大鼠血清中,置于日光下12 h(日光组)。3 000×g离心15 min,取血清0.2 mL,添加0.6 mL甲醇,漩涡振荡1 min,离心,上清液70 ℃下烘干,再用0.2 mL甲醇超声溶解,离心,微孔滤膜过滤。取上清液10 μL,按照1.3.1节方法测定DBP和MBP质量浓度。
1.3.3 DBP体内实验
1.3.3.1 DBP血药浓度的测定
对大鼠一次性给予2 000 mg/kgmbDBP灌胃染毒。对照组以等体积玉米油进行灌胃。分别设置避光组和日光组,避光组置于暗室中,调节暗室内温度与室外一致,日光组置于室外日光下,每组6 只大鼠。大鼠灌胃后分别于5、15、30、45 min和1、2、3、4、5、8、12、24、48 h眼眶取血0.8 mL,置于肝素化的离心管中,3 000×g离心15 min,取血清0.2 mL,添加0.6 mL甲醇,漩涡振荡1 min,离心,上清液70 ℃下烘干,再用0.2 mL甲醇超声溶解,离心,微孔滤膜过滤。取上清液10 μL按照1.3.1节方法测定DBP和MBP质量浓度。
1.3.3.2 MBP组织分布的测定
按1.3.3.1节方法对大鼠灌胃进行200 mg/kgmbMBP染毒。溶剂对照组以等体积玉米油进行灌胃。日光组和避光组分别设置为5、15、30、45 min和1、2 h组,每组6 只大鼠。各组大鼠经灌胃染毒后观察并记录体征变化。染毒结束后处死大鼠,分取肝脏、心脏、肺、肾脏和脾脏。脏器用生理盐水冲洗表面血迹,滤纸吸干,称质量,磨碎。用20 mL甲醇超声提取,取上清液1 mL,烘干,再用0.2 mL甲醇超声提取,离心,微孔滤膜过滤。取上清液10 μL按照1.3.1节方法测定MBP质量浓度。
1.3.3.3 脏器损伤相关指标的测定
按1.3.3.2节方法对大鼠进行灌胃染毒,日光组和避光组分别设置为5、15、30、45 min和1、2 h组,每组6 只大鼠。对大鼠进行眼眶取血,以灌胃染毒前采血样品为空白对照,离心10 min后吸出上层血浆,分别检测血浆中MDA、GSH、ROS含量和超氧化物歧化酶(superoxide dismutase,SOD)活力。随后取大鼠的部分肝脏和肾脏组织,先用预冷的磷酸盐缓冲液漂洗,然后称取适量组织,加入磷酸盐缓冲液(pH 7.5),制成质量分数为10%的匀浆液,低温离心后取上清液,参考文献[13]测定ROS、GSH、MDA含量和SOD活力。
1.3.3.4 组织病理学变化观察
按1.3.3.2节方法对大鼠进行灌胃染毒,取大鼠部分肝脏和一侧的肾脏,用体积分数10%甲醛溶液固定,脱水,透明,浸蜡,包埋,切片,苏木精-伊红(hematoxylin eosin,HE)染色,在光学显微镜下观察组织的病理学变化。
1.3.3.5 代谢样品的采集
取健康Wistar雄性大鼠12 只,随机分为避光组和日光组,每组各6 只。分置于代谢笼中,给药前禁食,实验期间自由进食与饮水。以2 000 mg/kgmbDBP给大鼠灌胃染毒。分别收集避光组与日光组给药前(空白)及给药后0~4、4~8、8~12、12~24 h各时间段的尿样和粪样,记录尿样体积,置于-80 ℃保存待测。
1.4 数据统计与分析
所有实验均重复3 次,结果以平均值±标准差表示。采用SPSS 20.0软件对数据进行单因素方差分析和简单相关性分析。用SIMCA-P 11.5软件对数据进行回归分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 DBP体外实验分析结果

图 1 MBP和DBP的液相色谱图Fig. 1 Liquid chromatograms of MBP and DBP
图1结果表明,DBP与血清混合后,在避光和日光下放置12 h均有MBP生成。但DBP与生理盐水混合后,在避光和日光下放置12 h均无MBP的生成。在空白血清中没有检测到MBP和DBP。对MBP进行分离,其电子轰击质谱图如图2所示。

图 2 MBP的电子轰击质谱图Fig. 2 Electron impact mass spectrum of MBP
2.2 DBP体内实验分析结果

图 3 DBP和MBP在大鼠体内的质量浓度变化Fig. 3 Changes in blood concentrations of DBP and MBP in rats
对大鼠单独灌胃1/10半数致死量的DBP后,DBP在大鼠体内的质量浓度变化见图3。随着时间的延长,DBP在大鼠血液中的质量浓度不断增加,在15 min左右避光组与日光组出现最大值,避光组为0.063 μg/mL,日光组为0.026 μg/mL;之后DBP质量浓度均下降,到3 h左右避光组出现第2个峰值(0.017 μg/mL);同时,根据高效液相色谱分析结果,从大鼠血液中还检测到MBP。日光组大鼠在2 h左右全部死亡,其血液中的MBP质量浓度高于避光组大鼠,在2 h时达到0.133 μg/mL。避光组大鼠血液中的MBP质量浓度在1 h时出现最大值(0.054 μg/mL),之后趋于平稳,12 h后开始下降,24 h左右MBP质量浓度降到0.001 μg/mL。
2.2.2 MBP在大鼠体内的分布
大鼠灌胃DBP并在日光下照射2 h左右后出现急性中毒死亡,因此选择将组织分布实验时间设计在0~2 h。DBP灌胃大鼠后主要以水解产生MBP的形式被吸收,因此以MBP作为研究对象。图4结果表明,MBP灌胃大鼠后,避光条件与日光条件下,肝脏与肾脏中MBP质量浓度均高于脾、肺和心脏。肝脏和肾脏在避光条件与日光条件下MBP分布表现出较大差异:在避光条件下,肝脏中MBP质量浓度在45 min左右达到最大值(0.030 μg/mL),然后趋于平稳;肾脏中MBP质量浓度在45 min左右达到最大值(0.254 μg/mL),之后趋于平稳;日光组肝脏与肾脏中MBP质量浓度均在30 min左右达到最大值,肝脏中为0.048 μg/mL,肾脏中为0.043 μg/mL,之后MBP质量浓度先下降后趋于平稳。
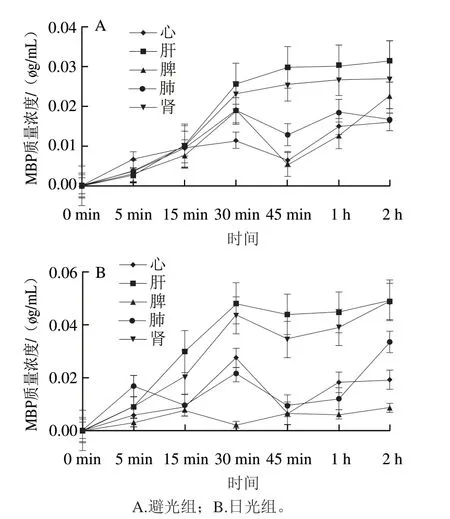
图 4 MBP在大鼠体内的分布Fig. 4 Distribution of MBP in rats
2.2.3 脏器损伤相关指标的测定

表 1 MBP对大鼠肝脏中ROS、MDA、GSH含量和SOD活力的影响Table 1 Effect of DBP on ROS, MDA, GSH and SOD levels in rat liver
由表1、2可见,与空白对照组相比,避光组和日光组大鼠肝脏和肾脏中的ROS和MDA含量均升高,但灌胃30 min后日光组ROS含量明显高于避光组。避光组和日光组大鼠肝脏和肾脏中GSH含量和SOD活力均降低,但灌胃15 min后日光组明显低于避光组。

表 2 MBP对大鼠肾脏中ROS、MDA、GSH含量和SOD活力的影响Table 2 Effect of DBP on ROS, MDA, GSH and SOD levels in rat kidney
2.2.4 大鼠肝脏组织切片观察结果

图 5 大鼠肝脏组织HE染色结果(×100)Fig. 5 Hematoxylin eosin staining of liver tissue(× 100)
以200 mg/kgmbMBP灌胃后,在显微镜下观察经HE染色的大鼠肝脏组织细胞时发现,肝细胞的损伤程度与光照时间存在明显的时间-效应关系,大鼠肝细胞在日光下2 h损伤最明显。由图5可看出,避光组灌胃MBP后5 min~2 h内,肝脏细胞均以中央静脉为中心向外呈辐射状排列,肝窦状隙规则分布且细胞排列较为密实,肝脏细胞损伤不明显(图5A~D)。日光组在灌胃MBP后30 min左右肝细胞局部伴随轻微炎症细胞浸润、细胞核轻微固缩、局部胞浆空亮和局部细胞肿大等症状;随着时间的延长,在1 h左右出现部分肝细胞水肿、细胞核固缩、破裂、水解症状;2 h左右肝细胞出现胞浆空亮、核消失、空泡样变、脂肪滴增大融合、局部细胞严重坏死症状,说明肝细胞存在严重的氧化损伤(图5E~H)。因此,在日光下MBP对大鼠肝脏的损伤程度高于避光条件。
2.2.5 大鼠肾脏组织切片观察结果
丹皮酚对强直性脊柱炎模型小鼠Wnt和BMP/Smad信号转导通路的影响 ………………………………… 吴 琪等(11):1500

图 6 大鼠肾脏组织HE染色结果(×100)Fig. 6 Hematoxylin eosin staining of kidney tissue(× 100)
显微镜下观察大鼠肾脏组织切片时发现,与肝脏组织细胞相比,日光组大鼠肾脏组织细胞同样发生了严重的组织损伤。灌胃MBP后,避光组大鼠(图6A~D)出现了局部肾小管上皮细胞脱落、水样变性等症状,但大鼠肾脏病理切片可见肾皮质和髓质结构清晰,系膜区无增生及沉积物,基底膜未见病变;随着时间的延长,在2 h左右细胞肾小囊管腔变窄,出现炎症细胞浸润等症状。日光组大鼠(图6E~H)灌胃MBP后1 h左右,出现了肾小体数目减少、肾小囊管腔变窄、淋巴细胞浸润程度增大等症状,且损伤程度明显高于避光组。结果表明日光能够加重MBP对大鼠的肾脏损伤。
2.2.6 DBP对大鼠排泄的影响
大鼠灌胃DBP后,其主要以MBP的形式从尿液中排泄,且在尿液中没有检测到DBP,避光组0~4 h时尿液中MBP质量浓度为0.427 μg/mL,4~8 h时为0.164 μg/mL,8~12 h时为0.455 μg/mL,12~24 h时为0.560 μg/mL。日光组0~4 h时尿液中MBP质量浓度为0.132 μg/mL,4~8 h时为0.069 μg/mL,8~12 h时为0.291 μg/mL,12~24 h时为0.099 μg/mL。在0~24 h内,避光组大鼠尿液中MBP质量浓度高于日光组(图7A)。MBP和DBP在大鼠粪便中均被检出(图7B),且0~24 h内避光组大鼠粪便中DBP和MBP质量浓度均大于日光组。结果表明与日光组相比较,避光组大鼠体内DBP更容易代谢排出体外。

图 7 大鼠排泄物中DBP、MBP的质量浓度变化Fig. 7 Changes in urinary and fecal concentrations of DBP and MBP in rats
3 讨 论
PAEs是全球最普遍的环境激素类污染物,其中DBP是我国最常使用的增塑剂之一,其可通过饮食摄入、呼吸道吸入和皮肤接触等途径对人体造成危害[16],可导致过敏性皮炎[17]以及生殖[18]、神经、肝脏、肾脏和心脏等多种器官系统的损伤[17-23]。DBP导致肝细胞过氧化物酶增多、肝肿大的问题曾引起专家的重视,尽管该作用机制还不是十分明确,但是过氧化物酶增生和肝肿大通常发生在肿瘤形成之前[24]。近年来,有研究者通过测量尿液中DBP代谢物MBP的含量来间接反映DBP的接触水平,基于样品的易得到性和检测方法的成熟性,认为MBP是一种较合适的反映DBP暴露的生物标志物[25]。
本实验应用对比研究,结合多元统计分析方法,对DBP的光敏毒性进行研究,旨在找出DBP与光照的关联性以及DBP在光照下毒性加剧的机理,从整体上阐明光照条件对大鼠的毒性作用及代谢调控机制。本研究采用高效液相色谱法检测了在光照和避光条件下大鼠体外、体内血清中DBP和MBP的质量浓度。体外血清实验结果表明DBP在大鼠血清中转化为MBP,与是否光照无关。因此,对于MBP在日光下是否会加剧对大鼠的毒性作用以及机理进行研究。大鼠代谢实验中,经口灌胃DBP,其可迅速经胃肠道吸收,经小肠内的非特异性酶代谢成稳定的MBP,MBP和其他代谢产物与葡糖普酸结合后随尿液排出[3]。大鼠经口给予MBP后,在心脏、肝脏、脾、肺和肾脏中均能检测到DBP,但肝脏和肾脏中MDP质量浓度明显高于其他脏器。
Jurczuk等的研究表明,ROS超过一定浓度时会对其他生物分子产生不利影响[26],因此ROS的生成和氧化应激反应是MBP造成肝脏和肾脏炎症的主要方式。在灌胃MBP后,日光组大鼠的肝脏和肾脏组织GSH含量下降,这可能是由于MBP持续氧化产生应激产物ROS所引起,同时GSH由于去除过氧化氢而被消耗。王立蓉等研究表明,细胞GSH含量降低到一定程度时,细胞会受到不可逆损伤[27]。MDA在机体的新陈代谢过程中发挥重要作用,可以造成膜的流动性与通透性的改变,导致异常生理生化反应与免疫反应的产生。SOD可以保护细胞不受氧自由基的损伤,能够清除H2O2和·OH。当MDA含量升高、SOD活力降低时,可以引发氧化应激反应,从而损伤细胞甚至导致某些细胞的死亡[28]。对染毒大鼠肝脏和肾脏中关键指标进行测定,结果表明,ROS和MDA的含量与MBP染毒后光照时间呈正相关,GSH含量和SOD活力与MBP染毒后光照时间呈负相关;相同剂量MBP染毒后,与避光组相比,日光组大鼠血清中ROS和MDA含量较高,GSH含量和SOD活力较低,表明光照能加剧MBP对大鼠肝脏和肾脏组织的氧化损伤。
肝脏和肾脏的HE染色病理切片观察结果表明,染毒后随着时间的延长,日光组大鼠肝细胞和肾小管上皮细胞出现明显的细胞核固缩、细胞水肿、空泡样变、脂肪滴增大融合等症状,而避光组损伤程度相对较轻,结果表明日光能够加剧MBP对大鼠肝脏和肾脏的组织损伤。大鼠排泄物的研究结果表明,光照条件较避光条件下MBP在大鼠体内更不易排出体外。说明DBP是一种对雄性大鼠具有潜在危害的光敏毒性物质。
DBP可通过食物、饮水等多种途径被人体摄入[29]。张鹏等研究表明,在胶陀螺中含有一定量的天然DBP[30],且近年来更有胶质菌食用不当而引发的急性中毒事件的报道[31]。李志军等研究表明,不同的浸泡方式对黑木耳中DBP含量存在相关性[32],胶质菌的急性中毒事件可能与胶质菌中存在的DBP有关。本研究证明了DBP的光敏毒性和在体内脏器中的分布规律,应重视DBP对人体的潜在危害,并对DBP及含有天然DBP食品的健康危险度做出更全面的评价。

