乙酸条件下长石溶解—沉淀过程探究
方晓玲 蒋定建

摘 要:以长石为研究对象,在静态条件下开展了乙酸溶蚀长石模拟实验,结合电感耦合等离子质谱仪(ICP-OES)、扫描电镜(SEM)等表征手段,明确矿物之间具体的转化反应并计算其反应速率。结果表明:在整个溶蚀过程中,钠长石和钾长石一直在溶解,其中钠长石的溶解速率为2.38×10-10 mol·kg-1·s-1,而钾长石的溶解速率为3.27×10-10 mol·kg-1·s-1;钠长石的溶解导致了勃姆石的早期形成,随后朝着高岭石区域靠近,并最终稳定在该相区;而钾长石先是在勃姆石区域短暂停留,接着稳定在白云母相区,最后由于溶液中Na+的富集,使得钾长石开始向钠长石转化;碱性长石的溶解是一个动态耦合的矿物转化过程,期间不仅有原生矿物的溶解,还伴随着次生矿物的沉淀。
关 键 词:碱性长石;溶解-沉淀;矿物转化;反应速率
中图分类号:P168.11 文献标识码: A 文章编号: 1671-0460(2019)09-1990-05
Abstract: Taking feldspar as research object, simulation experiment on the dissolution of feldspar in acetic acid was carried out under static condition. By ICP-MS, SEM and other characterization methods, specific transformation reactions among minerals were identified and the reaction rates were calculated. The results showed that albite and K-feldspar were dissolving during the entire dissolution process, in which the dissolution rate of albite and K-feldspar were 2.38×10-10 mol·kg-1·s-1 and 3.27×10-10 mol·kg-1·s-1 respectively; the dissolution of albite led to the early formation of boehmite, which then moved toward the kaolinite region and eventually stabilized in the phase region; K-feldspar firstly stayed in the boehmite area momently and then stabilized in the muscovite phase area. Finally, due to the enrichment of Na+ in solution, K-feldspar began to transform into albite; the dissolution of alkaline feldspar was a dynamically coupled mineral transformation process, which not only included the dissolution of primary minerals, but also had the precipitation of secondary minerals.
Key words: Alkaline feldspar; Dissolution-precipitation; Mineral conversion; Reaction rate
深埋藏条件下的硅酸盐岩溶蚀过程模拟一直是地球化学较为活跃的领域之一[1-4],长石作为硅酸盐岩的关键组成,其溶蚀过程更是研究的重中之重。而乙酸作为烃源岩裂解的主要产物,也是地层中含量最多的有机酸[5],其对长石等骨架颗粒的溶解为油气的储集和运移开辟了通道,因此厘清乙酸条件下长石的溶解过程就显得尤为重要。近年来,国内外众多专家学者开展了一系列碱性长石溶蚀的探究性實验,并取得了令人瞩目的成就[6-10]。 Schott[11]认为,在远离平衡的弱酸性环境中,长石溶解是溶液中氢离子和矿物表面阳离子的交换反应以及长石中Al-O键和Si-O键的水解反应共同作用的结果。Bevan等[12]的实验结果表明乙酸根通过与Al3+、Si4+形成络合物来降低表面反应的活化能,近而提高其在溶液中的溶解度。黄思静等[13]研究发现,乙酸对长石存在选择性溶蚀,矿物表面的K+、Na+和Ca2+优先溶出,而Al3+,Si4+则最后溶出。罗孝俊等[14]的结论证明长石本身的类型及结构也是制约溶解反应的重要因素,相同地层环境下,钾长石比钠长石更为稳定。然而,前人的研究大都关注于长石的溶解模型以及溶解反应的热动力学函数关系,从未真正地明确溶蚀过程中矿物间的动态转化。于此,本文以乙酸溶蚀长石为核心,在静态条件下探究乙酸溶蚀长石过程中存在的具体的矿物转化反应,并计算出各自的反应速率,为后续研究长石贮藏提供积极的指导。
1 实验部分
1.1 实验材料和仪器
碱性长石(中国石化胜利油田分析测试中心);分析纯乙酸(上海化学试剂有限公司);去离子水(实验室自制)。
电子天平(AL104,瑞士梅特勒科技有限公司);pH计(pHS-3C,上海雷磁有限公司);电热鼓风干燥箱(DHG-9023A ,长春石油设备有限公司);水热反应釜(316L,山东恒化科技有限公司);电感耦合等离子体发射光谱仪(Agilent 5110,美国安捷伦技术有限公司);扫描电子显微镜(EM-30,韩国库赛姆科技有限公司);X射线光电子能谱(250Xi,美国赛默飞世尔科技有限公司);X射线晶粉衍射仪(X-Pert PRO,荷兰帕纳科技术有限公司)。
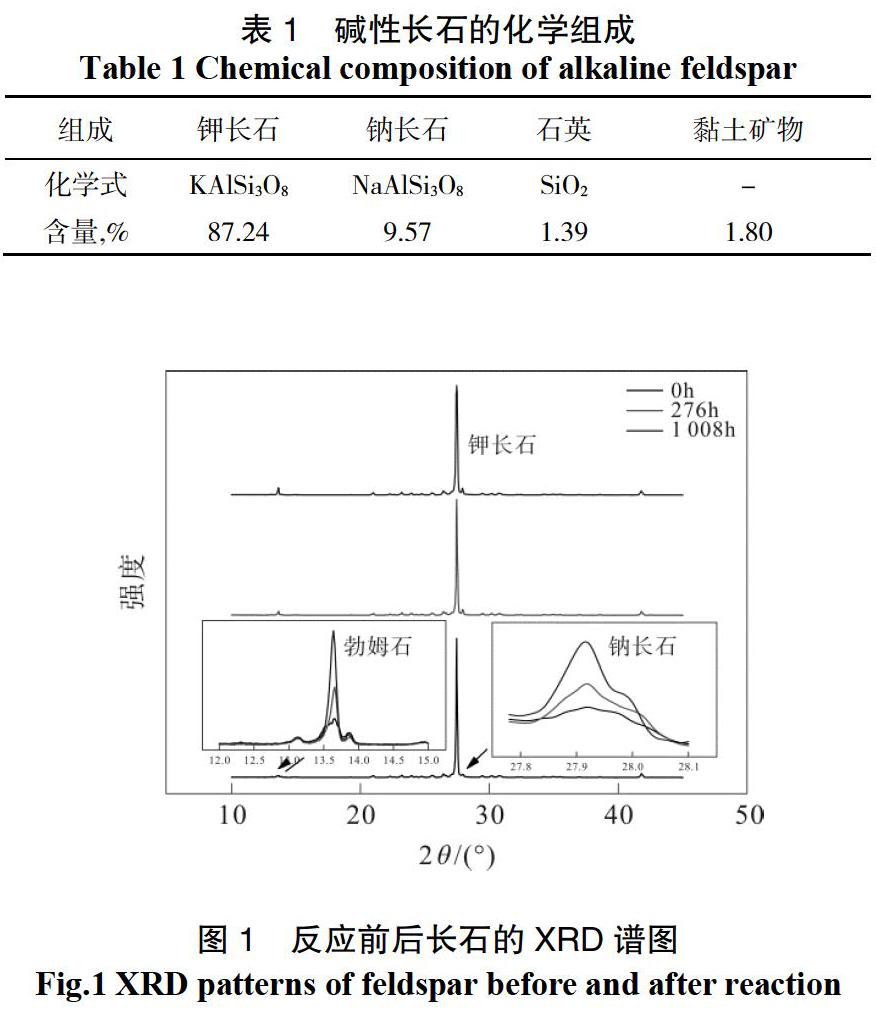
酸性環境能够引发钠长石的溶解,使之形成勃姆石,反应式如下:
在密闭、静止的实验条件下, 伴随着钠长石的溶解, H+的浓度不断降低,而SiO2和Na+则被逐渐释放到溶液中。实际上,a(Na+)/a(H+)几乎没有变化,凸显了亚稳态矿物之间的质量传递速率减慢(例如从勃姆石到高岭石),这甚至可能是钠长石溶解所引起的高度过饱和所致。因此,可以借助log(a(Na+)/a(H+)) 与log(a(SiO2)(aq))的比值随时间的变化作为一种在相图中定性分析矿物转化过程的手段。
大量铝硅酸盐矿物的溶解实验数据[16-18]显示,碱性长石的溶解并未按照化学计量关系进行,这种情况多数发生在溶解过程中存在次生矿物沉淀以及部分原矿发生选择性溶蚀的情况下,除此之外,溶蚀液组成的差异同样会导致这一结果,因此液相中SiO2和Na+的浓度之比并未达到3∶1。
由图5可知,溶液的组成开始向高岭石区域靠近,并最终停留在此相区。这个过程中所发生的矿物转化可以用式(2)来表示:
虽然扫描电镜并未拍摄到高岭石的图片,但通过分析溶液中离子浓度的变化趋势,推测钠长石的溶解过程中可能存在高岭石这一次生矿物,故在相图中将其呈现出来。
3.1.2 钠长石溶解速率
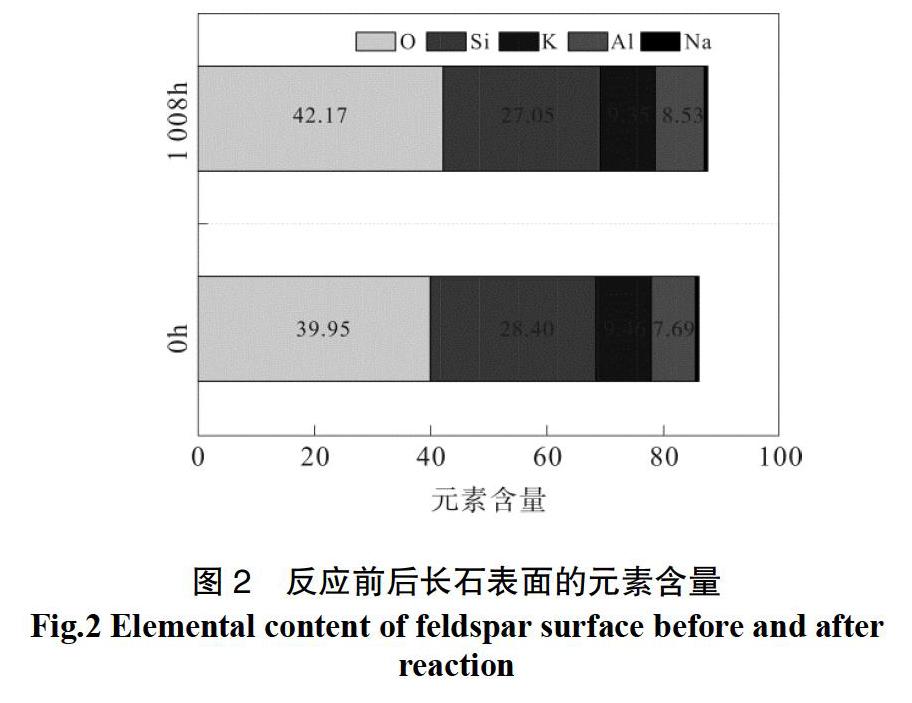
Na+的释放是由钠长石溶解造成的,故可用溶液中Na+浓度的变化来计算钠长石的溶解速率。由图4可知,反应的前415 h内,Na+浓度的增长速率较快,钠长石的溶解主要集中于此,之后由于溶解反应的驱动力减弱以及次生矿物钠长石的形成导致了增速放缓。因此,按照这一时期内(<415 h)Na+浓度的变化,计算钠长石的溶解速率为2.38×10-10 mol·kg-1·s-1,与Hellmann的测定值[19]基本一致。
3.2 钾长石的溶解与沉淀
3.2.1 钾长石的矿物转化过程
钾长石在整个反应过程中总呈现不饱和状态,表明其一直在溶解,反应过程如下:
钾长石通过消耗H+,将SiO2和K+释放到溶液中。由于钠长石的优先释放以及其含量相对较少,因此在较长的反应时间里(>180 h),可近似认为溶液中的SiO2主要由钾长石所贡献。溶蚀液组成先是在勃姆石区域短暂停留,随后稳定在白云母相区(图6)。白云母的形成可由式(4)来表示:
在图3b中,可以明显地观察到,长石表面有大量的钠长石晶体形成,其转化方程为:
然而,图6并没有考虑平衡体系之外的离子,因此相图中并未呈现钾长石向钠长石转化的区域,特别是在溶液中含有Na+的情况下。
3.2.2 钾长石溶解速率
结合溶液中离子浓度的动态变化以及扫描电镜的结果,钾长石的溶解-沉淀过程大致分为三个阶段(表3)。
由表3可知,反应的初始阶段,钾长石以溶解为主,其速率为3.27×10-10;中间阶段,由于溶解反应的热力学驱动力减弱以及矿物表面活性位点上形成了次生矿物从而妨碍了反应的继续,使得白云母的沉淀反应占优势,其速率为4.42×10-12;最后阶段,由于溶液中Na+的富集,钾长石开始向钠长石转化,反应速率为1.83×10-11 。由此可见,乙酸溶蚀长石是一个动态耦合的矿物转化过程,期间既有原生矿物钾长石、钠长石的溶解,也有次生矿物勃姆石、白云母、钠长石的沉淀。
4 结 论
(1)碱性长石中的钠长石组分的水解导致了勃姆石的早期形成。根据实验初期(<415 h)溶蚀液中Na+的浓度变化,计算出了钠长石的溶解速率。
(2)碱性长石中的钾长石组分始终在溶解。溶蚀液组成先是在勃姆石区域短暂停留,随后稳定在白云母相区。由于溶液中Na+的富集,使得钾长石开始向钠长石转化。钾长石的溶解-沉淀过程可分为三个阶段,明确了各时期的主反应并计算出了相应的反应速率。
(3)对于乙酸溶蚀长石而言,其反应是一个复杂的矿物转化过程,在原生矿物钾长石、钠长石溶解的同时,伴随着勃姆石、白云母等次生矿物的沉淀。
参考文献:
[1]赵国泉,李凯明,赵海玲,等.鄂尔多斯盆地上古生界天然气储集层长石的溶蚀与次生孔隙的形成[J].石油勘探与开发,2016, 32(1): 53-55.
[2]远光辉,操应长,黄克来,等.东营凹陷北带古近系碎屑岩储层长石溶蚀作用及其物性响应[J].石油学报, 2013, 34(5): 853-866.
[3]陈永波,潘建国,张寒,等.准噶尔盆地玛湖凹陷斜坡区断裂演化特征及对三叠系百口泉组成藏意义[J]. 中国岩溶,2015, 26(1): 11-24.
[4]Blum, T C. Dissolution and precipitation kineticsof kaolinite [J]. Science, 2014, 29(3): 649-686.
[5]Elizabeth,吴传芝,等.澳大利亚麦克阿瑟盆地古元古代巴尼克里克组页岩储集岩相长石溶解致孔隙度增大现象研究[J].石油勘探与开发, 2016, 15(2): 96-118.
[6]Burch, T E, Nagy, K L. Free energy dependence of albite dissolution kinetics at 80℃ and pH 8.8 [J]. Chemical Geology, 1993, 10(5): 137–162.
[7]Wild M. The pH-dependent control of feldspar dissolution rate by altered surface layers [J]. Chemical Geology, 2016, 44(2): 148-159.
[8]Fan Q. Coupled alkali-feldspar dissolution and secondary mineral precipitation in batch systems: New experiments at 200 ℃ and 300 bars [J]. Chemical Geology, 2009, 258(4): 125-135.
[9]Paul. Coupled alkali-feldspar dissolution and precipitation[J]. Geochemistry, 2015, 34(1): 1-12.
[10]Gautier M Q. Experimental study of K-feldspar dissolution rates as a function of chemical at 150 ℃ and pH 9 [J]. Geochemical 2016, 58(3): 4549–4560.
[11]Schott M J. The effect of aluminum, pH, and chemical on the rates of dissolution reactions. [J]. Geochemical, 2012, 58(2): 2011–2024.
[12]Bevan J, Savage D. The effect of organic acids on the dissolution of K-feldspar[J]. Mineralogical 2009, 53(372): 415-425.
[13]黃思静,黄可可,冯文立,等.成岩过程中长石、高岭石、伊利石之间的物质交换与次生孔隙的形成:来自鄂尔多斯盆地上古生界和川西凹陷三叠系须家河组的研究[J].地球化学, 2009, 38(5):498-506.
[14]罗孝俊,杨卫东,李荣西,等. pH值对长石溶解度及次生孔隙发育的影响[J].矿物岩石地球化学通报, 2001, 20(2): 103-107.
[15]Ehrenberg S N. Depth-dependent transformation of kaolinite to dissolve in sandstones of the norwegian continental shelf[J]. British Journal of Oral & Maxillofacial Surgery, 2015, 28(3): 325-352.
[16]张永旺,郭建宇.低温条件下长石溶解模拟实验研究[J]. 地质论评, 2009, 55(1): 134-142.
[17]Bob T. Thekineticsof thedissolution of feldspars in CO2 [J].Geochemical, 2007, 40(2): 157-161.
[18]Huang W T. The effect of fluid/rock ratio on feldspar dissolution under reservoir conditions[J]. Clay Minerals, 2006, 21(4): 585-601.
[19].Hellmann. The kinetics of dissolution at 100, 200, and 300 [J]. Geochemical, 2010, 58(2): 595–611.

