EMS诱变对沙枣种子萌发和幼苗生长的影响
高维锡 程 毛 齐 艳 陈 敏
( 1) 烟台职业学院食品与生化工程系,264670,山东烟台; 2)山东师范大学生命科学学院,250014,济南;3) 烟台工程职业技术学院,264006,山东烟台 )
1 引 言
土壤盐渍化是十分严重的环境问题,盐碱土在地球上分布广泛,据统计全球的盐碱土面积约为9.55亿hm2[1].我国现阶段土壤盐渍化问题较为严峻,我国的盐渍土面积约为3.6×107hm2,约占全国可利用面积的4.88%[2].黄河三角洲,被誉为“金三角”地带.该区域是黄河改道携带大量泥沙淤积形成的冲积平原[3].该地区土壤的盐渍化导致生态系统退化严重,植被生境以及多种野生动物的栖息地受到破坏.土壤盐渍化已经成为制约黄河三角洲生态系统和农业可持续发展的最重要问题.黄河三角洲地区的盐碱地以每年1.3×103~2.0×103hm2的速度不断增加[4].由于土壤含盐量高,地下水位高,并且土壤中营养成分分布不均匀,有机质低,氮、磷等缺乏,黄河三角洲地区的土壤不宜种植作物和造林,限制了城市绿化的发展.
沙枣(ElaeagnusangustifoliaL.)是一种能源植物,又称七里香、香柳、桂香柳等,是胡颓子科(Elaeagaceae)、胡颓子属(Elaeagnus),小乔木或落叶灌木[5,6].沙枣(E.angustifolia)的果实烘干后可以作为丰富的维生素来源,如维生素E、胡萝卜素、维生素C、硫胺B1和钙、镁、钾、铁和锰等矿物质元素[7].沙枣可以耐受干旱环境,并且能够在很多气候和土壤条件下生长,现已被认为是防风固沙,道路绿化和填海造林的主要树种.由此可见,沙枣是一种理想的绿化苗木,并且具有耐盐碱的特点,将其引种到黄河三角洲地区,对于改良黄河三角洲土地,改良当地的盐渍土环境具有重要的作用.
诱变育种是利用物理或者化学等因素诱导植物产生变异,一直是育种者的首选技术,可以通过诱变获得有价值的突变体,并根据不同的育种目标对突变体进行有目的的筛选与鉴定,选育出新品种或者创造出新遗传资源的现代育种技术[8,9].20世纪40年代,Auerbach和Robson[10]首次发现利用化学物质芥子气可以诱导植物发生基因突变,奠定了化学物质在植物诱变育种上的基础[11].甲基磺酸乙酯(EMS)是一种应用广泛的化学诱变剂,是对DNA的某些结构进行改变.一般是将带有一个或者多个活性烷基转移到电子密度高的碱基上,通过烷化反应置换氢原子,氢键的能力发生改变,从而使DNA结构发生改变[12].EMS诱变在作物育种研究中发挥了十分重要的作用.具有许多优点,第一,简便易行,实验操作简单,无需复杂的设备,只需要充分的实验材料,便可以大规模进行实验,也可以进行重复实验[13].第二,具有多效性,诱变后产生的突变类型较多.第三,突变频率高,易于对突变体的筛选.第四,缩短育种年限,经过EMS化学诱变后,作物一般在第二代就可以稳定,经过3~6代就可以育出新品种[12].
目前,EMS诱变技术作为一项国内外成熟的技术,现已被广泛应用到植物育种,基因功能分析等方面.沙枣作为绿化苗木的缺点是树型不好,分支分蘖太强,干性太差,本课题组试图通过EMS诱变筛选沙枣的变异植株,获得适合绿化的沙枣新品系.本研究采用EMS诱变技术首先确定其诱导处理沙枣幼苗的半致死剂量,通过比较不同剂量处理下幼苗的生长状态,得出EMS对沙枣幼苗进行诱变的最佳条件,以期为后筛选耐盐树型优美的沙枣突变体奠定基础.
1 实验材料及方法
1.1实验材料于2017年10月从甘肃省购入当年收金昌沙枣种子,去除果肉后洗净种子,待种子完全干燥好置于4 ℃冰箱备用.
试剂:EMS(北京百奥莱博科技有限公司,CAS号:62-50-0).
1.2实验方法
1.2.1 EMS诱变处理 实验设置4个浓度梯度(0.5%、1%、1.5%、2%)分别处理6 h,确定半致死浓度;然后在半致死浓度下,设置4个时间梯度(2、4、8、12 h),确定合适的处理时间.每个处理50粒种子,3个重复,确保籽粒饱满,大小一致.以不添加EMS为对照(CK).
具体做法是:挑选大小一致饱满的金昌沙枣种子,用清水洗净后,室温浸种3 d使种子充分吸水后,再浸于不同浓度的EMS溶液中(EMS溶液用pH 7.0的磷酸缓冲液配置),置于28 ℃摇床250 r/min进行诱变处理.到达处理时间后倒掉EMS溶液,用EMS失活缓冲液(100 mol/L)硫代硫酸钠溶液冲洗10~20次使EMS失活,最后用双蒸水洗10~20次,每次1 min.将处理后的种子均匀洒在铺有滤纸的培养皿中(直径15 cm),每皿20粒种子,3个重复,置于组培室中避光培养7 d(杨育红和张文辉 2006),温度为(23±5)℃.将处理后的种子种在盛有洗净细砂的培养盘中,每盆15粒种子,3个重复,置于大棚中进行幼苗成活实验,保持相对湿度60%(白天)/80%(晚上),温度25 ℃(白天)/15 ℃(晚上).
为了确定EMS处理对沙枣种子萌发率和幼苗成活率的影响,将经EMS处理后的沙枣种子放置于铺有滤纸的培养皿中,以胚根突破种皮为依据,统计种子的萌发率;将经EMS处理后的沙枣种子种植于盛有干净河沙的培养盘中,当胚芽长出,并且长出真叶为依据,统计幼苗成活率.
1.2.2 诱变幼苗的生长指标测定 小心取出沙枣幼苗,自来水洗净后,再用去离子水轻轻地冲洗3~5遍,吸水纸吸干表面水分后称取鲜重(FW),然后将材料放入事先烘干的信封中,编号标记,105 ℃杀青15 min,然后放入60~80 ℃烘箱中烘至恒重,称取干重(DW).
含水量= (FW-DW)/FW×100%.
用刻度尺测量胚轴胚根长.
1.2.3 EMS诱变半致死剂量确定 EMS半致死浓度(LCt50)是指在一定时间内引起50%植株死亡的药物浓度,本实验以沙枣种子萌发率为指标计算EMS半致死浓度.根据沙枣种子在不同EMS浓度下的萌发率,拟合直线回归方程Y=a1+b1X,得出萌发率为50%时所对应的EMS浓度,即为EMS半致死浓度[14].
1.3数据分析所有数据均用SPSS Statistics 17.0软件进行数据统计分析,采用单因素方差分析(ANOVA)及新复极差法(Duncan)进行差异显著性检验,P≤ 0.05 表示存在显著性差异.
2 实验结果
2.1不同浓度EMS处理对沙枣种子萌发率的影响由图1可以发现,经过不同浓度的EMS诱变处理后,沙枣种子萌发受到了显著的抑制.随EMS浓度的升高,沙枣种子的萌发率急剧下降,和对照相比,用0.5%,1%和1.5%EMS处理的种子萌发率分别降低了20%,56%和98%.当EMS浓度升高达到2%时,种子完全不萌发.
2.2不同浓度EMS处理对沙枣种子胚根根长的影响图2表示不同浓度EMS处理沙枣种子萌发后胚根根长.随着EMS浓度的加大,萌发出的幼苗表现出明显的根长变短,长势减弱的趋势,与对照组的根长差异显著.EMS浓度为0.5%时沙枣种子萌发后的根长为对照组种子的50.9%,1.5%处理浓度的沙枣种子根长为对照组的24.46%.
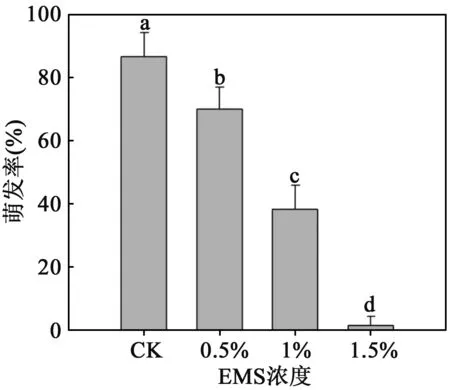
图1 不同浓度EMS处理对沙枣种子萌发率的影响
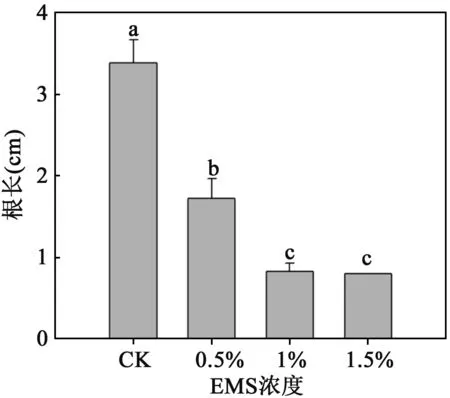
图2 不同浓度EMS处理对沙枣胚根根长的影响
图中数据代表平均值±标准差 (n= 3),不同字母表示P≤ 0.05水平上差异显著(下同).
2.3不同浓度EMS处理对沙枣种子萌发幼苗生物量的影响通过图3可以发现,EMS处理显著抑制了沙枣种子萌发幼苗的生长率.与对照相比,随着EMS浓度的逐渐增大,幼苗的鲜重(图3A)、干重逐渐降低(图3B),但EMS诱变对幼苗的含水量没有显著影响(图3C).

图3 不同浓度EMS处理对沙枣种子萌发幼苗鲜重(A)、干重(B)和含水量(C)的影响
2.4不同浓度EMS处理沙枣种子对沙枣幼苗成活率的影响为了计算EMS的半致死剂量,将经过不同浓度EMS处理后吸涨的沙枣种子种植于盛有洗净河沙的培养盘中,测定沙枣幼苗的成活率.通过图4可以看出,随着EMS浓度的增加,沙枣幼苗成活率逐渐下降,各处理浓度之间差异显著.EMS诱变剂浓度为1%时,沙枣幼苗的成活率约为对照的45%,所以选择EMS的诱变浓度1%为半致死剂量.

图4 不同浓度的EMS处理对沙枣幼苗成活率的影响

图5 1%EMS处理不同时间对沙枣种子存活率的影响
2.5不同处理时间对沙枣幼苗成活率的影响以1% EMS为半致死浓度,研究不同处理时间对沙枣幼苗成活率的影响.结果表明,随着诱变时间的增加,沙枣幼苗的成活率逐渐降低,并且各组之间差异显著.诱变处理4 h时,幼苗成活率为对照的55.36%,处理8 h时,沙枣种子的存活率为对照的23.21%,当处理时间达到12 h时,达到完全致死水平.
2.6不同处理时间对沙枣幼苗生物量的影响通过图6发现,随着处理时间的增加,沙枣幼苗的鲜重(A)、干重(B)和含水量(C)均呈现出逐渐降低的趋势.其中,沙枣幼苗的鲜重显著降低,且各组之间差异显著(图6A).EMS诱变降低了沙枣幼苗的含水量,处理时间为4 h时含水量和对照相比降低了21%,进一步延长处理时间至8 h,含水量不再降低(图6 C).
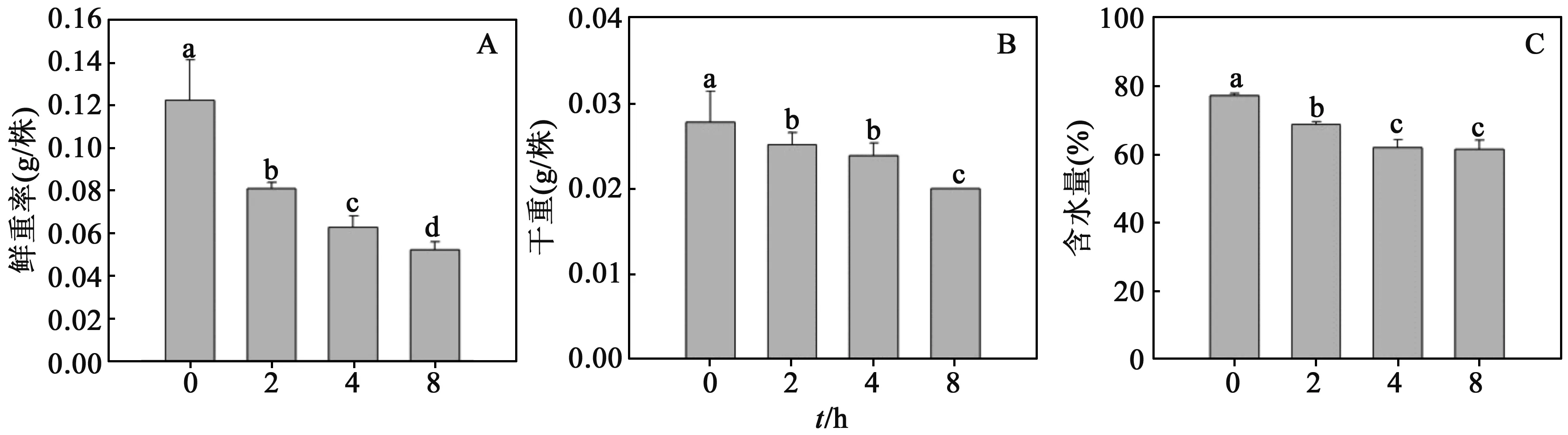
图6 1%EMS处理不同时间对沙枣种子鲜重(A),干重(B)和含水量(C)的影响
2.7不同处理时间对沙枣幼苗根长的影响如图7所示,随着EMS诱变剂处理时间的逐渐增加,沙枣幼苗根长的生长受到了显著的抑制作用.和对照(处理0 h)相比,用EMS处理2 h、4 h和8 h的根长分别降低了65%、82%和88%.
2.8不同处理时间对沙枣幼苗成活率的影响测定了不同处理时间下的沙枣幼苗的成活率.通过图8可以发现,随着EMS处理时间的增长,沙枣幼苗成活率逐渐下降,各组之间差异显著.和对照(处理0 h)相比,用EMS处理2 h,4 h和8 h的幼苗成活率分别降低了13%,67%和95%.

图7 1% EMS处理不同时间对沙枣种子根长的影响
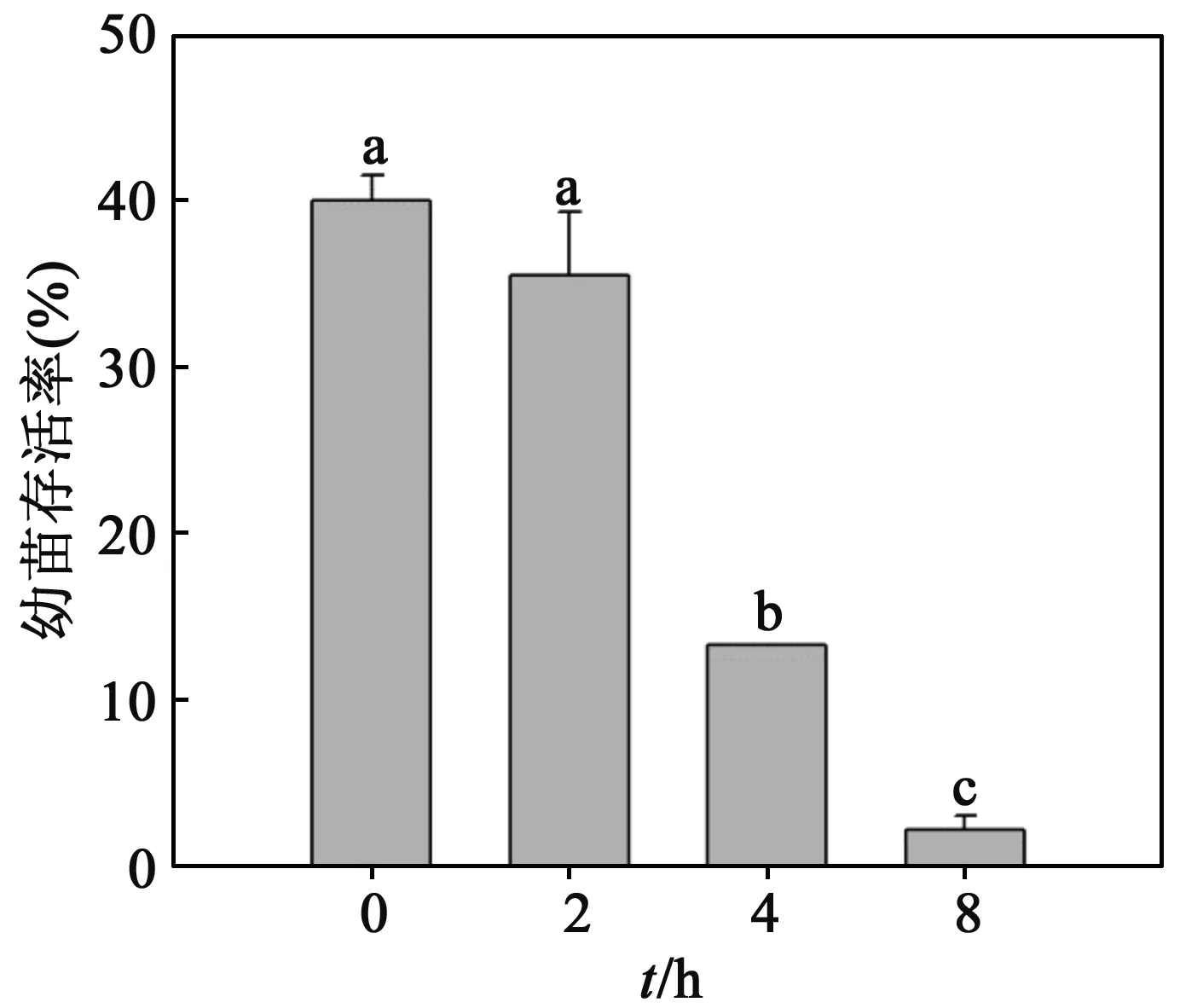
图8 1% EMS处理不同时间对沙枣幼苗成活率的影响

图9 1% EMS处理不同时间下利用拟合回归方程确定EMS诱变的半致死剂量
2.9 EMS诱变半致死剂量的确定通过不同浓度处理确定了EMS诱变沙枣的半致死浓度为1%,为进一步确定半致死时间,以幼苗成活率的log值-处理时间作图,得出拟合直线回归方程(图9),可知EMS诱变半致死处理时间约为3 h.
3 讨 论
我国研究化学诱变起步较早,现已取得了较为瞩目的成就,诱变育成的品种数量和种植面积居世界第一,但是,大部分研究都集中在牧草以及大田作物的突变构建和扩大种种质资源的基础上.沙枣耐盐碱、耐干旱,是一种有前景的绿化植物,目前对沙枣种子进行化学诱变的研究较少.化学诱变技术可以丰富植物种质资源、选育出植物新品种,是一种新兴的育种手段.而化学诱变确定适宜的化学诱变剂处理浓度难度较大.如果诱变剂处理浓度太高,对诱导物的毒害作用较大,会导致其存活率降低;如果浓度太低,会显著降低诱变效果,有益突变的概率降低[15].
梅凌锋等[16]对广金钱草种子进行EMS化学诱变处理,得到随着EMS浓度的升高和浸种时间的延长呈逐渐降低的趋势;对幼苗根和下胚轴长也有显著影响.10 g/L EMS浸种16 h和15 g/L浸种8 h的相对致死率均为49.99%,推荐15 g/L EMS浸种8 h为最佳诱变剂量.马海新等[17]对加工番茄种子进行EMS诱变,处理分为干种子组和湿种子组,得出4%的EMS浓度处理12 h为EMS处理加工番茄干种子的较适宜浓度;3%的EMS浓度处理12 h为EMS处理加工番茄湿种子的较适宜浓度.朱娜娜[18]用EMS处理西瓜种子1.0% EMS浸种9 h相对出苗率为58.67%,相对成苗率为49.18%,接近半致死剂量,因此,此组合可确定为西瓜Wl-17种子发生诱变的最佳EMS剂量组合.吴博[19]诱变杉木种子,得出EMS诱变的致死组合为:浓度0.9%,时间12 h.上述研究表明,EMS 对不同种类的种子敏感度不同,要针对不同的处理材料,不同的品种特性、处理浓度、诱导时间都会导致最终的变异效果不同.
本研究探讨了不同EMS浓度处理和不同时间处理对沙枣吸涨种子的影响.EMS化学诱变抑制了沙枣种子的生长发育,随着诱变浓度的增大,沙枣种子的存活率逐渐降低,当诱变浓度为2%时,沙枣种子全部死亡(图1).不同处理浓度下,沙枣种子鲜重和干重显著降低(图2),推测是由于EMS诱变影响了种子有机质的积累,导致鲜重干重显著降低而含水量并没有显著变化.崔霞等[20]通过EMS诱变番茄时发现,EMS诱变抑制了番茄幼苗根长生长.本研究结果也与前人研究结果一致.不同浓度EMS诱变处理8 h,沙枣种子的根长显著缩短(图2),并且在1%EMS处理条件下,随着处理时间的逐渐增长,种子的根长也呈现出显著缩短的趋势(图7).为了计算EMS诱变的半致死剂量,本研究引入幼苗成活率作为筛选指标,发现处理6 h时,随着处理浓度的逐渐增大,幼苗成活率逐渐降低,确定1%为半致死浓度.接着测定了在1%EMS处理下不同处理时间对沙枣幼苗成活率的影响,得出处理时间约为3 h.所以,沙枣种子的最佳诱变条件:浓度为1% ,处理时间约为3 h.
总之,本研究首次对沙枣种子进行了EMS诱变处理,确定了最佳EMS诱变条件,为下一步获得沙枣变异植株提供了理论依据.

