MicroRNA-185对血管紧张素Ⅱ介导的心肌细胞肥大和凋亡的影响
杨 莉,贺 静,孙晓慧,乌宇亮
(1.泾河工业园长庆油田职工医院心血管内科,陕西 西安 710201;2.西安交通大学第一附属医院心血管内科,陕西 西安 710061)
病理性心肌肥厚是猝死、心力衰竭等心血管疾病的危险因素,其涉及心肌细胞肥大、凋亡、自噬及炎症反应等相关机制[1]。寻找有效阻碍心肌细胞肥厚和凋亡的靶分子对改善心肌肥厚具有重要意义。研究证实,微小核糖核苷酸(microRNA,miRNA)参与调控心脏疾病的发生、发展[2],miR-185在心肌肥厚模型中表达下调[3],但其对心肌细胞肥大及凋亡的影响尚不清楚。心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(B-type natriuretic peptide,BNP)和β-肌球蛋白重链(β-myosin heavy chain,β-MHC)是心肌细胞肥大的标志物,这些指标升高表明存在心肌细胞肥大。细胞分裂周期蛋白42(cell division cycle 42,CDC42)是miR-185的一个靶分子,与心肌细胞肥大和凋亡有一定关系,其在压力超负荷的心脏和体外培养的心肌细胞中可被多种激动剂包括血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)和异丙肾上腺素激活,具有心肌损伤作用。活化型多聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)和活化型caspase 3是细胞凋亡的分子标志物。本研究通过观察miR-185对Ang Ⅱ介导的心肌细胞系H9c2细胞中ANP、BNP、β-MHC和CDC42 mRNA表达水平及细胞活性、细胞凋亡小体富计因子、活化型PARP和活化型caspase 3的影响,旨在探讨miR-185影响心肌细胞肥大及凋亡的作用机制,为miR-185在心脏疾病防治中的应用提供理论支持。
1 材料与方法
1.1 细胞心肌细胞系H9c2细胞由中国科学院细胞库提供,冻存于含二甲基亚砜(dimethylsulfoxide,DMSO)的胎牛血清(fetal bovine serum,FBS)中,液氮保存。
1.2 主要试剂与仪器Ang Ⅱ、青链霉素、达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、FBS购自美国Hyclone公司,DMSO购自美国Sigma公司,miR-185模拟物(miR-185 mimic)和miR-185阴性对照购自上海吉玛制药技术有限公司,实时定量SYBR Mix试剂盒购自德国Qiagen公司,TRIzol试剂盒、lipofactamine2000试剂购自美国Invitrogen公司,细胞凋亡检测试剂盒购自德国罗氏公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)裂解液和胰蛋白酶细胞消化液购自上海碧云天生物技术有限公司,辣根过氧化酶标志羊抗兔二抗购自北京中杉金桥生物技术有限公司,蛋白显色液购自美国Millipore公司,抗PARP、活化型caspase 3、CDC42抗体购自美国Cell Signaling Technology公司,双荧光素酶报告mRNA试剂盒和反转录试剂盒购自美国Promega公司;37 ℃恒温培养箱购自德国Heraeus公司,细胞培养板购自美国Coring公司,ABI 7500聚合酶链反应(polymerase chain reaction,PCR)仪购自美国Applied Biosystems公司,低温高速离心机和多功能酶标仪购自美国Thermo Fisher公司。
1.3 实验方法
1.3.1 细胞培养取冻存的H9c2细胞,37 ℃温水迅速融化,并悬浮于含体积分数20%FBS的DMEM中,混匀后转移至新的离心管,1 000 r·min-1离心10 min,弃培养基,沉淀的细胞加入10 mL DMEM,混匀,接种于10 cm培养皿中,置于37 ℃、含体积分数5% CO2的培养箱中培养48 h后进行细胞传代。传代2次后用于后续实验。
1.3.2 细胞分组及转染取传代2次的H9c2细胞接种于6孔板,培养24 h后随机分为对照组、Ang Ⅱ处理组、阴性对照组和miR-185过表达组。对照组细胞采用无血清培养基培养5 h后更换为完全培养基,继续培养43 h;Ang Ⅱ 处理组细胞采用无血清培养基培养5 h后更换为完全培养基,继续培养19 h,给予0.1 μmol·L-1Ang Ⅱ处理24 h;阴性对照组细胞采用含50 pmol·L-1miR-185阴性对照的无血清培养基培养5 h,更换为完全培养基继续培养19 h,给予0.1 μmol·L-1Ang Ⅱ处理24 h;miR-185过表达组细胞采用含50 pmol·L-1miR-185 mimic的无血清培养基培养5 h,更换为完全培养基继续培养19 h,给予0.1 μmol·L-1Ang Ⅱ处理24 h。阴性对照组和miR-185过表达组细胞使用的转染试剂为lipofectamine2000。
1.3.3 实时定量PCR检测各组细胞中miR-185及ANP、BNP、β-MHC、CDC42 mRNA表达取“1.3.2项”培养的各组细胞,用磷酸盐缓冲液(phosphate buffered solation,PBS)清洗3次,各孔加入1 mL TRIzol试剂,于冰上反应10 min,提取细胞总RNA。按照反转录试剂盒说明书将RNA反转录为cDNA。反转录体系为:2×PCR缓冲液 12.5 μL,cDNA 1 μL,上游引物 0.5 μL,下游引物 0.5 μL,SYBR Green I 0.5 μL,灭菌蒸馏水10.0 μL,总体积为25 μL。每组设置3个复孔,使用ABI 7500 PCR仪进行实时定量,工作程序设定为:94 ℃预热2 min,94 ℃变性15 s,60 ℃退火30 s,72 ℃ 延伸30 s,共40个循环。以U6作为miR-185的内参,β-actin作为ANP、BNP、β-MHC和CDC42的内参。采用2-ΔΔCt法计算目的mRNA和miR-185的相对表达量。
1.3.4 CCK-8法检测各组细胞活性取“1.3.2项”培养的各组细胞,弃培养基,各孔加入100 μL PBS洗涤2次,加入100 μL培养基和10 μL CCK-8溶液混匀;同时设置空白孔,加入100 μL培养基和10 μL CCK-8溶液;37 ℃培养箱中孵育2 h,采用多功能酶标仪于450 nm波长处测定各组细胞的吸光度值(A),细胞活性(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。其中A实验组代表对照组、Ang Ⅱ处理组、阴性对照组和miR-185过表达组细胞A值。每组设3个复孔,取均值。
1.3.5 细胞凋亡检测试剂盒检测各组细胞凋亡情况取“1.3.2项”培养的各组细胞,弃培养基,用PBS清洗3次,胰蛋白酶消化后将细胞重悬于PBS中,800×g离心10 min,弃上清液,加入200 μL裂解液,室温反应30 min;800×g离心10 min。取20 μL上清液加至链霉亲和素包被的微孔板中,再加入80 μL免疫反应试剂(偶联有过氧化物酶的抗-DNA单克隆抗体、抗组蛋白-生物素、温育缓冲液,1118混合),在摇床上避光室温反应2 h,弃上清液,加入250 μL温育缓冲液清洗3次,弃上清。加入100 μL 2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸二铵盐,室温孵育45 min。另设1个孔,加入100 μL 2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸二铵盐作为空白对照孔(不含细胞裂解液)。于405 nm波长处测定各孔A值,每组设置3个复孔。结果用凋亡小体富计因子表示,富计因子=(A实验组-A空白对照组)/A对照组。其中A实验组代表对照组、Ang Ⅱ入理组、阴性对照组和miR-185过表达组细胞A值。富计因子越大,表明细胞凋亡水平越高。
1.3.6 Western blot法测定各组细胞中活化型PARP、活化型caspase 3和CDC42蛋白表达取“1.3.2项”培养的各组细胞,PBS清洗3次,每孔加入80 μL蛋白裂解液,于冰上反应15 min,收集细胞总蛋白,BCA法测定各组细胞的蛋白浓度。每组取50 μg 蛋白样品,在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(dodecyl sulfate,sodium salt-polyacrylamide gel electrophoresis,SDS-PAGE)中进行电泳分离,采用200 mA恒流湿转移法将蛋白转移至硝酸纤维素膜,室温条件下采用50 g·L-1牛血清白蛋白封闭1 h,加入抗PARP(1500)、活化型caspase 3(1500)、CDC42(11 000)和β-actin(15 000)一抗,4°C过夜孵育,加入羊抗兔二抗(15 000)室温孵育2 h,每张膜上加入200 μL显色液,进行X胶片曝光显影,采用Image J软件分析各条带的灰度值。实验重复3次,取均值。
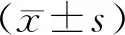
2 结果
2.1 4组细胞中miR-185及ANP、BNP、β-MHC mRNA、CDC42 mRNA相对表达量比较结果见表1。与对照组比较,Ang Ⅱ处理组和阴性对照组细胞中miR-185相对表达量显著下降,ANP、BNP、β-MHC和CDC42 mRNA相对表达量显著升高,差异均有统计学意义(P<0.05)。Ang Ⅱ处理组与阴性对照组细胞中miR-185及ANP、BNP、β-MHC、CDC42 mRNA相对表达量比较差异无统计学意义(P>0.05)。与Ang Ⅱ处理组和阴性对照组比较,miR-185过表达组细胞中miR-185相对表达量显著升高,ANP、BNP、β-MHC、CDC42 mRNA相对表达量显著下降,差异均有统计学意义(P<0.05)。
表1 4组细胞中miR-185及ANP、BNP、β-MHC、CDC42 mRNA相对表达量比较

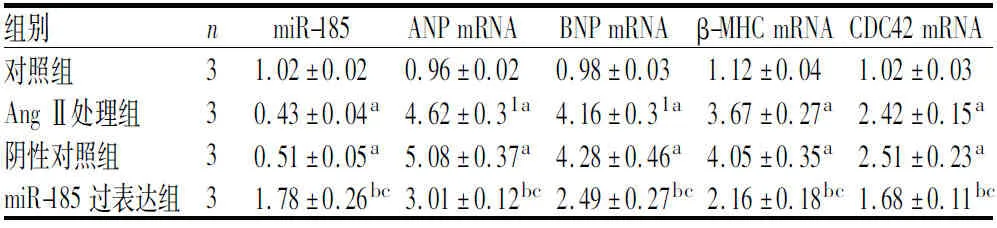
组别nmiR-185ANP mRNABNP mRNAβ-MHC mRNACDC42 mRNA对照组31.02±0.020.96±0.020.98±0.031.12±0.041.02±0.03Ang Ⅱ处理组30.43±0.04a4.62±0.31a4.16±0.31a3.67±0.27a2.42±0.15a阴性对照组30.51±0.05a5.08±0.37a4.28±0.46a4.05±0.35a2.51±0.23amiR-185过表达组31.78±0.26bc3.01±0.12bc2.49±0.27bc2.16±0.18bc1.68±0.11bc
注:与对照组比较aP<0.05;与Ang Ⅱ处理组比较bP<0.05;与阴性对照组比较cP<0.05。
2.2 4组细胞活性比较对照组、Ang Ⅱ组、阴性对照组和miR-185过表达组细胞活性分别为(100.03±1.29)%、(43.26±6.06)%、(36.18±4.27)%和(79.28±5.18)%。与对照组比较,Ang Ⅱ处理组和阴性对照组细胞活性显著降低,差异有统计学意义(P<0.05)。阴性对照组与Ang Ⅱ处理组细胞活性比较差异无统计学意义(P>0.05)。与Ang Ⅱ处理组和阴性对照组比较,miR-185过表达组细胞活性升高,差异有统计学意义(P<0.05)。
2.3 4组细胞凋亡情况比较对照组、Ang Ⅱ处理组、阴性对照组和miR-185过表达组细胞凋亡小体富计因子分别为0.12±0.02、0.56±0.06、0.49±0.04和0.39±0.04。与对照组比较,Ang Ⅱ处理组和阴性对照组细胞凋亡小体富计因子显著增高,差异有统计学意义(P<0.05)。阴性对照组与Ang Ⅱ处理组细胞凋亡小体富计因子比较差异无统计学意义(P>0.05)。与Ang Ⅱ处理组和阴性对照组比较,miR-185过表达组细胞凋亡小体富计因子显著降低,差异有统计学意义(P<0.05)。
2.4 4组细胞活化型PARP、活化型caspase 3和CDC42蛋白相对表达量比较结果见图1和表2。与对照组比较,Ang Ⅱ处理组和阴性对照组细胞中活化型PARP、活化型caspase 3和CDC42蛋白相对表达量显著增高,差异有统计学意义(P<0.05)。阴性对照组与Ang Ⅱ处理组细胞中活化型PARP、活化型caspase 3和CDC42蛋白相对表达量比较差异无统计学意义(P>0.05)。与Ang Ⅱ处理组和阴性对照组比较,miR-185过表达组细胞中活化型PARP、活化型caspase 3和CDC42蛋白相对表达量降低,差异有统计学意义(P<0.05)。
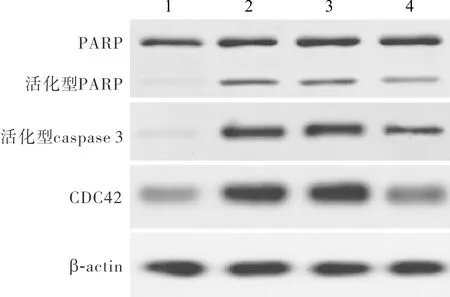
A:对照组;B:Ang Ⅱ处理组;C:阴性对照组;D:miR-185过表达组。
图1 4组细胞中活化型PARP、活化型caspase 3、CDC42蛋白的表达(Western blot)
Fig.1 Expression of cleaved PARP,cleaved caspase 3 and CDC42 protein in the four groups (Western blot)
表2 4组细胞中活化型PARP、活化型caspase 3和CDC42蛋白相对表达量比较


组别n活化型PARP活化型caspase 3CDC42对照组31.02±0.030.95±0.031.01±0.02Ang Ⅱ处理组34.26±0.38a6.87±0.71a3.49±0.21a阴性对照组33.94±0.45a7.03±0.61a3.28±0.32aMiR-185过表达组32.38±0.25bc4.05±0.36bc1.54±0.15bc
注:与对照组比较aP<0.05;与Ang Ⅱ处理组比较bP<0.05;与阴性对照组比较cP<0.05。
3 讨论
心肌肥厚分为生理性肥厚和病理性肥厚,生理性心肌肥厚常发生于儿童猛长期、女性孕期及运动员,病理性心肌肥厚是由长期的压力负荷导致异常血流动力学应激、高血压、心肌梗死等因素引起。早期心肌肥厚有利于维持正常心功能,但肥厚的心肌耗氧量增加,心肌顺应性降低,故长期病理性心肌肥厚会引起心律失常、心力衰竭或者猝死,增加患者死亡风险。研究证实,靶向抑制病理性心肌肥厚能够有效改善心功能[4],因此,如何阻碍心肌肥厚的发生、发展已成为研究热点。心肌肥厚的发生机制复杂,除压力负荷外,交感神经兴奋性增强、肾素-血管紧张素-醛固酮系统激活、胰岛素抵抗、自噬及氧化应激均参与心肌肥厚的发展过程[5-6]。目前,研究者着重于探索能够靶向阻碍心肌细胞肥大的分子或者药物,Ang Ⅱ处理心肌细胞能够建立体外心肌肥厚模型,可用于心肌肥厚发生机制的研究[7]。Ang Ⅱ是Ang Ⅰ在血管紧张素转化酶作用下产生的一种多肽物质。有研究证实,Ang Ⅱ通过激活血管紧张素受体1,经Ca2+-磷脂依赖性蛋白激酶途径,使细胞内Ca2+浓度增加,导致心脏后负荷增加,引起心肌肥厚[8]。在Ang Ⅱ介导的心肌细胞损伤中,心肌细胞肥大的标志因子ANP、BNP和β-MHC表达显著上调[9-10]。本研究中,Ang Ⅱ处理组细胞中ANP、BNP和β-MHC mRNA相对表达量较对照组显著升高,提示Ang Ⅱ成功诱导了心肌细胞肥大;阴性对照组细胞中ANP、BNP和β-MHC mRNA相对表达量与Ang Ⅱ处理组比较差异无统计学意义,表明细胞转染miR-185阴性对照对Ang Ⅱ造成的心肌细胞肥大无明显影响。
MiRNA是一类长度约20~24个核苷酸的小RNA,研究显示,miRNA能够作为疾病诊断及预后判断的标志物,同时,miRNA参与调控心血管疾病、肿瘤等多种疾病的发生、发展[11]。研究发现,miR-185通过调控癌细胞增殖、凋亡、自噬、侵袭和迁移而参与癌症的发生和发展[12- 13]。有研究证实,Ang Ⅱ处理心肌成纤维细胞可导致细胞中miR-185表达水平下调[14]。目前,miR-185对Ang Ⅱ介导的心肌细胞肥大的作用机制尚不明确。因此,本研究就miR-185对Ang Ⅱ介导的心肌细胞系H9c2细胞肥大的作用进行探讨,结果显示,Ang Ⅱ处理组细胞中miR-185表达较对照组下调,提示miR-185可能参与调控Ang Ⅱ介导的心肌细胞损伤;Ang Ⅱ处理组与阴性对照组细胞中miR-185相对表达量比较差异无统计学意义,表明细胞转染miR-185阴性对照对miR-185表达无明显影响;同时,与AngⅡ处理组和阴性对照组比较,miR-185过表达组细胞中miR-185相对表达量显著升高,而ANP、BNP和β-MHC mRNA相对表达量下降,提示过表达miR-185可以抑制Ang Ⅱ介导的心肌细胞肥大。
Ang Ⅱ通过促进心肌细胞肥大、成纤维细胞增殖而参与心脏重构。体外实验研究证实,Ang Ⅱ能够诱导心肌细胞凋亡[15],在体内应用血管紧张素转换酶抑制剂可以阻止心肌细胞凋亡[16]。细胞凋亡是心血管疾病中一个重要的病理过程,阻止或者减少心肌细胞凋亡是保护心肌细胞、改善心功能的一个重要措施。有研究显示,miR-185促进肺上皮细胞凋亡[17];但在内质网应激介导的心肌细胞损伤模型中,过表达miR-185可抑制心肌细胞凋亡[18];这些研究表明,miR-185对不同细胞的作用不完全一致。Caspase家族成员在细胞凋亡中具有重要作用,其家族成员主要包括凋亡启动因子和凋亡执行因子。Caspase 3是关键的凋亡执行因子,是细胞凋亡过程中的主要效应因子,其活化是凋亡进入不可逆阶段的标志。活化型caspase 3能够对其底物进行切割,PARP就是活化型caspase 3的底物之一,被活化型caspase 3切割后,得到的活化型PARP也是细胞凋亡早期标志因子[19-20]。因此,可以通过测定活化型caspase 3和活化型PRAP来评价细胞凋亡水平。本研究结果显示,Ang Ⅱ处理组细胞较对照组细胞活性降低,细胞凋亡小体富计因子显著升高,活化型caspase 3和活化型PARP蛋白表达水平上调,表明Ang Ⅱ可以降低心肌细胞活性,诱导心肌细胞凋亡;阴性对照组与Ang Ⅱ处理组细胞活性及细胞中凋亡小体富计因子、活化型caspase 3和活化型PARP蛋白表达水平比较差异无统计学意义,表明细胞转染miR-185阴性对照对Ang Ⅱ造成的心肌细胞活性降低和凋亡无影响;与AngⅡ处理组和阴性对照组比较,miR-185过表达组细胞活性增高,细胞凋亡小体富计因子显著降低,活化型caspase 3和活化型PARP蛋白表达下调,提示miR-185过表达可以改善Ang Ⅱ导致的心肌细胞活性降低,抑制心肌细胞凋亡。
CDC42是肾素-血管紧张素系统同系物家族成员之一,具有心肌损伤作用。与野生型小鼠相比,特异性敲除心脏CDC42的小鼠在第2、8周心肌肥厚程度加重,并很快转变为心力衰竭[21]。胚胎心肌细胞CDC42缺失会导致右心室发育不良[22],且CDC42可促进缺血再灌注诱导的心肌细胞凋亡[23]。CDC42在压力超负荷的心脏和体外培养的心肌细胞中可被多种激动剂包括Ang Ⅱ和异丙肾上腺素激活。本研究发现,与对照组比较,Ang Ⅱ处理组细胞中CDC42 mRNA和蛋白相对表达量显著增高,提示CDC42参与Ang Ⅱ介导的细胞损伤;阴性对照组细胞中CDC42 mRNA和蛋白相对表达量与Ang Ⅱ组比较差异无统计学意义,表明细胞转染miR-185阴性对照对Ang Ⅱ造成的CDC42 mRNA和蛋白表达无明显影响;与AngⅡ处理组和阴性对照组比较,miR-185过表达组细胞中CDC42 mRNA和蛋白相对表达量显著下调,表明miR-185能够抑制CDC42表达。
综上所述,miR-185可能通过下调心肌细胞CDC42水平来减轻Ang Ⅱ介导的心肌细胞损伤,抑制Ang Ⅱ介导的心肌细胞肥大,改善心肌细胞活性,抑制心肌细胞凋亡,从而发挥心肌保护作用。

