含羞草素对糖尿病大鼠肾脏缺氧损伤及HIF/PHD轴的影响
汤 蜜,李沁芸,李少斌,2,颜晓勇,余丽梅,2,杨亦彬,2
(1.遵义医科大学附属医院 肾内科,贵州 遵义 563099;2.遵义医科大学附属医院 细胞工程实验室再生医学科,贵州 遵义 563099)
近年来大量国内外研究强调了缺氧在慢性肾脏疾病(Chronic kidney disease,CKD)进展中的重要性[1-2]。研究发现低氧状态贯穿了糖尿病肾病(Diabetic nephropathy,DN)发生发展的全过程,并认为这种状态与肾脏微血管病变以及局部新生血管生成密切相关[3-4]。一般情况下,机体可通过激活HIF/PHD轴上的缺氧诱导因子(Hypoxia-inducible factor,HIF),进而激活下游靶基因(血红素加氧酶-1(Heme oxygenase-1,HO-1)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)和促红细胞生成素(Erythropoietin,EPO)等,对缺氧做出适应性应答。但由于HIF半衰期短,易降解[5],导致机体对缺氧状态下的缓冲储备能力下降,可能是推进DN进展的主要原因之一。脯氨酸羟化酶(Proline hydroxylase ,PHD)作为HIF降解反应的关键酶,在调节HIF/PHD轴的HIF表达上有重要作用[6]。含羞草素是一种PHD广泛抑制剂,可通过抑制PHD促进HIF表达,改善机体肾氧平衡。本实验用含羞草素治疗糖尿病大鼠,观察含羞草素对糖尿病大鼠肾脏缺氧及HIF/PHD轴上的相关因子(HIF-1α、PHD2、HO-1)表达的影响。
1 材料与方法
1.1 材料 200~240g SD大鼠(由重庆第三军医大学野战外科研究所提供),3~4月龄;共24只;链脲佐菌素(Streptozotocin,STZ)、含羞草素 (Sigma公司);小鼠抗大鼠HIF-1α单克隆抗体、兔抗大鼠PHD2多克隆抗体(NOVUS 公司);小鼠抗大鼠HO-1单克隆抗体(Abcam 公司);小鼠抗大鼠β-actin单克隆抗体(ZSGB-BIO公司);缺氧探针Hypoxyprobe?-1 Kit(HPI公司);RNA逆转录试剂盒、RNA引物、扩增试剂盒(Sangon Biotech公司);安稳血糖仪(Sinocare 公司)。
1.2 方法
1.2.1 造模分组及采样 本实验由对照组、糖尿病组以及含羞草素治疗组组成。采用腹腔注射STZ(55 mg/kg)模拟糖尿病模型,满足:连续3d血糖>16.65 mmol/L、尿量>原尿量150%、尿蛋白排泄量>30 mg/24 h、尿糖强阳性4项即为模型建立成功。对照组则注射同等剂量的柠檬酸-柠檬酸钠缓冲液。成模8周后,于次日上午9∶00~10∶00经腹腔注射含羞草素(50 mg/kg/d,注射剂量为本课题组前期试验得出)作为含羞草素治疗组。每组设12周末、16周末(从注射STZ开始计算)两个观察时点,每个时点每个组4只大鼠。处死前留取24 h尿,并立即送检24 h尿蛋白。心尖采血用于血糖检测,将双肾切为约3 mm厚的组织片,一部分用于制作石蜡切片;剩余组织装入1.5 mL E管用于提取RNA;放入-80℃冰箱中长期储存。
1.2.2 血糖、尿蛋白 用安稳血糖仪检测各组大鼠血糖,检验科检测24 h尿蛋白。
1.2.3 肾组织常规病理 肾组织切片经10%甲醛固定、乙醇脱水、石蜡包埋后,在温水中展平并用载玻片捞出,晾干后烘箱烤干备用。常规HE、PAS染色观察肾脏病理结构。
1.2.4 肾组织免疫组织化学染色 取出经石蜡包埋后的切片,脱蜡水化,去除内源性过氧化物酶,微波炉加热修复抗原,山羊血清封闭非特异性结合位点,滴加一抗 (抗体稀释倍数:缺氧探针 1∶100、HIF-1α 1∶100、PHD2 1∶300 、HO-1 1∶100),4℃过夜;滴加二抗, 37℃孵育30 min。PBS冲洗后经过显色、苏木素复染、分化、中性树胶封片后,显微镜下观察,选用全自动图像分析系统 (Image-pro plus 6.0) 测定各组的平均积分光密度值(IOD)。
1.2.5 Real-Time PCR检测 冰上提取肾组织总RNA并测定RNA纯度及浓度,根据说明书进行20 μL体系的逆转录和扩增,2^(-△△Ct)法分析Ct值并计算RNA相对表达量。引物序列:β-actin上游5'- AGCCATGTACGTTAGCCATCC -3',下游5'- C TCTCAGCTGT GGTGGTGAA -3';HIF-1α上游5'-TCAAGTCAGCAACGTGG AAG-3',下游5'-TTCACAAATCA TCACCAAGC-3';HO-1上游5'-C GAAACAAG CAGA ACCC AGT-3',下游5'-TGT GTGGCTGGTGTGTAAGG-3';PHD2上游5'- TGGAGACG GAAGATGTGTGA-3',下游5'- CTTGGGTTCAATG TCAGCAA-3'。
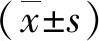
2 结果
2.1 血糖、24 h尿蛋白 与NC组相比,DN组和DL组在两时点的血糖、24 h尿蛋白水平均明显升高(P<0.05)。DL组的血糖较模型组略有升高,但差异无统计学意义。DL组24 h尿蛋白水平较DN组显著降低(P<0.05,见表1)。
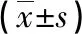
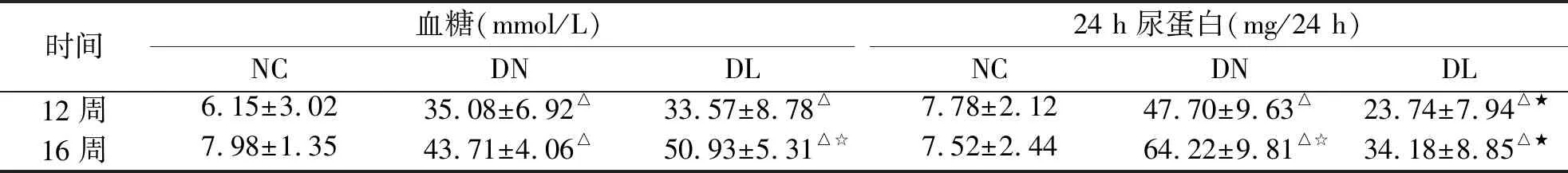
时间血糖(mmol/L)NCDNDL24 h尿蛋白(mg/24 h)NCDNDL12周6.15±3.0235.08±6.92△ 33.57±8.78△ 7.78±2.1247.70±9.63△23.74±7.94△★16周7.98±1.3543.71±4.06△ 50.93±5.31△☆ 7.52±2.4464.22±9.81△☆34.18±8.85△★
与NC 组比较 ΔP<0.05;与DN 组比较,★P<0.05;与 12周比较,☆P<0.05。
2.2 肾脏病理 肾脏病理PAS染色显示NC组的肾脏组织未发现异常病变。而DN组和DL组均可见不同程度的肾小球增大,系膜基质增多、部分肾小管及球囊扩张、肾小管上皮细胞颗粒和空泡变性等病理改变,且DL组的病变相对于DN组有所减轻(见图1)。

图1 大鼠肾组织PAS染色结果(×400)
2.3 肾脏缺氧状况及相关因子免疫组化
2.3.1 缺氧探针(HypoxyprobeTM-1) 3组缺氧探针染色均呈阳性,NC组主要集中在髓质及皮髓交界,而DN组扩大到皮质区。且DN组的阳性着色面积显著扩大(P<0.05),而DL组较DN组显著缩小(P<0.05,见表2、图2)。


时间NCDNDL12周12.59±0.9727.19±2.33△17.38±1.71△★16周11.30±1.3923.53±1.02△16.18±3.90△
与NC 组比较,ΔP<0.05;与DN 组比较,★P<0.05。
2.3.2 HIF-1ɑ、PHD2、HO-1的蛋白及mRNA表达 3个指标均突出表达于肾小管。DN组、DL组肾脏HIF-1α、PHD2、HO-1蛋白和mRNA表达均有不同程度的上调,除DN组16周时的HO-1蛋白、HIF-1α mRNA以及两时点HO-1 mRNA表达上调无统计学意义外,其余时点DN组和DL组的指标均显著高于NC组(P<0.05); DL组两时点肾脏HIF-1α、PHD2、HO-1蛋白表达显著高于DN组(P<0.05),两时点HIF-1α以及16周HO-1 mRNA表达也显著高于DN组(P<0.05)(见表3、图3~6)。

图2 大鼠肾组织缺痒探针免疫组比(×400)
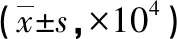
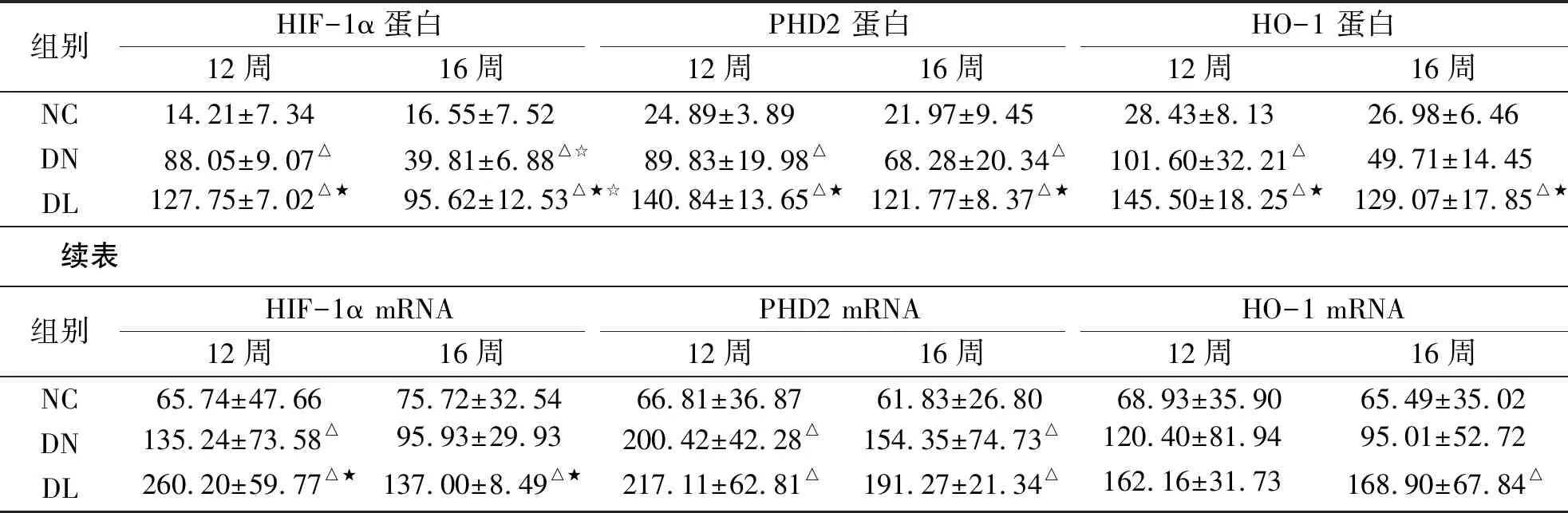
组别HIF-1α蛋白12周16周 PHD2 蛋白12周16周HO-1 蛋白12周16周NC14.21±7.3416.55±7.5224.89±3.8921.97±9.4528.43±8.1326.98±6.46DN88.05±9.07△39.81±6.88△☆89.83±19.98△68.28±20.34△101.60±32.21△49.71±14.45DL127.75±7.02△★ 95.62±12.53△★☆140.84±13.65△★ 121.77±8.37△★145.50±18.25△★129.07±17.85△★ 续表组别HIF-1α mRNA12周16周PHD2 mRNA12周16周HO-1 mRNA12周16周NC65.74±47.6675.72±32.5466.81±36.8761.83±26.8068.93±35.9065.49±35.02DN135.24±73.58△95.93±29.93200.42±42.28△ 154.35±74.73△120.40±81.9495.01±52.72DL260.20±59.77△★137.00±8.49△★217.11±62.81△191.27±21.34△162.16±31.73168.90±67.84△
与NC组比较,ΔP<0.05;与DN 组比较,★P<0.05;与12 周比较 ☆P<0.05。
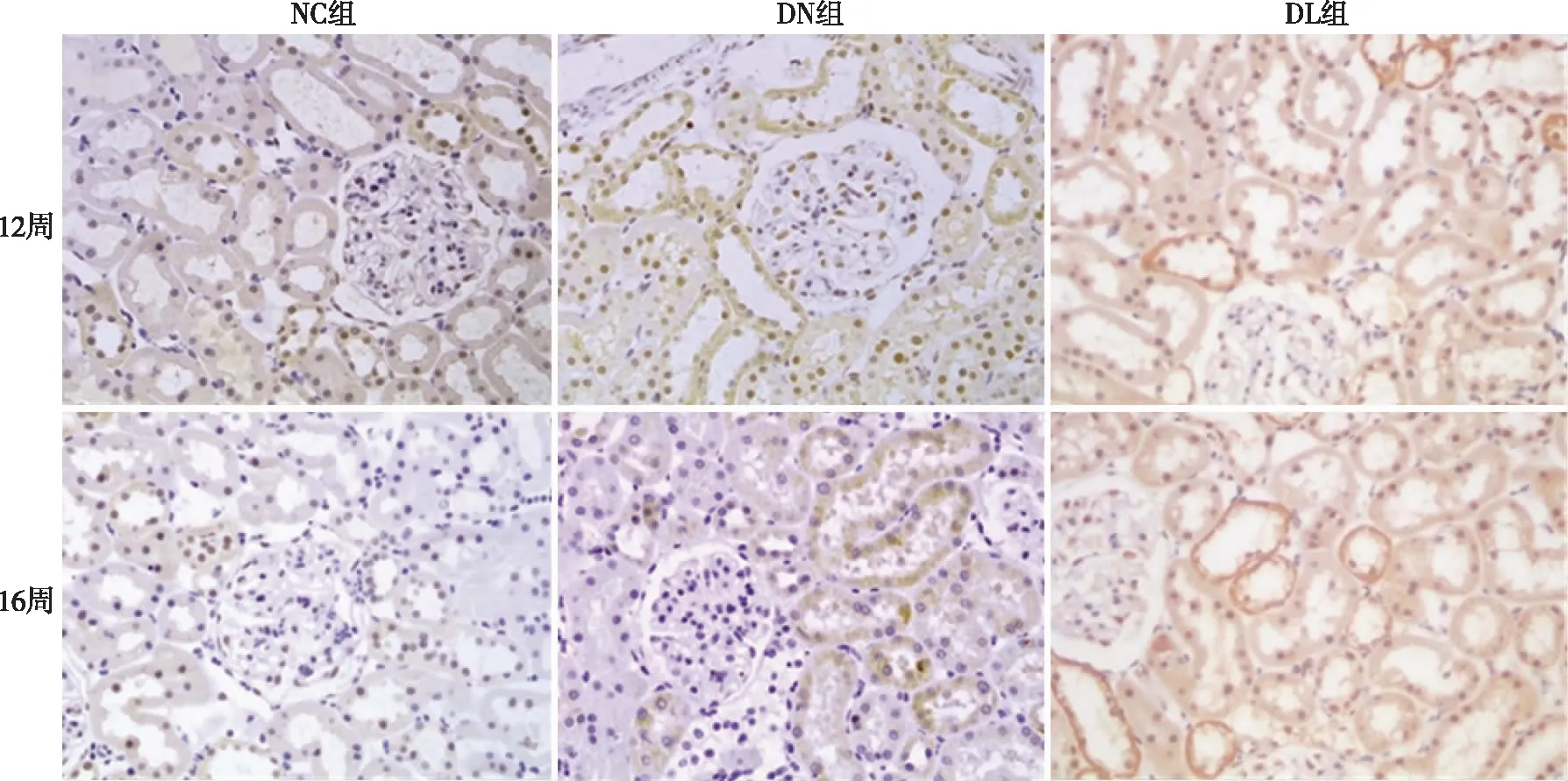
图3 大鼠肾组织HIF-1α免疫组比(×400)

图4 大鼠PHD2免疫组比(×400)

图5 大鼠肾组织HO-1免疫组比(×400)

图6 大鼠肾组织β-actin、HIF-1α、PHD2、HO-1的扩增、溶解曲线
3 讨论
近年来,有研究提出“肾组织缺氧是慢性肾脏病(CKD)进展到终末期肾病(End-stage renal disease,ESRD)的最终共同途径”[7]。糖尿病肾病(DN)作为CKD和ESRD最主要的病因,其发病机制与肾组织缺氧状态也密切相关[8]。HIF是介导机体适应缺氧最主要的转录因子,Zhang X等[9]的研究发现激活HIF能减轻DN中低氧诱导的组织损伤,延缓DN的进展。表明HIF可能是DN的潜在治疗靶点。
HIF主要由氧敏感的α亚基和稳定表达的β亚基构成。HIF-α家族包括HIF-1α、HIF-2α和HIF-3α,其中HIF- 1α是缺氧转录反应的主要调节因子[10]。在低氧条件下,α亚基(HIF-1α)与β亚基形成具有转录活性的异二聚体。然后HIF-1α被反式激活并转移到细胞核中以结合HO-1和VEGF等缺氧反应元件(Hypoxia response element,HRE),通过调控这些基因的表达,维持肾脏血氧平衡[8]。然而在常氧条件下,HIF受到脯氨酸羟化酶(PHD)的调控,易发生降解。Bohuslavova R等[11]发现糖尿病大鼠肾脏处于低氧状态时,HIF不能被充分激活。
含羞草素是一种从含羞草中提炼出的植物氨基酸,其副作用小,通常作为PHD的抑制剂发生效应[12]。研究表明含羞草素能非选择性地抑制PHD的所有同种型,使HIF-1a的表达增加[13]。Schellinger IN等[14]发现含羞草素可激活CKD大鼠肾脏组织HIF的表达,并能在后期显著增加VEGF和EPO的表达,通过促进新生血管形成对抗缺氧。Müller等[15]发现在堆积大量糖基化终产物(Advanced glycation end products,AGEs)的糖尿病晚期,含羞草素能增加DN大鼠牙髓衍生细胞的促血管生成能力。鉴于以上研究,本课题组提出含羞草素可能改善糖尿病大鼠肾脏组织缺氧的猜想。
通过腹腔注射含羞草素干预糖尿病大鼠,利用缺氧荧光探针法检测大鼠体内的缺氧相关因子的表达从而评估各组大鼠肾脏缺氧状况[16]。发现DN组和DL组大鼠在两个时间点肾脏组织的缺氧面积均显著高于NC组(P<0.05),含羞草素治疗后显著减少(P<0.05)。另外,PAS染色结果显示:DN大鼠两时点的肾脏出现不同程度的肾小球增大、系膜基质增多、肾小管扩张等病理改变,含羞草素治疗后改善。说明糖尿病大鼠肾脏存在缺氧状态,且含羞草素能一定程度的缓解其缺氧、改善肾组织病理损伤。另外,含羞草素改善肾脏缺氧的同时(P<0.05),DL组两时点肾脏HIF-1α和HO-1的蛋白、mRNA表达显著上调(P<0.05)。由此我们推测含羞草素改善糖尿病大鼠缺氧的作用可能与调节HIF-1α下游靶基因HO-1的表达相关。Lever等[17]发现HO-1能减轻DN中由氧化应激介导的血管收缩、肾小球病变以及肾功能降低等损伤,具有肾脏保护作用。且HO-1的这些作用受到HIF调控。含羞草素能抑制PHD,上调HIF-1α的表达,使HIF在机体缺氧状态下被充分激活,HO-1随之表达上调,从而发挥抗炎、抗氧化应激等作用[18]。
然而,含羞草素对HIF-1α的调节并不稳定,实验中DL组大鼠HIF-1α的表达在16周较12周下调,但缺氧现象却较12周减轻。说明含羞草素虽能缓解肾脏缺氧状态,但其对HIF的调节机制并不单一[19]。PHD作为HIF降解的关键酶,同时也是接受低氧调控的HIF的下游靶基因[20]。尽管PHD在缺氧时功能低下,但有研究提出即使在缺氧状态下,PHD2也能选择性地促进HIF-1α降解[21]。这也解释了DN组大鼠在氧含量降低时,PHD2的蛋白和mRNA的表达反而较NC组升高的现象。
此外,DL组大鼠肾脏的PHD2蛋白和mRNA表达并未受到抑制,这似乎与含羞草素的作用相矛盾。有学者发现在不同的病理生理条件下,不同的PHD亚型调节不同的HIF-α亚型且作用强度不同;作为转录因子,不同的HIF-α亚型也调控着作用不同甚至功能相反的下游因子的转录[22]。由此可见,PHD抑制剂通过上调HIF的表达从而缓解肾脏缺氧的这一机制非常复杂。含羞草素调控HIF-1α的表达也可能并非完全通过PHD2这一亚型来完成。另外,HIF虽能有效的改善DN大鼠肾脏缺氧状态,但HIF的大量激活也会加重肾组织纤维化[23]。结合本研究16周时的糖尿病大鼠处于DN的中晚期,使用含羞草素后, HIF-1α被大量激活,促进了肾脏组织的纤维化,PHD2在此时表达上调是否归因于机体的一种保护性反应,这需要进一步深入研究。
总之,通过实验发现含羞草素可以在一定程度上改善糖尿病大鼠肾脏组织缺氧和病理损伤,且该作用与上调HIF/PHD轴上的HIF-1α和HO-1的表达有关。这为含羞草素用于DN的临床治疗提供了基础依据。
- 遵义医科大学学报的其它文章
- PAX1甲基化与蛋白检测在宫颈鳞癌及上皮内病变中的应用价值分析
- Phylogenetic characteristics and population genetic diversity of 15 autosomal STR loci in Tujia population of Guizhou of China
- IL-6与GATA-6在肺动脉高压大鼠肺组织中的表达及意义
- Effects of icariside II on hepatic cytochrome P450 expression in mice
- 过表达Nrf2对氧化应激状态下骨髓间充质干细胞凋亡的保护作用
- 九香虫水提液对锰中毒大鼠睾丸损伤的抗凋亡作用

