2-氧杂双环[3,3,0]辛-6-烯-3-酮对映异构体手性拆分及光学纯度的测定
曹 宏,王淑红,赵春影,胡川闽,蔡建辉,修志明
(1.吉林医药学院 吉林省抗体工程科技协同创新中心,吉林 吉林 132013;2.吉林大学 中日联谊医院,长春 130021;3.长春百纯和成医药科技有限公司,长春 130012)

图1 双环内酯对映异构体Fig.1 Enantiomer of 2-oxabicyclo[3,3,0]oct-6-en-3-one
前列腺素(prostaglandins,PGs)是一类重要的内源性生理活性物质,具有多种生理调节功能[1-2].其中PGF2α类似物(如拉坦前列素、曲伏前列素、他氟前列素等)微量使用即可发挥各种生理作用,是医药领域中的一类重要药物[3-5].2-氧杂双环[3,3,0]辛-6-烯-3-酮(简称双环内酯)是合成PGF2α类似物的重要中间体[6-11],该分子有2个手性中心,理论上存在4个对映异构体.在实际生产中,根据反应机理推断,仅存在一对对映异构体,其结构如图1所示,其中A为(1S,5R)-2-氧杂双环[3,3,0]辛-6-烯-3-酮(简称(-)-双环内酯),B为(1R,5S)-2-氧杂双环[3,3,0]辛-6-烯-3-酮(简称(+)-双环内酯),(+)-双环内酯作为(-)-双环内酯对映异构体杂质,若参与后续合成反应则会生成多种较难去除的杂质[12].
随着手性色谱填料多样化,应用手性固定相的液相色谱法拆分及分析手性化合物日益广泛[13],其中纤维素类手性固定相是一种高选择性、高效、分离范围广的手性选择子,也是目前应用和研究较多的手性固定相之一[14].本文选用多糖类直链淀粉衍生物手性柱OD-H直接拆分双环内酯对映体,可简单、快速、准确地检测双环内酯对映异构体含量,对工业生产中前列腺素类药物的质量控制具有重要意义.
1 材料与方法
1.1 仪器与试剂
液相色谱仪(LC-2010AHT型,日本岛津公司);核磁共振仪(AV400型,德国BRUKER公司);高分辨质谱(Q-TofMS/MS型,美国Waters公司);旋光度仪(XG004型,上海仪电科学仪器股份有限公司);OD-H型手性柱(250 mm×4.6 mm,5.0 μm,美国BC公司).(-)-双环内酯、(+)-双环内酯和(±)-双环内酯样品由长春百纯和成医药科技有限公司提供;正己烷、正庚烷、异丙醇和无水乙醇为色谱纯试剂(美国Tedia公司).
1.2 标准品和样品
(-)-双环内酯(光学纯度大于98%)、(+)-双环内酯(光学纯度大于98%)和(±)-双环内酯(HPLC纯度大于98%)样品来自3个不同批次,样品均用无水乙醇溶解稀释至相应的质量浓度.
1.3 方 法
1.3.1 色谱条件 色谱柱:表面涂覆纤维素-三(3,5-二甲基苯基氨基甲酸酯)(OD-H)的硅胶柱(250 mm×4.6 mm,5.0 μm);流动相:V(正己烷)∶V(异丙醇)=95∶5等度洗脱;流速为0.8 mL/min;柱温为25 ℃;紫外检测波长为205 nm;进样量为5 μL.
1.3.2 溶液的制备
1) 对照品溶液制备.分别精密量取(-)-双环内酯10 mg、(+)-双环内酯10 mg、(-)-双环内酯和(+)-双环内酯各10 mg,并分别置于100 mL 容量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,作为(-)-双环内酯、(+)-双环内酯和(±)-双环内酯对照品储备液.分别精密量取3种对照品储备液各1 mL,加入10 mL容量瓶中,用无水乙醇稀释至刻度,摇匀,配制成质量浓度为10 μg/mL的(-)-双环内酯、(+)-双环内酯和(±)-双环内酯对照品溶液.
2) 供试品溶液制备.分别精密量取3批次双环内酯样品各10 mg,并分别置于100 mL容量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,作为3份供试品储备液.精密量取1 mL供试品储备液加入10 mL容量瓶中,用无水乙醇稀释至刻度,摇匀,作为3份双环内酯样品的供试品溶液.
1.3.3 方法学验证实验
1) 系统适用性和稳定性.分别对(-)-双环内酯和(+)-双环内酯对照品溶液进样分析,记录保留时间;取(±)-双环内酯混合对照品溶液,连续进样5次,记录峰面积,计算峰面积相对标准偏差(RSD)值、平均分离度及平均理论塔板数.取(±)-双环内酯混合对照品溶液于0,18,24 h进样5 μL进行液相色谱测定,记录色谱图,计算峰面积RSD值,并考察(±)-双环内酯混合对照品溶液在24 h内的稳定性.
2) 线性关系和检测限确定.在上述液相色谱条件下,取(±)-双环内酯混合对照品溶液,采用逐级稀释法配制成质量浓度分别为1,2,10,50,100 μg/mL的溶液,进样5 μL,记录色谱图,按峰面积(A)与其质量浓度(ρ,μg/mL)计算回归方程.按仪器噪声的3倍响应值确定(-)双环内酯和(+)双环内酯的检测限.
3) 精密度和回收率.精密量取(±)-双环内酯混合对照品溶液5 μL,连续进样5次,记录峰面积,计算精密度.
从(±)-双环内酯混合对照品溶液中量取0.4,0.5,0.6 mL,分别加入5 mL(±)-双环内酯混合对照品溶液中,稀释定容至10 mL.按测得质量浓度和理论质量浓度分别计算回收率.
1.3.4 对映异构体过量测定 取质量浓度为10 μg/mL的双环内酯样品供试品溶液5 μL,置于液相色谱仪中,去除其余杂质峰,用面积归一化方法计算(-)-双环内酯和(+)-双环内酯的质量分数及光学纯度.对映体过量(ee%)的计算公式为
其中:a为(+)-双环内酯的面积百分数,b为(-)-双环内酯面积百分数.
2 结果与讨论
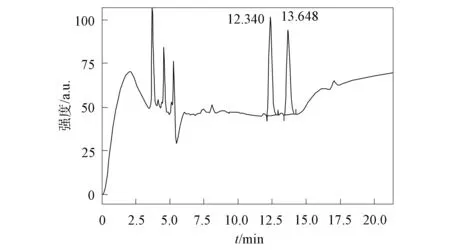
图2 系统适用性实验Fig.2 Applicability experiment of system
分别将(-)-双环内酯对照品溶液和(±)-双环内酯样品供试品溶液注入液相色谱仪中,所得色谱如图2所示.由图2可见,双环内酯样品供试品溶液中(+)-双环内酯和(-)-双环内酯先后出峰,分离度为3.0.

2.1 系统适用性和稳定性结果
测得液相色谱柱的平均理论塔板数以(+)-双环内酯峰计为13 950,以(-)-双环内酯峰计为12 877,即色谱系统适用于该液相色谱方法.对(±)-双环内酯混合对照品溶液进行液相色谱测定,测得(-)-双环内酯峰面积RSD为1.05%,(+)-双环内酯峰面积RSD为1.2%,表明(±)-双环内酯溶液在24 h内稳定.
2.2 线性关系和检测限结果
(-)-双环内酯和(+)-双环内酯在1~100 μg/mL内,其峰面积(A)与质量浓度(ρ,μg/mL)呈良好的线性关系,回归方程分别为
A=8 650.6ρ-1 745.1,R2=0.999;
A=8 701.7ρ-3 627.9,R2=0.999.
按仪器噪声的3倍响应值确定(-)-双环内酯和(+)-双环内酯的检测限,结果分别为0.1,0.05 μg/mL.
2.3 精密度测定结果
精密吸取(±)-双环内酯混合对照品溶液5 μL,连续进样5次,记录峰面积,测得(-)-双环内酯和(+)-双环内酯的RSD值分别为0.41%,0.24%,结果列于表1.
从(±)-双环内酯混合对照品储备液中分别量取0.4,0.5,0.6 mL,加入5 mL(±)-双环内酯混合对照品溶液中,稀释定容至10 mL,按测得质量浓度和理论质量浓度分别计算回收率,结果列于表2.由表2可见: (-)-双环内酯的平均加标回收率为99.6%~101%,RSD为0.46%~0.90%;(+)-双环内酯的平均加标回收率为99.5%~100%,RSD为0.67%~1.01%.

表1 双环内酯的精密度实验结果
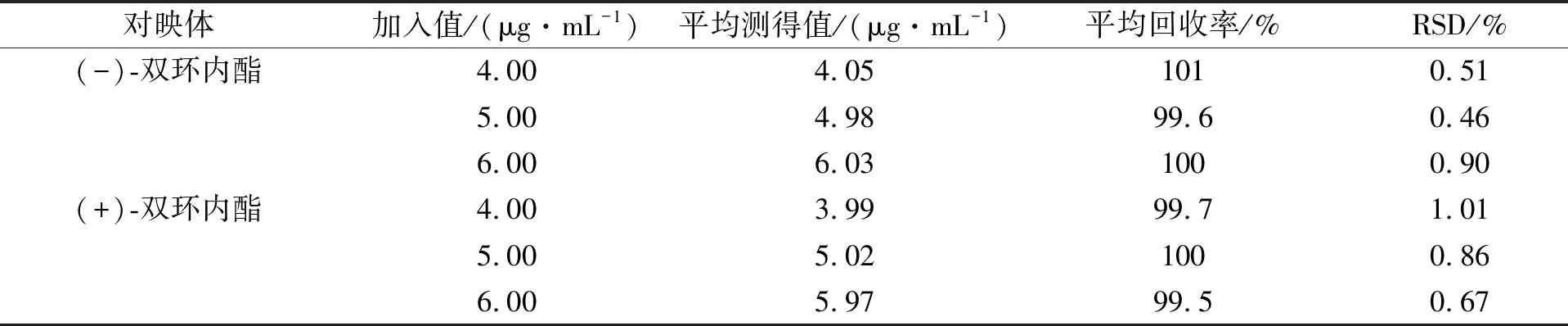
表2 双环内酯的回收率实验结果
上述方法学考察结果表明,该方法可准确测定(-)-双环内酯或(+)-双环内酯的质量浓度.
2.4 对映异构体过量测定结果
对3批次(±)-双环内酯样品的供试品溶液进行测定,计算光学纯度,结果列于表3.由表3可见,3份(±)-双内酯样品能进行有效分离,光学纯度分别为-98%,-99%和98%.

表3 双环内酯的光学纯度
2.5 手性色谱填料的选择
纤维素类手性色谱填料有:表面涂敷直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)硅胶、表面涂敷直链淀粉-三((S)-α-甲基苯基氨基甲酸酯)硅胶、表面共价键合直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)硅胶、表面共价键合直链淀粉-3-氯苯基氨基甲酸酯硅胶等.实验结果表明,选用手性填料表面涂敷纤维素-三(3,5-二甲基苯基氨基甲酸酯)硅胶可使双环内酯的分离度达3.0,可有效分离,故选用手性色谱柱BCOD(250 mm×4.6 mm,5 μm).
2.6 流动相的选择
采用手性色谱柱BCOD(250 mm×4.6 mm,5 μm),正相混合溶剂为流动相的烷烃-多元醇混合溶剂,烷烃分别选用正己烷和正庚烷等,多元醇分别选用甲醇、无水乙醇和异丙醇等,最终确定V(正己烷)∶V(异丙醇)=95∶5为最佳流动相比例.
2.7 流速的选择
使用手性色谱柱BCOD(250 mm×4.6 mm,5 μm),在V(正己烷)∶V(异丙醇)=95∶5的流动相下,考察流速对双环内酯对映异构体分离度及保留时间的影响.为保证检测的时间效率,使双环内酯对映异构体在60 min内全部出峰,确定考察流速为(0.3~1.0)mL/min.当流速为0.3 mL/min时,双环内酯对映体构体二者的分离度为5.7,(-)-双环内酯保留时间为42.2 min,(+)-双环内酯保留时间为43.6 min.增大流速,双环内酯对映异构体的保留时间逐渐减小,对分离度影响较小,但二者中间有杂质峰出现,可见流速仅影响单个对映异构体的分离度.最终确定流速为0.8 mL/min,分离度最好且检测时间在25 min内.
2.8 柱温的选择
分别将柱温设为20,25,30,35,40 ℃,对双环内酯对映异构体进行分析分离.结果表明:随着温度的上升,分离度逐渐减小.25 ℃时分离度较好,且接近室温,易操作,因此选择柱温为25 ℃.
综上所述,本文以表面涂覆纤维素-三(3,5-二甲基苯基氨基甲酸酯)硅胶的纤维素类手性为固定相,以V(正己烷)∶V(异丙醇)=95∶5为流动相,当流速为0.8 mL/min,柱温为25 ℃,检测波长为205 nm时,双环内酯对映异构体实现了较好的分离,分离为3.0,并用面积归一化方法确定了对映体过量值.该方法具有简单、准确、快速的优点,为前列腺素类药物质量控制提供了一种新方法.

