稀土氧化物及黏土负载La2O3除磷性能的实验研究
柴锡炯,尹 琳,陆现彩
(1. 表生地球化学教育部重点实验室,南京大学 地球科学与工程学院, 江苏 南京 210000; 2. 浙江长安仁恒科技有限公司, 浙江 湖州 313100)
受人类活动的影响,大量氮、磷等营养元素被排放进入湖泊、水库、江河等地表淡水体系,导致水体富营养化现象广泛存在。由之引起的水体生态系统结构破坏,已经成为全球性环境问题。依照我国《地表水环境质量标准》(GB3838-2002),我国37个主要湖泊中,中营养型和中-富营养型占55.8%,富营养型占14.7%,重富营养型占 8.8%(Leetal., 2010;许其功等,2016;戴秀丽等,2016;余佑金等,2017)。磷的低浓度富集是最为普遍的现象,也是导致水体富营养化的关键因素。因此,低磷浓度水体的除磷技术有着广泛的市场需求。常用的除磷技术包括生物除磷、化学除磷、电解、离子交换、结晶和吸附等(万里华, 2012; 郝艳玲等, 2016),其中直接用于低浓度磷化学去除的锁磷剂成为目前应用广泛的高附加值产品。锁磷剂(Phoslock)是澳大利亚科学家Douglas等于1999年提出的专利产品(US Patent 6350383)(Douglasetal., 1999; Douglas, 2002)。该专利采用具阳离子交换能力的膨胀性黏土(例如膨润土、蛭石等)作为载体,使用稀土氯化盐或者硝酸盐交换层间阳离子(Na+, Ca2+等)制得锁磷剂,在应用中显示出有效去除水中磷酸盐的性能。另有学者根据类似的原理把镧负载到沸石(宁平等, 2005)、多孔陶瓷(Zuoetal., 2016)、活性炭纤维上后经煅烧(万里华, 2012),获得的材料均可有效去除水体中的磷酸盐。还有学者用Al和La盐柱撑膨润土制得去磷剂去除水中的磷酸盐(Tianetal., 2009),亦取得良好效果。
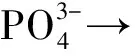
我国是稀土资源最为丰富的国家(程建忠等,2010)。我国南方离子吸附型稀土矿开发一般采用草酸沉淀法和碳酸铵沉淀法提取获得稀土氧化物(贺伦燕等, 1989)。由于稀土元素化学性质的相似性,稀土提纯的初级产品往往多种稀土氧化物共存(赵靖等, 2001)。深入探讨不同稀土氧化物除磷效果,可为稀土资源在环境保护行业的开发应用提供新的机遇。本文实验比较了Y2O3、La2O3、CeO2、Pr6O11、Nd2O3、Sm2O3、Eu2O3和Dy2O3等8种稀土氧化物的去除磷能力,并对其中典型的几种氧化物的除磷过程进行了动力学评估,研究了氧化镧负载于黏土矿物前后除磷能力的差异,以期开拓稀土氧化物用于水体除磷的环境应用。
1 实验材料与方法
1.1 材料和测试
实验材料为分析纯Y2O3、La2O3、CeO2、Pr6O11、Nd2O3、Sm2O3、Eu2O3和Dy2O3稀土氧化物。实验前需制备磷酸盐溶液,首先将分析纯磷酸二氢钾(KH2PO4)于110℃干燥2 h,在干燥箱中自然冷却;称取磷酸二氢钾0.219 7 g溶于水,移入1 000 mL容量瓶中,加入适量KOH调节pH值,得到50 mg/L、pH值为7.5±0.1的磷酸盐溶液。由于pH值的变化对稀土氧化物除磷影响较大,实验模拟天然湖泊水体pH值,溶液pH值定为7.5。实验所用试剂购自上海阿拉丁有限公司。
磷浓度测定采用钼锑抗分光光度法(GB11893-89),测试仪器为UV1800紫外可见分光光度计。通过实测建立吸光度和磷酸根浓度的标准曲线方程,R2=0.999 7。扫描电镜观察采用Zeiss Supra 55场发射扫描电镜(FE-SEM)(Carl Zeiss, Oberkochen, Germany)和能谱分析(EDS,牛津仪器公司,Inca X-Max 150 mm2)观察和鉴定,加速电压设置为5 kV和15 kV,测试前样品表面需喷铂增加其导电性。
1.2 稀土氧化物吸附磷酸根的动力学实验
室温20℃条件下,在烧杯中加入体积(V, L)为1.0 L 、pH值为7.5±0.1、初始浓度(C0,mg/L)为5 mg/L的磷酸二氢钾溶液,分别按1∶1、5∶1和9∶1的稀土氧化物与磷的摩尔比加入稀土氧化物粉末,稀土氧化物选择了Y2O3、La2O3、CeO2、Pr6O11、Nd2O3、Sm2O3、Eu2O3和Dy2O3共8种。反应过程中使用磁力搅拌器按500 r/min不间断搅拌,在反应2、12、24、48、72、96、120 h后分别取水样,经0.45 μm膜过滤测定磷酸根浓度(Ct, mg/L),求出去除量Q(mg) [Q=(C0-Ct)V],并计算除磷率E(%)[E=100(C0-Ct)/C0]。实验设有两组平行,并测定了La2O3、Eu2O3和Dy2O3组在反应2、24、48、72、120 h后的溶液pH值。
同时,分别使用准一级、准二级、准三级模型对吸附动力学数据进行拟合,计算公式参考文献Tian等(2009)。
1.3 稀土氧化物的磷酸根吸附等温线测定
选择其中5种典型稀土氧化物进行磷酸根吸附等温线测定。在5只烧杯中分别加入1.0 L浓度为1、3、5、8和10 mg/L、pH值为7.5±0.1的磷酸二氢钾溶液,之后分别加入Y2O3、La2O3、Nd2O3、Eu2O3和Dy2O3各50 mg,作用120 h后测定磷酸盐浓度,此浓度为平衡浓度,记为(Ce, mg/L)。在此基础上绘制吸附等温线,并使用Langmuir模型和Freundlich模型进行拟合,两者的表达式参考文献Freundlich(1906)和Langmuir(1918)。
1.4 稀土氧化物吸附磷酸根影响因素的实验研究
因稀土氧化物颗粒加入水中后会快速沉降,可能抑制稀土氧化物的吸附效率,本文评估了搅拌的影响,设置了静置组和搅拌组,向100 mL浓度为5 mg/L、pH值为7.5±0.1的磷酸盐溶液按稀土氧化物/磷酸根摩尔比5∶1分别投入Y2O3、La2O3、Nd2O3、Eu2O3、Dy2O3等5种稀土氧化物,作用120 h后测定水中磷浓度。搅拌组采用磁力搅拌器500 r/min不间断搅拌,静置组全程无搅拌。
由于在稀土氧化物吸附磷酸根的体系中,稀土氧化物也可能发生溶解并结合磷酸根生成沉淀。为了评估稀土氧化物溶解的影响,本文测定了室温20℃条件下氧化镧溶解平衡的饱和浓度为59.5×10-9。
1.5 氧化镧负载黏土的除磷实验
考虑到稀土氧化物粉末在水相体系中的分散性较差,本文将除磷性能最好的氧化镧负载于黏土矿物,并测定了负载氧化镧黏土后的磷吸附行为。设定2组实验:第1组分析黏土矿物吸附磷酸根的能力,称取研磨至200目以下膨润土、凹凸棒石、高岭土各0.5 g加入到150 mL磷浓度为10×10-6的溶液中;第2组称取膨润土、凹凸棒石、高岭土各4.75 g与0.25 g氧化镧混合均匀,研磨至200目以下,然后称取0.5 g负载氧化镧的黏土加入至400 mL磷浓度为10×10-6、pH值为7.5的磷酸二氢钾溶液,作用72 h后分析溶液中的磷酸根含量,并计算除磷率。
2 实验结果与讨论
2.1 稀土氧化物除磷动力学特征
由图1可知,稀土氧化物除磷效率总体上随时间增加而增加。稀土氧化物/磷酸盐摩尔比值(R)越低的体系达到平衡的时间越短,R为1.0时,大约需要20 h达到平衡,除磷率一般较低;比值为5.0时上升至72 h;比值为9.0时则长达100 h。所有体系均显示La2O3的除磷效果最好,当R为5∶1时,La2O3作用72 h后除磷率达到了90%以上(图1b);其次是Pr6O11、Nd2O3、Y2O3、Eu2O3,除磷率分别为54.8%、52%、45.8%、43.2%,Dy2O3和Sm2O3去除效果较差,实验表明CeO2没有除磷效果。
由图2可知,总体上看,磷酸盐的去除会引起溶液pH值的上升。在作用的初始阶段,除磷率随时间增加而快速增加,溶液的pH值也相应地快速上升;在作用72 h后,溶液pH值略降低。初始阶段的pH值上升是磷酸根吸附至稀土氧化物表面活性位点,置换了部分稀土氧化物表面的羟基,使溶液pH值上升。在实验后期,pH值的降低可能与磷酸二氢根离子的解离并发生中和作用有关,同时稀土氧化物表面活性中心的结合水分子可能发生脱质子,类似现象在镧交换树脂除磷(Wuetal., 2007)、氢氧化锆除磷(Chitrakaretal., 2006)和水合氧化铁吸附除磷(Blaneyetal., 2007)体系亦有发生。
对稀土氧化物去除磷酸根的动力学过程分别使用准一级、准二级、准三级模型进行数据拟合,结果(表1)表明稀土氧化物的除磷过程更符合准一级反应动力学模型。
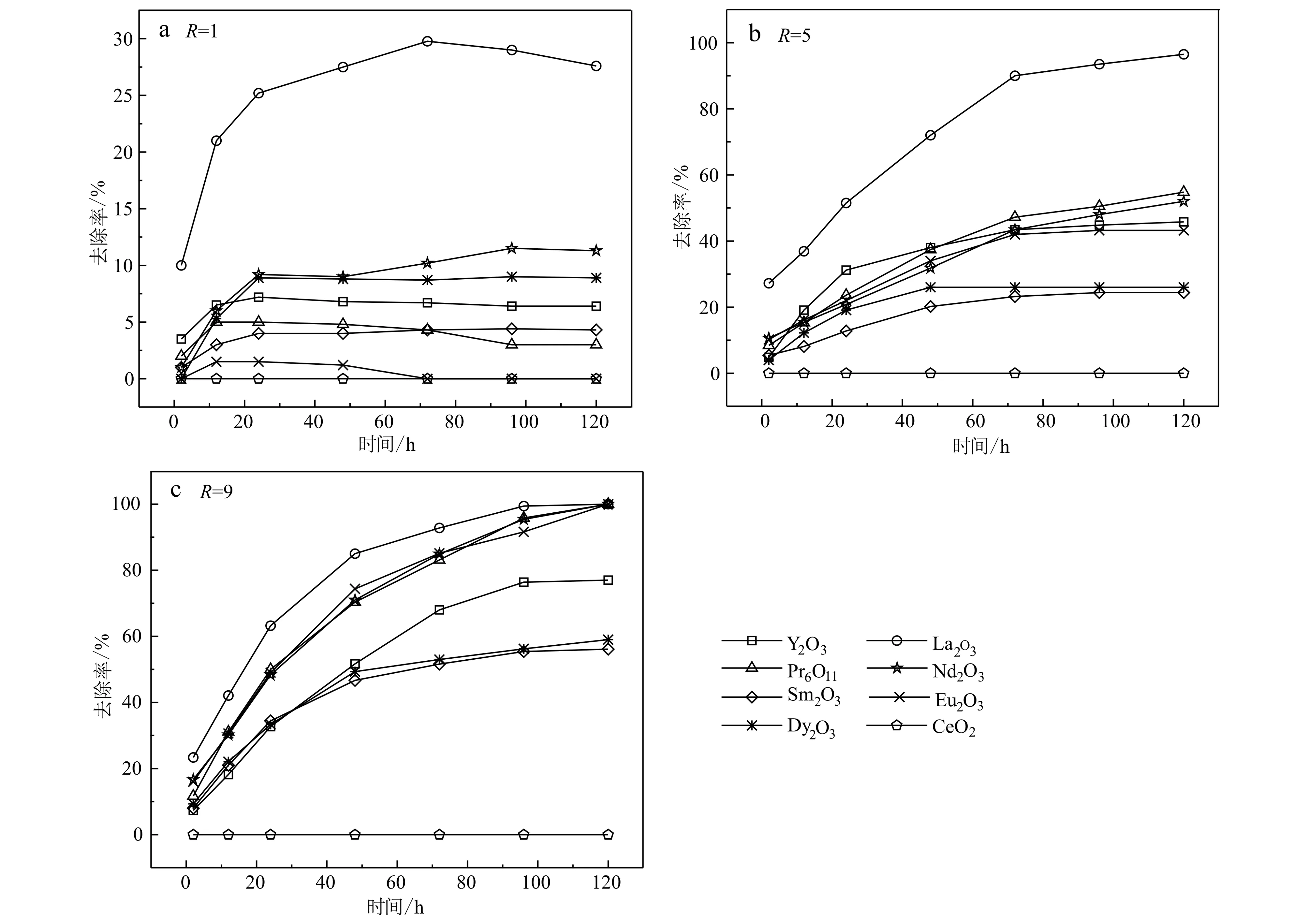
图 1 不同稀土氧化物/磷酸盐摩尔比条件下磷去除率随时间的变化Fig. 1 Phosphorus removal changes with time in the systems with different REE oxides/phosphate ratios
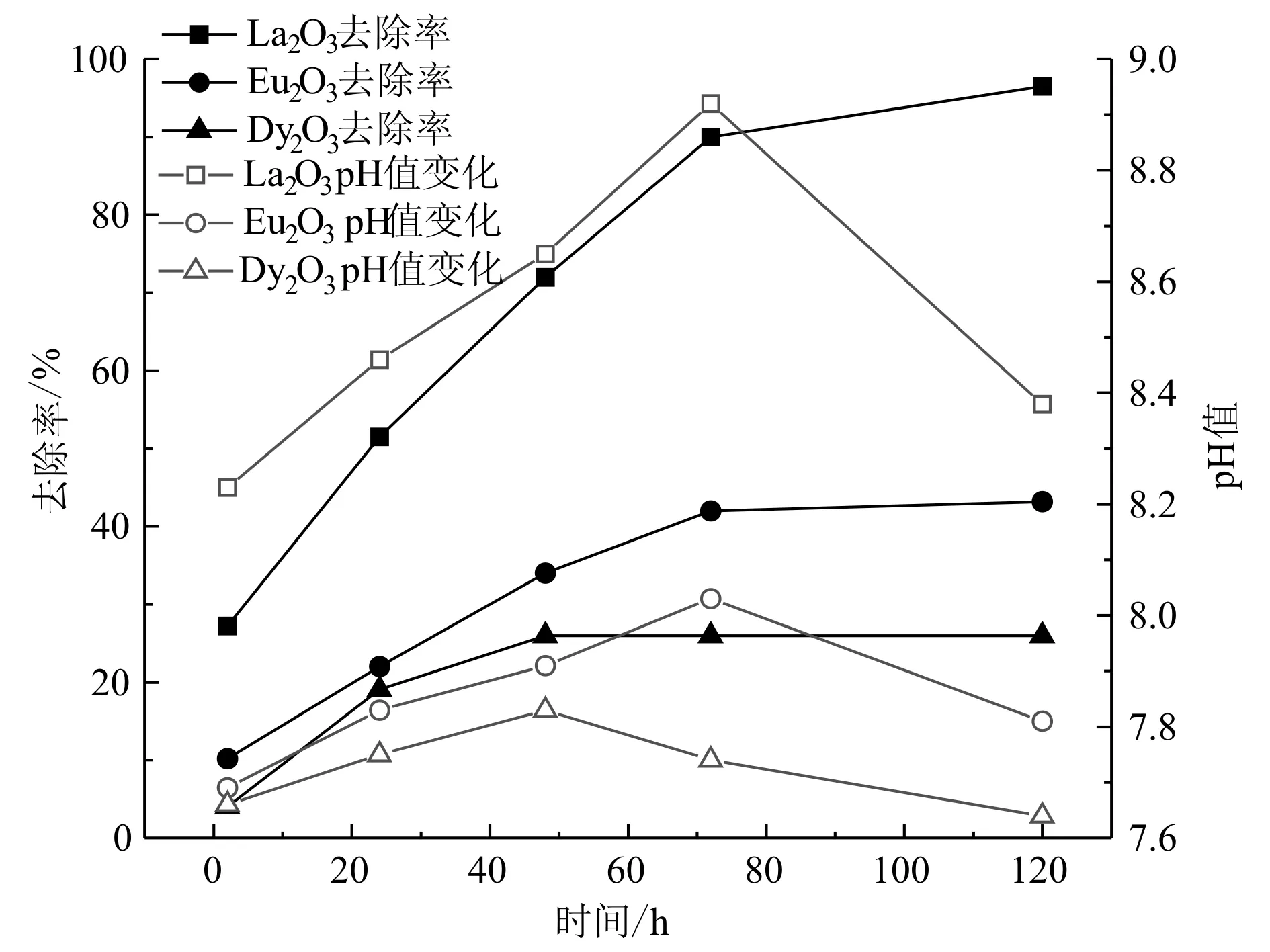
图 2 R为5∶1稀土氧化物体系除磷率和pH值随时间的变化Fig. 2 Changes in phosphorus removal rate and solution pH with time in the REE oxides system with R as 5∶1
2.2 稀土氧化物的磷酸根吸附等温线
利用Langmuir模型和Freundlich模型对稀土氧化物吸附磷酸根的吸附等温线进行拟合,结果表明稀土氧化物除磷更符合Langmuir模型(图3,图中Ce是平衡浓度, mg/L;Qe为吸附剂吸附平衡的能力, mg/g),说明吸附更接近化学吸附过程。根据此模型可求得Y2O3、La2O3、Nd2O3、Eu2O3和Dy2O3的最大吸磷容量每毫克分别为0.026、0.055、0.051、0.016和0.014。
为了进一步确定表面单层吸附的机制,本文还采用稀土氧化物与500×10-6高浓度磷酸盐溶液作用72 h后再与磷酸盐溶液作用,测定磷酸盐去除率,显示被高浓度磷酸盐处理过的稀土氧化物不再有去磷能力,进一步证明稀土氧化物吸附磷酸盐为表面单层吸附。
2.3 搅拌对实验结果的影响
实验发现,搅拌能够提升稀土氧化物的除磷效率,但对不同稀土氧化物的影响有所不同。去除率提升最多的体系是Eu2O3,提高了11%,Y2O3、La2O3、Nd2O3、Dy2O3等体系分别提高3.7%、7.1%、6.8%和5%(表2)。这说明在实际应用中可以不考虑水体的水动力条件。
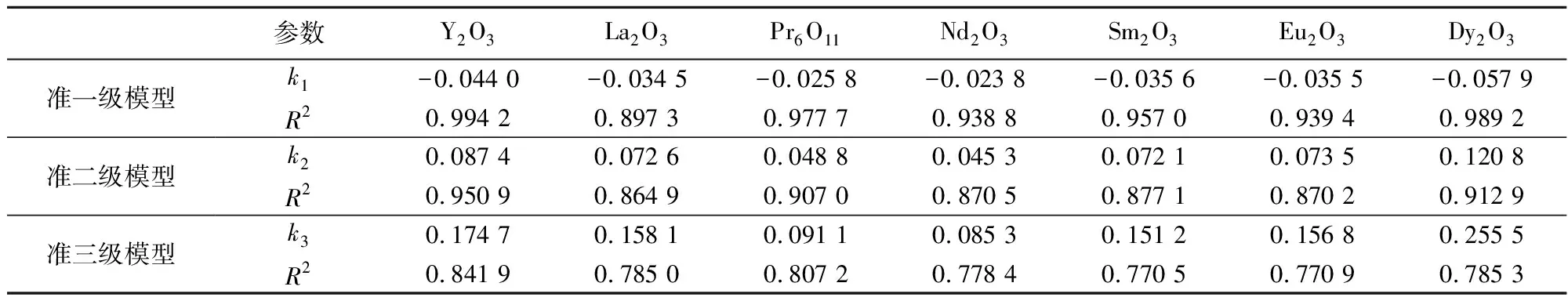
表 1 稀土氧化物除磷过程的动力学拟合结果Table 1 Chemical kinetic fitting of the phosphorus removal by using REE oxides
注: 温度20℃,其中k1、k2、k3分别是准一次动力学、准二次动力学、准三次动力学模型的降解速率参数,R为拟合度。
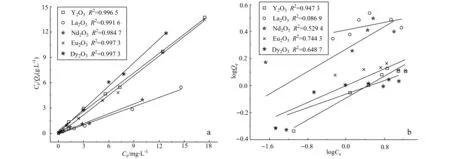
图 3 稀土氧化物的磷酸根吸附等温线的Langmuir模型(a)和Freundlich模型(b)拟合结果Fig. 3 Fitting results of phosphate ions adsorption isotherm on REE oxides by using Langmuir model (a) and Freundlich model (b)
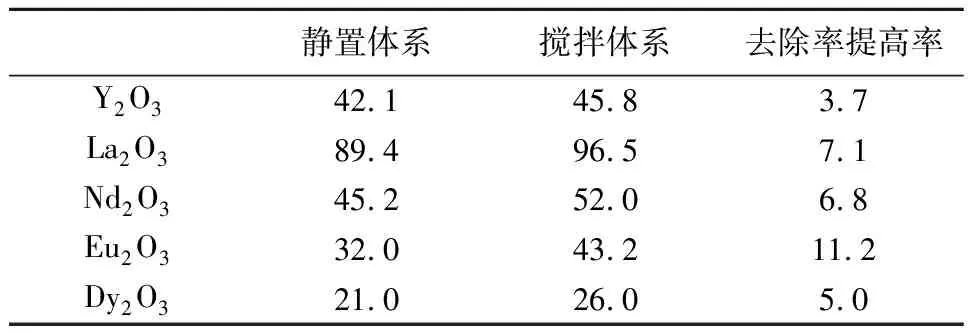
表 2 搅拌对稀土氧化物去除磷酸盐的影响 %Table 2 Effects on phosphorus removal of stirring in REE oxide systems
2.4 黏土负载氧化镧的除磷效果
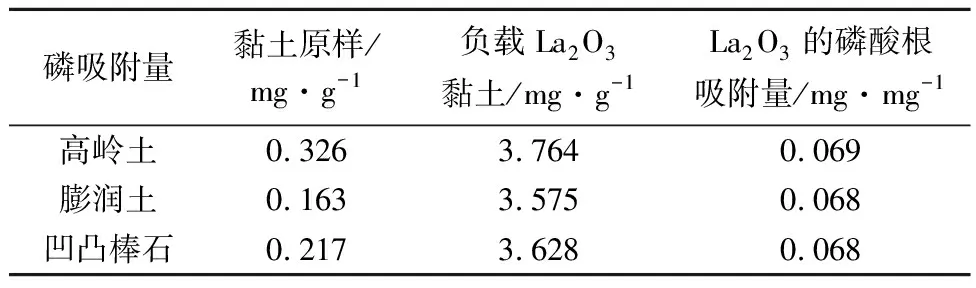
表 3 稀土氧化物负载黏土矿物的磷吸附量Table 3 Phosphate adsorption on La2O3 particles supported on clay minerals
利用扫描电镜背散射和能谱装置(其中背散射观察微形貌,能谱确定氧化镧成分)对比观察黏土原样和负载后的样品,整体上看,La2O3颗粒的负载没有改变黏土矿物的分散状况和表面形貌,说明负载主要为机械分散。同时发现La2O3颗粒能够均匀分布于黏土矿物表面,并倾向于吸附于黏土矿物颗粒的边缘位置(图4),这种分散状态可能有利于提升La2O3颗粒与溶液的接触面积,进而对稀土氧化物除磷有较好促进作用。

图 4 黏土矿物与La2O3负载后黏土矿物的扫描电镜照片(EBSD)Fig. 4 Scanning electron microscopic images of clay minerals and La2O3 particles supported on clay minerals
3 除磷机理初探
基于上述实验结果,稀土氧化物的除磷机制以表面化学吸附为主导。在作用过程中,溶液中的大部分磷酸根结合到稀土氧化物颗粒表面的活性位点上,形成稳定的化学吸附;同时有稀土氧化物表面的部分羟基被置换进入溶液,并导致溶液pH值上升。在此过程中,稀土氧化物可能发生微弱溶解,由于稀土磷酸盐极低的溶解度(饱和浓度仅为59.5×10-9),可能会有极少量离子态稀土元素与磷酸根结合产生沉淀;但是,鉴于表面吸附磷酸根的稀土氧化物的溶解作用会被显著抑制,所以本文认为稀土氧化物溶解导致的除磷作用应该可以忽略。赵雷洪等(1996)对稀土氧化物表面性质进行了研究,发现稀土氧化物表面存在两个固体碱中心,一个为弱碱中心,一个为强碱中心,实验结果表明碱度顺序为La2O3>Nd2O3>Y2O3>CeO2,这和本次实验结果稀土氧化物除磷效果相类似。
由于不同稀土氧化物的表面活性存在差异,从而导致其除磷能力不同,经对比显示氧化镧的除磷能力高于其他稀土氧化物,因此将氧化镧作为本次黏土改性剂。实验表明研磨机械分散到高岭土、膨润土、凹凸棒石的氧化镧比未负载的氧化镧除磷效果好,这是由于负载后稀土氧化物La2O3的颗粒团聚收到一定抑制,从而提高了与溶液反应的表面积,提升了除磷效率。
4 结论
比较了8种稀土氧化物(Y2O3、La2O3、CeO2、Pr6O11、Nd2O3、Sm2O3、Eu2O3和Dy2O3)对水体中磷酸盐的去除能力,显示La2O3除磷效果最好,解决了稀土氧化物改性材料去除磷时的稀土元素选择问题。实验研究表明稀土氧化物除磷过程更符合准一级动力学模型和Langmuir模型,据此提出稀土氧化物吸附磷酸盐以表面吸附为主。将稀土氧化物La2O3负载于黏土矿物后能够提高除磷能力,提高的效率与黏土矿物的类型无关,这与稀土氧化物能够附着于黏土矿物表面进而避免团聚作用有关。

