柑橘黄龙病菌亚洲种菌毛装配蛋白基因PAP序列分析、原核表达及抗血清制备
李宾宾 余乃通 杨毅


摘要 菌毛装配蛋白(Flp pilus assembly protein, PAP)是一种分泌蛋白,参与细菌菌毛的组装,表达量高。本研究以感染柑橘黄龙病的海南琼海市绿橙叶片为材料提取总DNA,用其菌毛装配蛋白基因(PAP)的特异引物进行PCR扩增,获得该基因的目的片段,序列分析表明海南琼海柑橘黄龙病菌PAP基因与柑橘黄龙病菌亚洲种 (GenBank登录号:CP001677.5) PAP基因序列一致。功能预测表明它含有两个与分泌功能相关的CpaC 和Secretin结构域。PCR产物通过EcoRⅤ和XhoⅠ双酶切构建重组载体pET32a-PAP。将pET32a-PAP载体转化BL21(DE3)大肠杆菌,经终浓度为1 mmoL/L IPTG诱导,目的蛋白主要以包涵体形式表达。目的蛋白经Ni2+-NTA层析柱纯化,并作为抗原腹腔免疫小白鼠,获得效价在1∶500~1∶1 000的多克隆抗血清。Western blot分析表明,PAP多克隆抗血清特异性强;以田间样品总蛋白做抗原时,能特异性检测染病样品。本研究为PAP蛋白功能研究和开发柑橘黄龙病菌的蛋白检测产品提供研究基础。
关键词 柑橘黄龙病; 基因表达; PAP蛋白; 抗血清制备
中图分类号: S 436.66 文献标识码: A DOI: 10.16688/j.zwbh.2018367
Abstract Flp pilus assembly protein (PAP) is a secreted protein involved in the assembly of bacterial pili with high-level expression. The total DNA was extracted from the HLB-infected green orange leaves collected from Qionghai city, Hainan province, China. The target fragment of PAP gene was obtained by PCR amplification with specific primers. Sequence analysis showed that the PAP gene is identical with the PAP gene of the Candidatus Liberibacter asiaticus (GenBank accession number: CP001677.5). Function prediction of PAP indicated that it contains two domains associated with secretory function, CpaC and Secretin. PCR products were digested by EcoRⅤ and XhoⅠ restriction enzyme and cloned into vector pET32a. The recombinant pET32a-PAP vector was transformed into Escherichia coli BL21(DE3) and PAP was expressed in the form of inclusion bodies under induction by 1 mmoL/L IPTG. The PAP fusion protein was purified by Ni2+-NTA column and used as an antigen. The mice were immunized intraperitoneally to obtain polyclonal antiserum and the titer was 1∶500-1∶1 000. Western blotting further analysis showed that PAP polyclonal antiserum was specific to PAP protein, which is applicable to field samples detection by ELISA. This study provides a research basis for the function study of PAP protein and the development of protein detection products for HLB.
Key words citrus Huanglongbing; gene expression; PAP protein; antiserum preparation
柑橘黃龙病citrus Huanglongbing (HLB)是柑橘类作物一种毁灭性病害,严重威胁着世界各地柑橘类作物的生产[1-2]。目前该病害已相继在亚洲、非洲、大洋洲和美洲的50多个国家和地区报道,给柑橘产业造成巨大的经济损失[1, 3]。中国19个柑橘主产区已有11个遭受到HLB危害[4]。近年来,随着海南绿橙等柑橘类产业的快速发展,柑橘黄龙病也随之而来并快速传播[5]。柑橘黄龙病的病原是一种专性寄生于植物韧皮部的革兰氏阴性菌,属韧皮部杆菌属Candidatus Liberibacter,主要由亚洲柑橘木虱Diaphorina citri和非洲柑橘木虱Trioza erytreae传播[6]。目前已报道的有3个种,即亚洲种Candidatus Liberibacter asiaticus、非洲种Candidatus Liberibacter africanus和美洲种Candidatus Liberibacter americanus[7]。
细菌分泌蛋白在其侵染宿主,引起宿主病变等方面起到重要作用[8-9]。革兰氏阴性菌含有8个不同类型 (typesⅠ~ typesⅧ) 的蛋白分泌系统[11],柑橘黄龙病菌含有完整的类型Ⅰ蛋白分泌系统和不完整的类型Ⅲ和类型Ⅳ蛋白分泌系统[12]。
前期,我们从感染HLB的海南绿橙中筛选出表达量较高的两个分泌蛋白,其中PAP蛋白(Flp pilus assembly protein)与菌毛组装有关[13]。本研究从感染HLB的海南绿橙中扩增出PAP蛋白基因,序列分析表明,PAP基因与柑橘黄龙病菌亚洲种(GenBank登录号:CP001677.5)的PAP基因序列一致[14]。对该蛋白进行原核表达及抗血清制备,得到了特异性强的PAP抗血清,工作效价在1∶500~1∶1 000之间。以田间样品总蛋白做抗原时,能特异性检测染病样品。本研究制备的PAP多抗血清为PAP蛋白的功能研究和开发柑橘黄龙病菌的蛋白检测产品提供重要基础。
1 材料与方法
1.1 材料
感染柑橘黄龙病的绿橙叶片采自海南省琼海市,-80℃保存;pET32a载体由本实验室保存;Escherichia coli BL21 (DE3)菌株购自北京全式金生物技术有限公司;EcoRⅤ和XhoⅠ购自大连宝生物公司;HSTM MIX购自东盛生物公司;植物基因组DNA提取试剂盒购自天根生化科技有限公司;BCIP/NBT底物显色试剂盒、氨苄青霉素(ampicillin)、isopropyl β-D-thiogalactoside (IPTG)、丙烯酰胺、N,N′-亚甲基双丙烯酰胺、三羟甲基氨基甲烷(tris)、植物蛋白提取试剂盒购自Solarbio公司;十二烷基硫酸钠(SDS)、甘氨酸、考马斯亮蓝R-250均购自海南爱斯科坦生物公司;PCR产物回收试剂盒购自Omega公司;碱性磷酸酯酶(AP)标记山羊抗小鼠IgG购自Biosharp生物公司;辣根过氧化物酶(HRP)标记山羊抗小鼠IgG购自碧云天生物技术公司;其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 引物设计
根据柑橘黄龙病菌PAP分泌蛋白基因(GenBank登录号:CP001677.5)编码区核苷酸序列和pET32a载体多克隆酶切位点设计一对特异性引物,PAP-F (5′-CCG GAT ATC TTG CAT CGT AAG CGC CAA AGA G-3′,下劃线为EcoRⅤ酶切位点)和PAP-R (5′-CCG CTC GAG TCC TGA CGG GAG GAG AGG AGG-3′,下划线为XhoⅠ酶切位点),由深圳华大基因股份有限公司(BGI)合成。
1.2.2 总DNA的提取及PAP基因的克隆
以感染HLB的绿橙叶片为材料,参照天根植物基因组DNA提取试剂盒操作说明书提取总DNA,用引物PAP-F和 PAP-R进行PCR扩增。PCR扩增体系为:DNA模板2 μL,正反引物各 2 μL(10 μmol/L),dNTPs 4 μL,5×Taq Buffer 10 μL,Taq DNA polymerase 1 μL,加ddH2O到50 μL。PCR程序为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min 40 s,共35个循环;72℃延伸10 min。取5 μL PCR产物于1%琼脂糖凝胶电泳检测。
1.2.3 pET32a-PAP表达载体的构建
利用Omega公司的胶回收试剂盒对PAP基因片段进行回收,将回收的PAP基因产物和pET32a载体同时进行EcoRⅤ和XhoⅠ双酶切,经T4 DNA连接酶将PAP基因连接到pET32a载体上,转化大肠杆菌DH 5α菌株,涂布于含50 μg/mL氨苄(Amp)的固体LB平板上,37℃培养箱过夜培养进行抗性筛选。挑取平板上的单克隆菌落,利用PAP-F和 PAP-R引物进行菌液PCR鉴定,随机选取3个片段大小正确的单克隆菌落送往赛默飞世尔科技(中国)有限公司进行双向测序。对测序正确的单克隆菌落提取重组载体,进行双酶切验证。将经过测序和双酶切验证的重组载体命名为pET32a-PAP。
1.2.4 PAP蛋白的诱导表达及可溶性分析
对测序正确的重组载体转化E. coli BL21 (DE3)菌株,挑取单克隆菌落接种到液体LB培养基(含100 μg/mL Amp),37℃于200 r/min培养过夜。以1∶50的比例将过夜培养的菌液接种到150 mL液体LB培养基中(含100 μg/mL Amp),37℃,200 r/min条件下培养,待菌液OD600达到0.6~1.0,加入IPTG使其终浓度为1 mmol/L,继续培养6 h。12 000 r/min离心5 min,沉淀溶于15 mL的1×PBS缓冲液中,超声波破碎20 min(连续循环工作4 s,停止8 s);12 000 r/min离心5 min,将沉淀溶于含8 mol/L尿素的15 mL Lysis buffer中,然后分别取上清和溶解的沉淀10 μL与等量体积的2×SDS loading buffer混合,100℃煮沸10 min,进行12% SDS-PAGE凝胶电泳(90 V, 2 h)。
1.2.5 融合蛋白的纯化
用含8 mol/L尿素的15 mL Lysis buffer溶解超声波破碎后的沉淀,8 000 r/min离心除去不溶性物质,上清过0.45 μm滤膜,然后通过Ni2+-NTA亲和层析柱进行纯化,经washing buffer溶液洗去杂蛋白后,用不同浓度的咪唑(50、100、150、200, 250 mmol/L)洗脱液进行洗脱,进行12% SDS-PAGE凝胶电泳检测。将纯化后的蛋白于-20℃保存。
1.2.6 抗血清的制备
取纯化后溶于150 mmol/L咪唑的PAP蛋白溶液20 μL与80 μL 1×PBS缓冲液混合,再与100 μL弗氏不完全佐剂混匀,腹腔免疫小白鼠1次;而后每隔7 d腹腔免疫小白鼠1次,共4次(使用弗氏完全佐剂)。最后1次免疫4 d后,对小白鼠进行眼球取血,室温放置30 min后,于4℃静置过夜。5 000 r/min 离心10 min,取上层血清,分装后于-80℃保存。同时,使用1×PBS缓冲液作为对照免疫小白鼠,即对照血清。
1.2.7 抗体效价检测及特异性检测
使用间接ELISA法测定PAP多抗血清的效价[15]。将获得PAP多抗血清分别按1∶500、1∶1 000、1∶5 000、1∶10 000、1∶50 000、1∶100 000的比例进行稀释。将纯化后的PAP蛋白(用包被液1∶1 000稀释)100 μL加入到96孔板中,37℃孵育2 h;1×PBST缓冲液洗涤3次,加入200 μL的1% BSA封闭液,37℃封闭2 h;重复洗涤3次,加入100 μL稀释后的血清,37℃孵育1 h;重复洗涤3次后加入100 μL HRP标记的羊抗小鼠IgG (1∶3 000),37℃孵育30 min;重复洗涤3次,随后加入100 μL TMB底物显色液,避光条件显色15 min,最后加入50 μL的浓盐酸终止反应,使用酶标仪测定OD450。
取纯化后溶于150 mmol/L咪唑的PAP蛋白溶液20 μL与等量体积的2×SDS loading buffer混合,100℃煮沸10 min变性,进行12%SDS-PAGE凝胶电泳。电泳结束后,将蛋白凝胶和硝酸纤维素膜(NC膜)预先用转膜液浸泡5 min,放入半干转膜仪中,电流1 A转膜25 min。转膜完成后用1×TBST缓冲液清洗NC膜3次;5%脱脂奶粉封闭液进行封闭2 h;1×TBST缓冲液清洗3次后置于PAP多抗血清(1∶1 000)孵育1 h;1×TBST缓冲液清洗3次,将其置于碱性磷酸酯酶(AP)标记山羊抗小鼠IgG稀释液(1∶2 000)孵育30 min;1×TBST缓冲液清洗3次,最后使用BCIP/NBT显色试剂盒显色,拍照保存。
采用Solarbio公司植物蛋白提取试剂盒提取感染HLB的绿橙和对照样品蛋白。将提取的蛋白稀释1 000倍(1∶1 000)和2 000倍(1∶2 000)作為抗原,以1∶1 000稀释的PAP多抗血清为一抗,按照上述方法,进行ELISA检测。
2 结果与分析
2.1 PAP基因的克隆及其序列分析
以感染HLB的绿橙总DNA为模板进行PCR扩增,得到大小为1 400 bp左右,与目的基因大小一致的DNA条带(图1a)。测序结果经NCBI BLASTn分析表明,该基因为柑橘黄龙病菌的PAP分泌蛋白基因,与Duan等[14]报道的柑橘黄龙病菌亚洲种(GenBank登录号:CP001677.5)的PAP基因序列一致,大小为1 425 bp,编码474个氨基酸,分子量大小为51.76 kD。
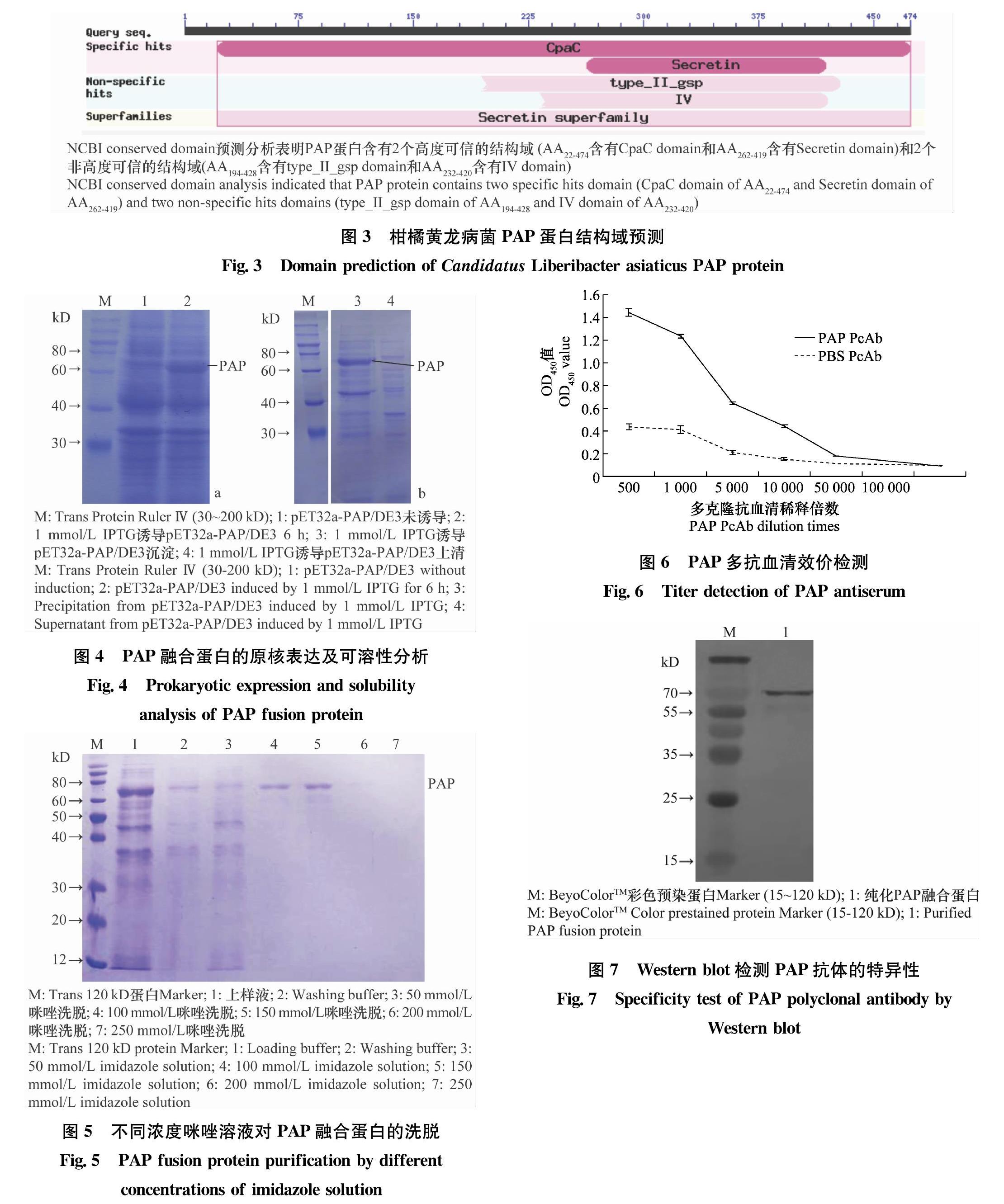
氨基酸比对分析表明,本研究获得的PAP蛋白与柑橘黄龙病菌亚洲种的PAP蛋白同源性在99.5%~100%;与番茄、辣椒和胡萝卜等分离的黄龙病新种(Candidatus Liberibacter solanacearum)的PAP蛋白同源性在68.4%~70.1%;与柑橘黄龙病菌非洲种的PAP蛋白同源性在66.6%;与柑橘黄龙病菌美洲种的PAP蛋白同源性在45.8%~46.8%(图2)。NCBI保守结构域(NCBI conserved domain)预测分析表明,本研究获得的PAP蛋白含有2个高度可信的与分泌功能相关的结构域,即CpaC结构域(AA22-474)和Secretin结构域(AA262-419);另外,该蛋白还预测含有2个可能结构域(可信度不高,有待进一步确认),即type_II_gsp结构域(AA194-428)和IV结构域(AA232-420)(图3)。
2.2 原核表达载体的构建
测序结果表明,3个单克隆菌中的PAP基因插入片段大小正确,碱基无缺失、突变发生,且编码框无移位。双酶切验证如图1b所示,特异性获得酶切后的PAP基因和pET32a载体片段。将经过测序和双酶切验证的重组载体命名为pET32a-PAP,作为后续原核表达的重组质粒。
2.3 PAP蛋白的原核表达及可溶性分析
将pET32a-PAP重组载体转化BL21 (DE3)表达菌,挑取转化平板上的单克隆菌落接种到含氨苄的LB液体培养基进行诱导表达,分离上清和沉淀进行可溶性分析。12% SDS-PAGE凝胶电泳表明,与未诱导的重组菌相比,经1 mmol/L IPTG诱导6 h后的重组菌在分子量大小约70 kD处,出现一条清晰的蛋白条带(图4a),与预测的PAP融合蛋白70.73 kD大小基本一致,即PAP融合蛋白。可溶性分析结果表明,PAP目的蛋白主要以沉淀形式(包涵体)表达(图4b)。
2.4 融合蛋白纯化
由于PAP融合蛋白含有His标签,可经过Ni2+-NTA亲和层析柱纯化。将含有PAP融合蛋白的包涵体沉淀溶解,用不同咪唑浓度的洗脱液洗脱纯化,最后用SDS×PAGE分析该蛋白在不同咪唑浓度洗脱液中的分布情况。结果如图5所示,经50 mmol/L咪唑的洗脱液洗脱后,Ni2+-NTA亲和层析柱上的杂蛋白可除去大部分;再经100 mmol/L和150 mmol/L咪唑的洗脱液洗脱后,大部分PAP融合蛋白从Ni2+-NTA亲和层析柱中洗脱下来,而在200 mmol/L和250 mmol/L咪唑的洗脱液中分布很少。由此可见,经不同咪唑浓度的洗脱液洗脱后,PAP融合蛋白主要分布在100 mmol/L和150 mmol/L咪唑的洗脱液中,且在150 mmol/L咪唑的洗脱液中浓度更高,于-20℃保存,备用。
2.5 PAP多抗血清效价及特异性
以纯化后的PAP融合蛋白(1∶1 000稀释)为抗原,对不同PAP多抗血清进行稀释,通过ELISA方法对PAP多抗血清进行效价测定。结果(图6)表明,与对照血清相比,PAP多抗血清在稀释500倍和1 000倍时,PAP多抗血清呈明显的阳性反应(判断标准为PAP PcAb的OD450/PBS PcAb的OD450 >2.1);而PAP多抗血清在稀释5 000倍以上均无阳性反应。Western blot结果分析表明,PAP多抗血清能与纯化后的融合蛋白起特异性反应,无其他明显杂带(图7)。田间样品ELISA检测结果显示,PAP多抗血清能特异性区分染病绿橙和对照样品(表1)。
3 讨论
前期,Li等通过PCR,qPCR和RT-qPCR的方法从感染HLB的海南绿橙样品中筛选出2个表达量高的柑橘黄龙病菌分泌蛋白,408和PAP。这两个蛋白均参与菌毛的组装[13]。将PAP蛋白基因构建到GV1300植物双向表达载体,通过农杆菌注射烟草进行瞬时表达,共聚焦显微镜观察表明,在烟草保卫细胞的微纤维丝观察到绿色荧光,说明PAP蛋白可能与调控保卫细胞的宿主蛋白相互作用,帮助病原菌穿过保卫细胞以达到入侵植株的目的。但是,柑橘黄龙病菌具体的侵染过程和机理有待进一步研究。
目前,柑橘黄龙病的有效检测方法包括PCR[16]、环介导等温扩增技术(LAMP)[17]、荧光定量PCR[18]、重组酶聚合酶扩增方法(RPA)[19]等诊断技术。虽然柑橘黄龙病菌相关蛋白基因的单克隆和多克隆制备已有报道[12, 20-22],但是目前尚无商业化的蛋白检测产品。PAP蛋白是柑橘黄龙病菌的分泌蛋白,是菌毛蛋白的重要组成成分,它的含量是病菌含量的几千甚至是几万倍以上。本研究使用该蛋白进行抗体制备,不但丰富了制备HLB蛋白检测产品的选择,同时使用该蛋白制备的单克隆抗体或多克隆抗体产品具有更高的效价和灵敏度。
柑橘黄龙病病菌根据病原的传播媒介、序列特征和热敏性等可分为亚洲种、非洲种和美洲种。根据PAP蛋白基因的序列分析,感染海南绿橙的柑橘黄龙病菌为亚洲种,与我国其他地区柑橘类作物上报道的柑橘黄龙病菌属于一个种。因此,使用本研究制备的抗体不但能用于海南绿橙黄龙病的检测,也可用于我国其他柑橘类黄龙病的检测。
参考文献
[1] ARREDONDO V R,DELGADO ORTIZ J C,BELTRN B M,et al.A review of techniques for detecting Huanglongbing (greening) in citrus[J].Canadian Journal of Microbiology,2016,62(10):803-811.
[2] CEVALLOS-CEVALLOS J M,FUTCH D B,SHILTS T,et al.GC-MS metabolomic differentiation of selected citrus varieties with different sensitivity to citrus Huanglongbing[J].Plant Physiology and Biochemistry,2012,53(4):69-76.
[3] DA G J,DOUHAN G W,HALBERT S E,et al.Huanglongbing:An overview of a complex pathosystem ravaging the worlds citrus [J].Journal of Integrative Plant Biology,2016,58(4):373-387.
[4] 譚锦.中国柑橘黄龙病病原菌原噬菌体遗传多样性研究[D].重庆:西南大学,2013.
[5] WU Xuhui,MENG Chunliang,WANG Guihua,et al.Rapid and quantitative detection of citrus Huanglongbing bacterium ‘Candidatus,Liberibacter asiaticus by real-time fluorescent loop-mediated isothermal amplification assay in China [J].Physiological & Molecular Plant Pathology,2016,94:1-7.
[6] GOTTWALD T R,GRAA J V D,BASSANEZI R B.Citrus Huanglongbing:the pathogen and its impact [J].Plant Health Progress,2007:0906-01.
[7] BOV J M.Huanglongbing:a destructive,newly-emerging,century-old disease of citrus [J].Journal of Plant Pathology,2006,88(1):7-37.
[8] ABBY S S,CURY J,GUGLIELMINI J,et al.Identification of protein secretion systems in bacterial genomes [J/OL].Scientific Reports,2016,6:1-21.
[9] GUGLIELMINI J,NRON B,ABBY S S,et al.Key components of the eight classes of type IV secretion systems involved in bacterial conjugation or protein secretion [J].Nucleic Acids Research,2014,42(9):5715-5727.
[10] CLARK K,FRANCO J Y,SCHWIZER S,et al.An effector from the Huanglongbing-associated pathogen targets citrus proteases [J].Nature Communications,2018,9(1):1718.
[11] COSTA T R,FELISBERTO-RODRIGUES C,MEIR A,et al.Secretion systems in gram-negative bacteria:structural and mechanistic insights [J].Nature Reviews Microbiology,2015,13(6):343-359.
[12] 侯衛真.柑橘黄龙病Serralysin蛋白的表达纯化及两种重要病原的分子检测[D].武汉:华中农业大学,2014.
[13] 李宾宾,杨毅,刘志昕,等.柑橘黄龙病菌(Candidatus Liberibacter asiaticus)分泌蛋白基因DNA含量及其RNA表达量关系分析[C]∥中国植物病理学会2018年学术年会论文集.2018.
[14] DUAN Yongping,ZHOU Lijuan,HALL D G,et al.Complete genome sequence of citrus Huanglongbing bacterium,‘Candidatus Liberibacter asiaticus obtained through metagenomics [J].Molecular Plant-Microbe Interactions,2009,22(8):1011-1020.
[15] 余乃通,冯团诚,王健华,等.香蕉束顶病毒海口分离物Rep基因的克隆、原核表达、抗血清制备及检测[J].植物保护,2011,37(4):38-43.
[16] LI Wenbin,HARTUNG J S,LEVY L.Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species associated with citrus Huanglongbing [J].Journal of Microbiological Methods,2006,66(1):104-115.
[17] OKUDA M,MATSUMOTO M,TANAKA Y,et al.Characterization of the tufB-secE-nusG-rplKAJL-rpoB gene cluster of the citrus greening organism and detection by loop-mediated isothermal amplification [J].Plant Disease,2007,89(7):705-711.
[18] ARRATIA-CASTRO A A,SANTOS-CERVANTES M E,ARCE-LEALP,et al.Detection and quantification of ‘Candidatus Phytoplasma asteris and ‘Candidatus Liberibacter asiaticus at early and late stages of Huanglongbing disease development[J].Canadian Journal of Plant Pathology,2016:38(4):411-421.
[19] QIAN Wenjuan,LU Ying,MENG Youqing,et al.Field detection of citrus Huanglongbing associated with ‘Candidatus Liberibacter asiaticus by recombinese polymerase amplification within 15 min [J].Journal of Agricultural and Food Chemistry,2018,66(22):5473-5480.
[20] 高玉霞.柑橘黄龙病PCR检测引物比较及其外膜蛋白抗体的研制[D].赣州:赣南师范学院,2015.
[21] YUAN Qing,JORDAN R,BRLANSKY R H,et al.Development of single chain variable fragment (scFv) antibodies against surface proteins of ‘ Ca.Liberibacter asiaticus[J].Journal of Microbiological Methods,2016,122:1-7.
[22] LIU Huawei,ATTA S,HARTUNG J S.Characterization and purification of proteins suitable for the production of antibodies against ‘Ca.Liberibacter asiaticus[J].Protein Expression & Purification,2017,139(5):36-42.
(责任编辑: 杨明丽)

