生长激素释放肽-6对心力衰竭模型大鼠心功能的影响
王聖茜 苏亚楠 邢宇彤 白雪 王一博 方秋月 谭洪建 陈立强
(佳木斯大学 1基础医学院,黑龙江 佳木斯 154007;2附属第一医院)
随着人口老龄化的加剧,心力衰竭(HF)的患病率呈上升趋势。HF是由心脏结构和(或)功能性异常所引起的一组复杂临床综合征〔1〕。HF时由于心脏的损害或超负荷而导致的心脏工作效率降低,直接的表现就是心脏收缩和(或)舒张功能发生障碍。合成的生长激素释放肽(GHRPs)通过生长激素促分泌素受体(GHSR)1a和非GHSR受体CD36结合而具有心脏保护作用〔2〕。GHRPs对心脏保护作用的研究多集中在其对心肌细胞保护的作用机制,而在其对HF时的心功能影响方面的研究相对较少,本实验旨在探究GHRP-6对HF模型大鼠心功能的保护作用。
1 材料和方法
1.1实验动物和分组 清洁级SD大鼠140只,体重(188.2±21.9)g,2~3月龄,哈尔滨医科大学实验动物中心提供,常规饲养。随机分4组,正常对照组(A组)、假手术组(B组)、模型组(C组)和GHRP-6治疗组(D组),每组30只。
1.2主要药物和试剂 GHRP-6,大连美仑生物技术有限公司;DP-4800全数字便携超声诊断系统,迈瑞生物医疗电子股份有限公司;BL-420F生物机能实验系统,成都泰盟科技有限公司。
1.3造模与用药 B组:左冠状动脉前降支穿线,不结扎;C组和D组:结扎大鼠左冠状动脉前降支制备HF模型。造模4 w后,D组尾静脉注射GHRP-6溶液,剂量为100 μg/(kg·d),其余组动物尾静脉注射同等剂量生理盐水,连续注射4 w。
1.4动物心电检测 各组动物麻醉后,仰卧位至于解剖台上,固定四肢,使用无菌电极分别刺入右前肢和左、右后肢的皮下,将BL-420F生物机能实验系统的单导联心电信号线分别连接无菌电极,测量并记录单通道标准肢体导联Ⅱ的心电图形。
1.5动物心脏超声检测 各组动物麻醉后,仰卧位至于解剖台上,固定四肢,超声机选择“M+B”模式,采用胸骨旁左室长轴切面体位图,将探头置于胸骨左缘第三、四肋间,将M型取样线移至二尖瓣腱索水平,观察到清晰的心室波群后冻结图像,测量左室舒张末期内径(LVEDD)和左室收缩末期内径(LVESD),采用Teichholz校正公式计算出左室舒张末期容量(LVEDV)和左室收缩末期容量(LVESV),并计算左室射血分数(LVEF)值。每只动物测量3组图像,每次间隔5 min。
1.6统计学方法 采用Graph prism7.0进行单因素方差分析、Tukey检验。
2 结 果
2.1HF动物模型手术前后心电图 术前正常大鼠心电呈窦性心律,律整,无异常波形。左冠状动脉前降支结扎术后5 min心电图显示:ST段显著抬高,T波增宽而高耸,幅度>0.2 mV,表示急性心肌梗死发生,手术成功。见图1。
2.2术后8 w各组大鼠心电图检测结果 A组、B组心电图无异常。C组心电图R-R间期不齐,P-R间期延长,ST段下斜型压低,T波倒置,电压>0.1 mV。D组心律较C组整齐,P-R间期延长,ST段压低水平较C组轻,T波倒置,电压<0.1 mV。见图2。
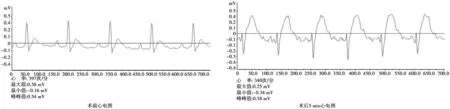
图1 HF动物模型术前、术后心电图
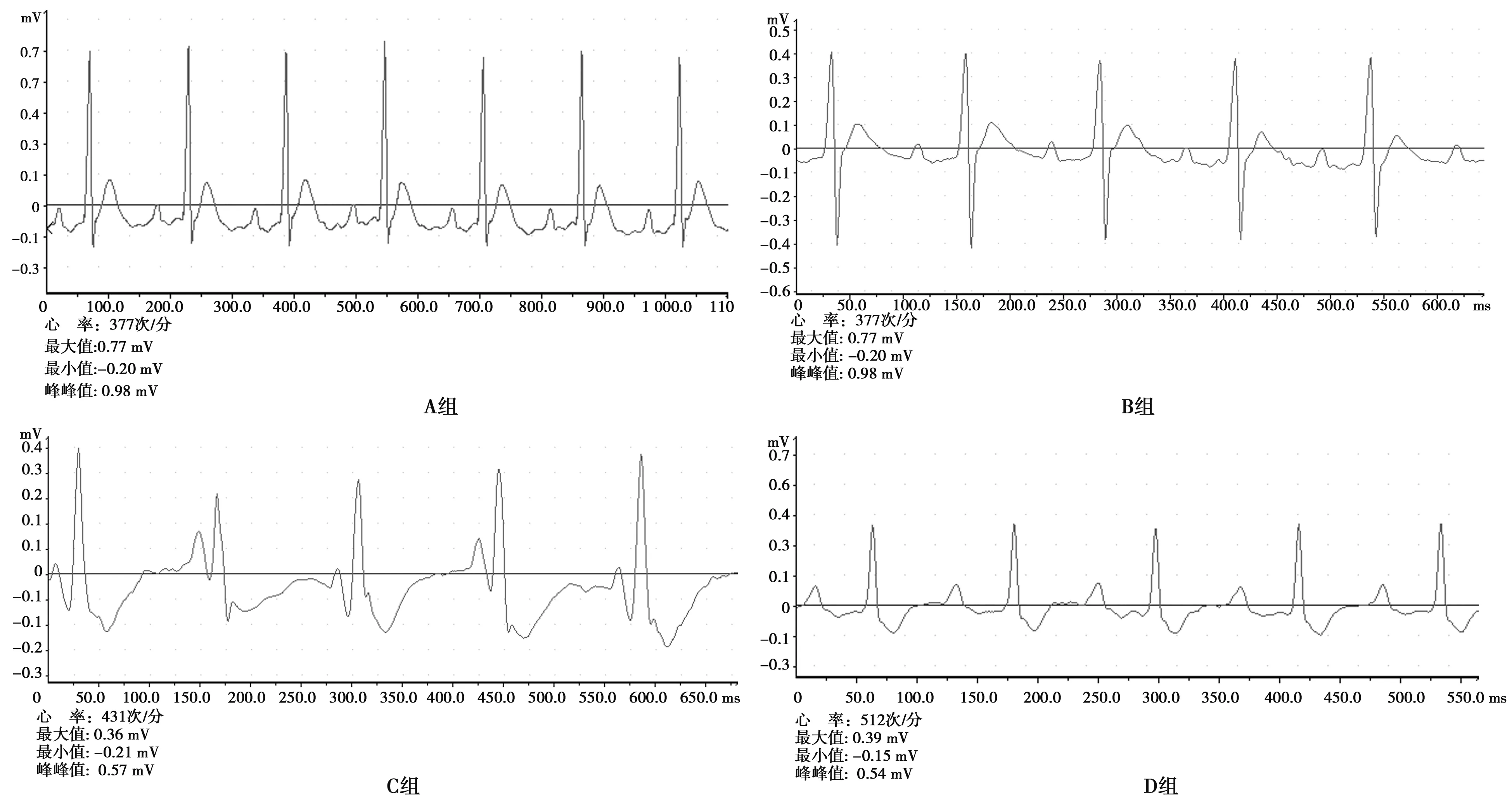
图2 术后8 w各组大鼠心电图
2.3术后8 w超声检测结果 M型超声心动图可见C组和D组大鼠8 w末时左心室扩大明显,左心室前壁活动曲线峰值降低,室壁运动波形减弱;LVEDD、LVESD、LVEDV、LVESV均明显高于A组和B组(P<0.05),而LVEF明显降低(P<0.05)。D组较C组的LVEDD、LVESD、LVEDV、LVESV均有显著降低(P<0.05),LVEF均值>50%,有明显的升高(P<0.05),有统计学意义。见图3、表1。
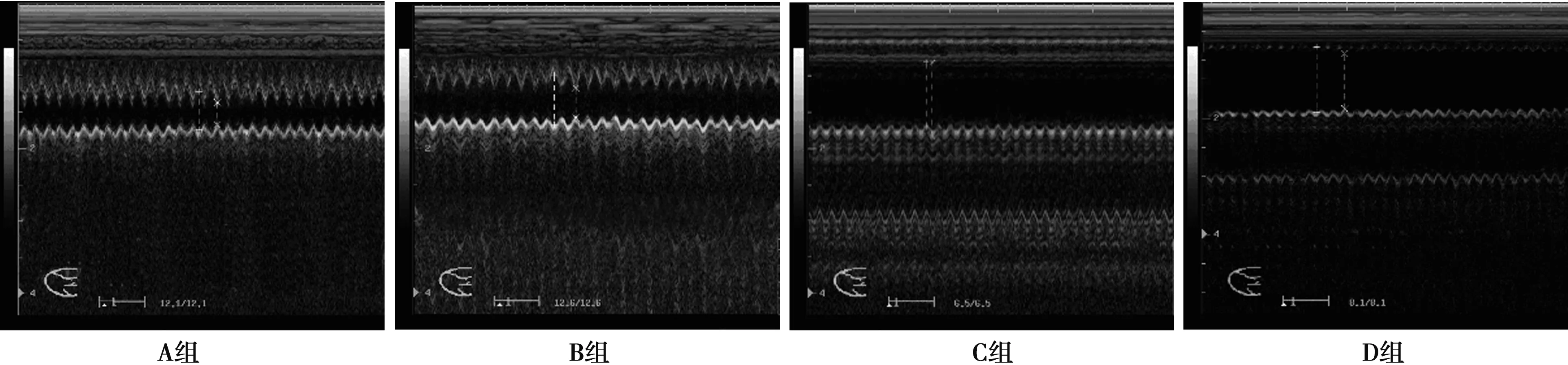
图3 各组大鼠8 w后M模式超声心功能检测

组别LVEDD(mm)LVESD(mm)LVEDV(mm3)LVESV(mm3)LVEF(%)A组6.53±0.432.79±0.27227.36±34.5839.56±7.8886.07±4.14B组6.55±0.392.81±0.27230.64±32.6938.83±7.7386.22±4.37C组9.74±0.781)7.61±0.631)498.51±98.551)323.21±58.911)36.52±7.111)D组8.41±0.631)2)6.07±0.521)2)381.03±67.171)2)183.36±37.191)2)51.25±5.271)2)
与A组及B组比较:1)P<0.05;与C组比较:2)P<0.05
3 讨 论
心肌梗死后因冠状动脉供血不足导致心肌缺血性坏死而引起HF〔3〕,基于此,采用左冠状动脉闭塞诱发梗死后的HF动物模型被广泛应用。该方法制备的大鼠模型在整个HF的过程中病理生理表现与人类的近似,可以准确反映人类在心肌梗死后并发HF的急性期和代偿期的病理生理特征。因此,采用冠状动脉左前降支结扎法制备HF动物模型,术后及术后8 w的心电和超声的检测结果,均表明大鼠HF模型制备成功。
由于左心室前壁的缺血性坏死,导致左室泵血功能下降,心输出量减少,心脏启动一系列代偿反应。如HF病因不能及时去除,心脏代偿反应会长期坚持下去,心脏功能逐步减弱,前后负荷增大,心肌耗氧量剧增,缺血缺氧造成心肌细胞死亡和心肌细胞凋亡,心肌重构,细胞因子合成分泌增加等,最终导致HF。
左心室收缩前、后的容量负荷和心室射血分数是反映左心室收缩功能重要指标。超声心动图是确诊HF最有用,最广泛可用的检查方法。它提供关于腔室容积、心室收缩和舒张功能、室壁厚度和瓣膜功能等即时信息,对于评估左心室功能至关重要〔4〕。本实验在术后8 w末模型组大鼠使用超声心动图进行了心脏功能检测,显示左心室收缩和舒张末期容量增加,输出量明显降低,LVEF<40%,具有明显的HF特征。
GHRPs是一组合成生长激素释放肽,主要包括GHRP-1、GHRP-6,GHRP-2和hexarelin,自20世纪80年代被合成以来,诸多学者对其作用机制进行的广泛的研究,在心肌细胞的保护作用方面的研究也越来越受到重视。GHRPs可以与在心脏和血管中分布的生长激素促分泌素受体(GHSR)结合并激活,直接作用于心血管。非GHSR CD36也已被证明是GHRPs的特异性心脏受体并介导其心脏保护作用〔5〕。GHRPs可以通过调控电压门控钙通道,增加Ca2+内流,触发细胞内的Ca2+释放,产生正性肌力作用。同时GHRPs通过调控磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)、丝裂原活化蛋白激酶(MAPK)等信号转导通路,减少心肌细胞的凋亡、降低炎症反应,增加抗氧化防御和能量合成代谢能力、抵抗纤维化细胞因子等方式保护心肌细胞〔2〕,防止心肌细胞损伤,从而改善HF时心脏的功能,增加心肌收缩力〔6〕。GHRPs还可减轻HF大鼠神经-体液相关的激素激活,能显著降低儿茶酚胺、肾素、血管紧张素(ANG)Ⅱ 、醛固酮和内皮素-1的循环水平,从而改善心脏功能。
本实验采用GHRP-6干预心肌梗死4 w后的模型大鼠,超声心动图检测心脏发现经过干预的模型大鼠LVEDV和LVESV增加明显低于模型组,LVEF>50%,心脏功能恶化程度较轻。由此,推测GHRP-6可能通过上述机制延缓HF大鼠的心脏功能的恶化进度,具有一定的心脏保护作用。
Ghrelin是一种肠肽类激素,是一种内源性的生长激素释放肽,GHRP-6 与Ghrelin作用于相同的受体1a型促生长激素释放受体(GHS-R1a),在心脏的作用相似,因此GHRP-6 可作为Ghrelin的类似物。研究显示〔7〕,Ghrelin可增加心肌缺血/再灌注损伤的小鼠心输出量,改善收缩期的心脏指数。同时发现白细胞介素(IL)-6和肿瘤坏死因子(TNF)-α促炎细胞因子的循环水平降低,乙酰辅酶A羧化酶活性被抑制,凋亡蛋白水平降低。该结果与本实验结果近似,亦可作为GHRP-6 在心功能保护作用方面的一个旁证。
本实验采用二维超声心动图来评价左心室功能,以LVEF作为左心室收缩功能的主要衡量标准,此方法在诊断HF和评估心功能方面是首选方法〔4〕,但由于二维超声的对心室体积测量依赖于室腔平面长度的几何计算,LVEF也是间接计算的体积衍生指数〔8〕,所以本实验依然存在着一定的局限性,对于GHRP-6在改善HF时心功能的研究仍需进行更深层次、多角度的实验。
致谢:黑龙江省北药与功能食品优势特色学科建设项目为本实验提供资助,特此致谢。

