中耳炎小鼠模型的听力学特点
肖聪聪 李博 郑体花 郑庆印
(烟台滨州医学院,山东 烟台 264000)
中耳炎的病程迁延,可引起注意力、认知感及听力下降,从而影响生活质量,严重者可以并发颅内外并发症而危及生命〔1~3〕。中耳炎是导致听力下降的主要原因,及时对其诊断及治疗有着重要意义。中耳炎小鼠模型的建立对中耳炎易感基因的识别处理及药物开发尤为重要,但是关于中耳炎小鼠模型的听觉特点尚不清楚,因此对中耳炎小鼠模型的听力损失程度及性质进行评估尤为重要。听性脑干反应(ABR)测试是听功能研究的重要指标和手段,具有客观、易操作且能够反映病变的部位及通路,已广泛应用于动物模型的听力评估。本研究通过对C57小鼠,Toll样受体(TLR)2-/-小鼠的中耳炎模型进行ABR测试,观察两种小鼠在不同刺激声下的ABR的反应阈和潜伏期,为中耳炎小鼠模型的听觉研究提供参考。
1 材料与方法
1.1实验动物及分组 C57小鼠、TLR2-/-小鼠各20只(南京大学模式动物研所提供)(20耳,均选择左耳测试),均为雌性,听力正常,7周龄,体重18~28 g。分为4组,中耳炎造模前C57小鼠一组(20只)作为对照组,中耳炎造模后C57小鼠一组(20只)作为实验组,中耳炎造模前TLR2-/-小鼠一组(20只)作为对照组,中耳炎造模后TLR2-/-小鼠一组(20只)作为实验组,即两种品系小鼠造模前两组对照组各20只,造模后两组实验组各20只。
1.2中耳炎动物模型的建立 两对照组均正常饲养,其余两实验组均在麻醉状态下向左耳中耳腔鼓室注射链球菌肽聚糖多糖(PGPS)(浓度为6 μg/μl,每只注射10 μl,美国BD公司),3 d后使用内镜观察中耳鼓室情况。
1.3ABR检测 分别对两种品系小鼠的对照组和实验组腹腔注射麻醉,记电极置颅顶,参考电极插入小鼠左耳与嘴角之间,接地电极插入右耳旁与左耳对称。电极之间阻抗小于3 kΩ。开放声场中扬声器(TDT MFI-1250)放置于距外耳道口1 cm的地方,避免耳机接触耳廓〔4〕。
采用美国TDT公司TDTⅢ设备和BioSigRP系统软件给声并采集信号〔5〕。刺激声分别为校准好的click声、tone burst(TB)声(8、16、32 kHz),强度为0~90 dB SPL,衰减间隔为10 dB,接近阈值时以5 dB减低以获得最低听阈值,带通滤波100~3 000 Hz,重复率11次/s,观察窗为10 ms,叠加1 024次记录所有波形图及各刺激声下的阈值,根据阈值最有统计学意义的刺激声条件下来判断潜伏期。
1.4统计学分析 实用GraphPad Prism7统计软件进行单因素方差分析。
2 结 果
2.14组小鼠内镜图像 如图1所示,麻醉状态下,TLR2-/-小鼠实验组耳内镜发现中耳有渗出液,得到这种图像的小鼠16只,TLR2-/-小鼠对照组使用耳内镜观察无异常现象。C57小鼠实验组发现耳内镜中耳有渗出液的11只,C57小鼠对照组使用耳内镜观察也无异常现象。
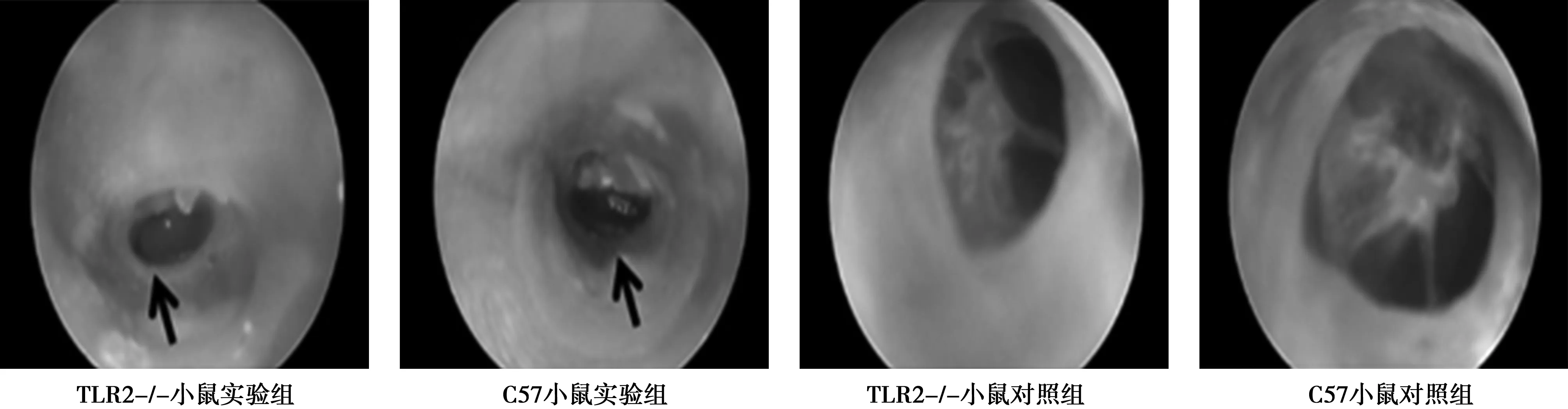
图1 4组内镜图像
2.24组小鼠ABR反应阈 由表1可见,不同刺激声下,TLR2-/-中耳炎模型小鼠和C57中耳炎模型小鼠的ABR反应阈均明显高于其对照组,C57中耳炎模型小鼠的ABR反应阈在click声和短纯音8、16 kHz有统计学意义(P<0.05),且对click声最为敏感(P<0.01),TLR2-/-中耳炎模型小鼠的ABR反应阈在click声和短纯音8、32 kHz差异有统计学意义(P<0.05),同样对click声刺激最为敏感(P<0.01)。由表2可见,比较两种中耳炎模型小鼠的实验组发现,TLR2-/-中耳炎模型小鼠的ABR反应阈高于C57中耳炎模型小鼠,在click声和短纯音8 kHz刺激声下的ABR反应阈差异有统计学意义(P<0.01),且在click声刺激下更有比较意义(P<0.001)。
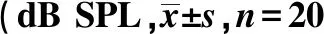
表1 4组不同刺激声下的ABR反应阈耳)
与同鼠种对照组比较:1)P<0.05,2)P<0.01;表3同
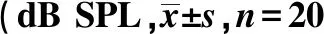
表2 TLR2-/-中耳炎模型和C57中耳炎模型的ABR反应阈耳)
与C57小鼠实验组比较:1)P<0.01,2)P<0.001
2.34组小鼠click声下的ABR各波潜伏期 如表3所示,TLR2-/-小鼠实验组和C57小鼠实验组的Ⅰ波,Ⅱ波和Ⅳ波潜伏期均较其对照组延长,C57小鼠Ⅰ波和Ⅱ波潜伏期较其对照组延长更明显,差异均有统计学意义(P<0.05)。如图2所示,为麻醉状态下小鼠在click声刺激下的ABR波形图,量取4组小鼠在80 dB SPL强度下Ⅰ波,Ⅱ波和Ⅳ波的潜伏期。
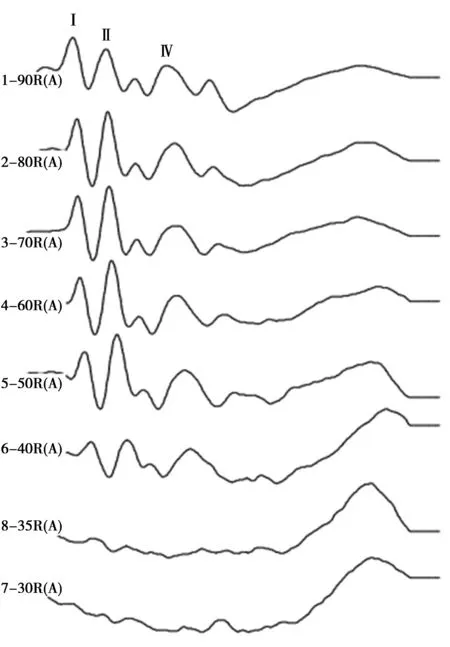
图2 click声刺激下ABR各波形
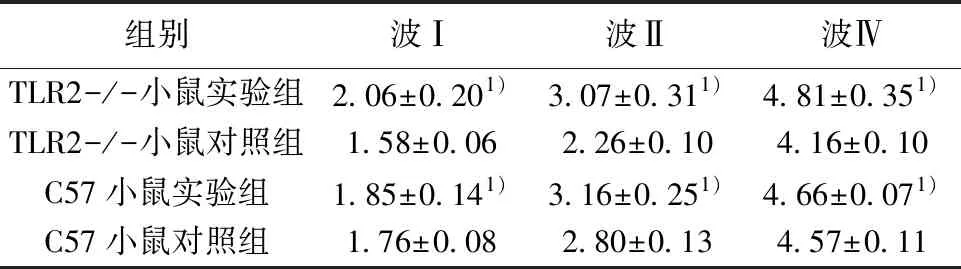
组别波Ⅰ波Ⅱ波ⅣTLR2-/-小鼠实验组2.06±0.201)3.07±0.311)4.81±0.351)TLR2-/-小鼠对照组1.58±0.062.26±0.104.16±0.10C57小鼠实验组1.85±0.141)3.16±0.251)4.66±0.071)C57小鼠对照组1.76±0.082.80±0.134.57±0.11
3 讨 论
本研究显示向TLR2-/-小鼠和C57小鼠鼓室注射PGPS可以成功诱导中耳炎,内镜图像显示中耳有渗出液,说明中耳炎小鼠模型造模成功。两种品系小鼠诱导后的中耳炎组ABR反应阈均高于对照组,且都在低频刺激click声差异最明显,这与临床中耳炎的ABR听力特点相符,低频刺激下ABR阈值升高。这可能是由于中耳炎发生时分泌积液,黏稠的分泌物使声音阻抗力增加,传导力减弱,造成阈值升高。有趣的是,与C57中耳炎模型小鼠对比,TLR2-/-中耳炎模型小鼠的ABR反应阈更高,听力损失程度更严重。TLR2-/-小鼠是在C57小鼠的基础上敲除TLR2基因的小鼠,说明TLR2基因缺陷的小鼠患中耳炎后听力下降较正常小鼠更严重。这与上面提到的TLR2因子的缺失可能对听力水平的降低造成影响有关。
TLRs是先天性免疫系统中的细胞跨膜受体及病原模式识别受体之一,在急性炎症反应细胞吞噬作用的调节和细胞信号转导及细胞凋亡中起重要作用〔6~8〕。TLR2是已经克隆的TLR家族中表达范围最广,识别病原微生物种类最多的成员〔9〕。它可单独或协同其他Toll样受体家族成员完成对病原体相关分子模式的识别,触发机体对致病微生物的级联免疫应答,尤其是针对细胞毒素的抗炎症反应具有重要的作用,已经成为多种疾病治疗的新靶点〔10,11〕。TLR2作为Ⅰ型跨膜转运蛋白,在免疫炎症反应过程中起着至关重要的作用。最近的一项研究表明,在人类中耳炎患者的中耳黏膜组织中TLR2表达水平明显降低〔12~14〕,TLR2信号可能在中耳炎感染中起着关键调控作用。TLR2信号转导通路主要分为 2 条途径:依赖髓样分化因子(MyD)88途径和非依赖MyD88途径(也称为依赖TRIF 途径)〔15〕。TLR2可通过与相应的配体结合形成二聚体复合物,并发生内部结构改变,从而招募包括接头蛋白MyD88、TIR相关蛋白、类MyD88样分子、干扰素诱导连接蛋白、人易位关联膜蛋白以及包含TIR 结构域的分子蛋白(SARM),然后启动下游的炎症反应〔16〕。但是TLR2 在炎症相关性疾病中耳炎中的具体作用机制尚未清楚,有望进一步研究。
本实验中,由于两种品系中耳炎模型小鼠均在click声刺激下最有统计学意义。两组中耳炎小鼠模型均在Ⅰ波、Ⅱ波潜伏期延长。这可能是由于中耳积液时声能传导的阻抗变大,传导至内耳的声能减少,故Ⅰ波、Ⅱ波潜伏期延长,临床上经常是以延时出现的Ⅰ波作为诊断中耳炎较好的指标,这与临床结果也是相符的。
中耳炎小鼠模型已经有相关报道和研究,但是关于中耳炎小鼠模型的听力特点尚未有相关探讨。本研究首次探讨中耳炎小鼠模型的听觉特点,对中耳炎小鼠模型的听力损失程度及性质进行评估,为临床早期及时诊断中耳炎提供依据,尤其选择TLR2-/-小鼠和C57小鼠这两种品系的小鼠模型,意在探讨TLR2因子的缺失与中耳炎的关系,为今后进一步研究中耳炎患病的分子机制,甚至将TLR2作为靶目标,利用现代医学技术,为中耳炎的防治开辟新途径。

