山莨菪碱预防糖尿病大鼠对比剂肾病的作用机制
宗春辉 赵凯 高巧营 李东华 戈立秀 刘晋津 吴腾 张一 张琦
(天津市南开医院,天津 300100)
近十几年来,随着对比剂在临床中的应用越来越广泛,对比剂肾病(CIN)的发生率亦呈上升趋势,已成为医源性急性肾损伤的重要原因之一〔1〕。造成CIN的诱因有多种,如高龄、高血压、糖尿病、慢性肾功能不全等,其中糖尿病是发生CIN最常见的危险因素之一〔2〕。目前CIN的发病机制尚不明确,相关的防治指南仅推荐水化做为预防CIN的措施。已有大量研究显示普罗布考可抗氧化应激、降低氧自由基的水平,具有预防及减少CIN发生的作用〔3,4〕;山莨菪碱亦对急性冠脉综合征合并糖尿病肾病患者择期冠状动脉介入术(PCI)术后肾功能具有良好的保护作用〔5〕,但具体机制不详。本研究探讨山莨菪碱对糖尿病大鼠CIN的预防作用及机制。
1 材料与方法
1.1实验动物和主要试剂、仪器 健康SD大鼠40只,8周龄,体重(250±20)g,购自军事医学科学院环境所动物中心。链脲佐菌素购自美国Sigma公司;山莨菪碱购自天津金耀药业有限公司;普罗布考购自承德颈复康药业集团有限公司;对比剂60%泛影葡胺购自上海旭东海普药业有限公司;血清肌酐(Scr)试剂盒购自中生北控生物科技股份有限公司;含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3抗体、caspase-9抗体、B淋巴细胞瘤(Bcl)-2 抗体、Bcl-2相关X蛋白(Bax)抗体、磷酸化蛋白激酶B(p-Akt,Ser473) 抗体、磷酸化雷帕霉素靶蛋白(p-mTOR,Ser2448)抗体、磷酸化细胞外信号调节激酶(p-ERK)、磷酸化氨基末端蛋白激酶(p-JNK)、p-P70S6K、β-肌动蛋白(actin)均购自Cell Signaling公司;蛋白核算测定仪购自Eppendorf AG公司;Western印迹电泳设备、凝胶成像系统均购于Bio-Rad公司;病理包埋机、切片机均购于LEICA公司;LEICA DM4000B正置显微镜购自德国leica公司。
1.2糖尿病大鼠模型建立及分组 给予SD大鼠标准鼠食,实验开始前适应性喂养1 w,造模前测大鼠尾静脉血糖,均显示在正常范围。所有大鼠以腹腔单剂量注射链脲佐菌素60 mg/kg建立糖尿病模型,注射后72 h及7 d后断鼠尾取血测血糖,以非禁食血糖>16.7 mmol/L判定糖尿病大鼠模型成功。随机将糖尿病模型大鼠分为对照组(N组)、CIN模型组(M组)、山莨菪碱组(A组)、普罗布考组(P组),每组10只。
1.3CIN模型建立 饲养10 w后,P组大鼠给予普罗布考(500 mg/kg)灌胃,N组和M组以等量生理盐水灌饲,连续6 d,第7天禁水不禁食。7 d后,麻醉状态下,在腹腔注射泛影葡胺前15 min,A组给予山莨菪碱100 μg/100 g腹腔注射,N组、M组、P组给予等量生理盐水腹腔注射。A组在注射泛影葡胺后4 h内每小时腹腔注射1次山莨菪碱100 μg/100 g,第4~12小时每隔4 h重复腹腔注射1次山莨菪碱,N组、M组、P组于相应时间腹腔注射等量生理盐水,以Scr比N组升高>25%判定CIN模型成功。
1.4实验取材 分别于注射泛影葡胺前、注射后24 h,腹腔注射水合氯醛麻醉大鼠,开腹取下腔静脉血2 ml,迅速取下双肾。左肾剖开部分固定于甲醛,以备肾脏病理研究;部分-80℃冻存,用于检测氧化应激指标;右肾-80℃冻存,用于Western印迹蛋白定量分析。
1.5相关指标的检测
1.5.1血、尿生化指标检测 包括血糖、Scr、尿素氮(BUN)、尿中性粒细胞明胶酶相关脂质运载蛋白(NGAL)等,按照试剂盒说明书利用半自动生化仪测定。
1.5.2肾组织匀浆氧化应激指标的检测 采用硝酸还原酶法测定一氧化氮(NO)水平,黄嘌呤氧化酶法检测超氧化物歧化酶(SOD)活力,硫代巴比妥酸法测定丙二醛(MDA)含量,比色法测定总抗氧化能力(T-AOC)水平。
1.5.3病理学形态检测 肾组织常规脱水石蜡包埋,切片后进行梯度酒精脱水、透明、HE染色,于正置显微镜下观察肾脏组织病理变化。
1.5.4Western印迹检测 提取肾组织总蛋白、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭、抗原抗体反应、放射自显影,检测肾组织Bcl-2、Bax、caspase-3、caspase-9、p-Akt、p-mTOR、p-ERK、p-JNK、p-P70S6K、β-actin蛋白表达量。
1.6统计学方法 应用SPSS18.0软件,计量资料组间比较采用方差分析;计数资料采用χ2检验。
2 结 果
2.1各组大鼠造影24 h后肾脏功能指标变化情况 与N组比较,M组、P组Scr、BUN及NGAL含量均明显升高(P<0.05,P<0.01);A组BUN升高(P<0.05)。与M组比较,A组Scr、BUN 及NGAL含量均明显降低(P<0.05,P<0.01)。见表1。
2.2肾组织匀浆氧化应激指标的检测 造影24 h后,与N组比较,NO、一氧化氮合酶(NOS)含量在M组明显升高(P<0.05);MDA含量在M组、A组、P组均明显升高(P<0.01);SOD、T-AOC含量在M组、A组、P组均明显下降(P<0.01)。与M组比较,NO、NOS含量在A组、P组均明显升高(P<0.05,P<0.01);MDA含量在A组、P组均明显降低(P<0.01)。见表2。
2.3HE染色检测各组大鼠肾小球、肾小管损伤程度 N组肾小球、肾小管上皮细胞未见明显损伤;M组肾小球基底膜增厚,近曲小管肿胀,胞质嗜酸性、细颗粒状,结构不清,远曲小管萎缩,胞质透明变性。A组、P组病理形态相似,肾小球基底膜无明显增厚,近曲小管及远曲小管结构清晰。见图1。

表1 药物干预后各组肾功能比较
与N组比较:1)P<0.05,2)P<0.01;与M组比较:3)P<0.05,4)P<0.01;下表同

表2 给予药物干预后各组肾脏NO、NOS、MDA、SOD、T-AOC的变化
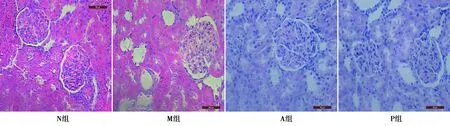
图1 HE染色检测各组肾小球、肾小管损伤(×400)
2.4电镜检查各组大鼠肾小球、肾小管损伤 N组肾小球、肾小管细胞未见明显损伤。M组肾小球血管袢基底膜部分增厚,并有细密的颗粒物沉积,基膜近系膜侧明显增厚,部分足突融合;肾小管上皮细胞胞质可见多量空泡,粗面内质网轻度肿胀脱颗粒;线粒体严重肿胀,嵴断裂、部分消失;肾小管腔面微绒毛大量脱落,基底膜严重增厚。A组肾小球血管袢基底膜大部分厚度均匀,有局灶性增厚;大部分血管内皮窗孔均匀分布,足突分布均匀,极少量融合。 P组肾小球血管袢基底膜厚度基本均匀,血管内皮穿孔分布均匀,足突裂隙均匀分布;肾小管上皮细胞胞质内可见少量溶酶体,部分线粒体排列轻度紊乱,肾小管基底膜厚度基本正常。见图2。
2.5线粒体Bcl-2、Bax蛋白表达量比较 四组之间Bcl-2、Bax蛋白表达量差异存在统计学意义(分别为F=157.75,P<0.05;F=108.81,P<0.05),采用SNK-Q检验对Bcl-2、Bax在四组间进行两两比较,得到Bcl-2蛋白表达量在N组、M组、A组、P组逐渐增加;Bax蛋白表达量在N组、M组、A组、P组逐渐减少,见图3,表3。
2.6Akt/mTOR/P70S6K通路蛋白量比较 四组之间p-Akt、p-mTOR、p-P70S6K蛋白表达量差异存在统计学意义(分别为F=1 390.76,P<0.05;F=2 599.42,P<0.05;F=4 721.76,P<0.05)。采用SNK-Q检验对上述三种蛋白各自进行四组两两比较,各组间蛋白表达量差异一致,在N组、M组、A组、P组逐渐增加,见表3,图4。
2.7MAPK(p-ERK、p-JNK)通路蛋白量表达变化 四组之间p-ERK、p-JNK蛋白表达量差异存在统计学意义(分别为F=1 059.66,P<0.05;F=1 456.56,P<0.05)。采用SNK-Q检验对上述两种蛋白各自进行两两比较,p-ERK蛋白表达量在N组、M组、A组、P组逐渐增加;p-JNK蛋白表达量在N组、M组、A组、P组逐渐减少,见表3,图5。
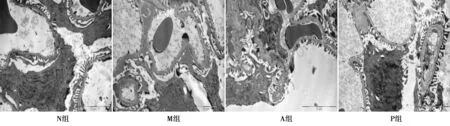
图2 电镜检查各组肾小球、肾小管损伤(×20 000)

图3 不同组别线粒体Bcl-2、Bax蛋白表达量比较
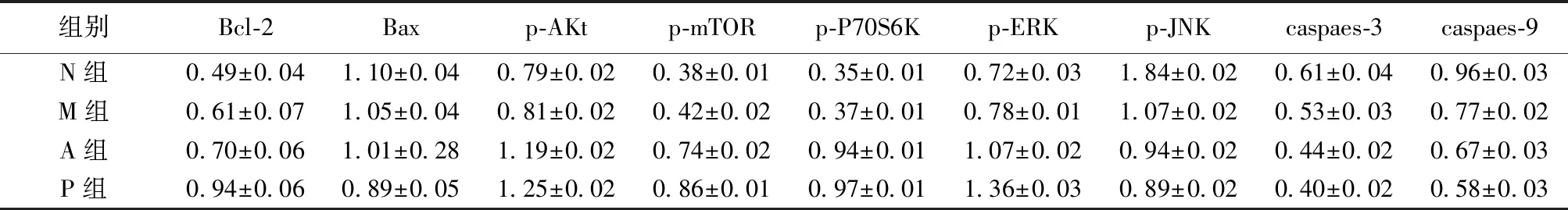
组别Bcl-2Baxp-AKtp-mTORp-P70S6Kp-ERKp-JNKcaspaes-3caspaes-9N组0.49±0.041.10±0.040.79±0.020.38±0.010.35±0.010.72±0.031.84±0.020.61±0.040.96±0.03M组0.61±0.071.05±0.040.81±0.020.42±0.020.37±0.010.78±0.011.07±0.020.53±0.030.77±0.02A组0.70±0.061.01±0.281.19±0.020.74±0.020.94±0.011.07±0.020.94±0.020.44±0.020.67±0.03P组0.94±0.060.89±0.051.25±0.020.86±0.010.97±0.011.36±0.030.89±0.020.40±0.020.58±0.03

图4 Akt/mTOR/P70S6K通路蛋白表达比较

图5 MAPK(p-ERK、p-JNK)通路蛋白量表达比较
2.8caspase-3/9蛋白量表达变化 四组之间caspase-3/9蛋白表达量差异存在统计学意义(分别为F=112.22,P<0.05;F=938.80,P<0.05);采用SNK-Q检验别caspase-3/9在四组间进行两两比较,得到蛋白表达量在N组、M组、A组、P组逐渐减少,表3,见图6。

图6 不同组别caspase-3/9蛋白表达量比较
3 讨 论
流行病学研究显示,糖尿病是CIN发生的最常见危险因素之一〔6〕,且多项研究已证明其为CIN发生的独立危险因素,发病率为5.7%~29.4%〔7〕。传统的CIN检测指标为BUN、Scr,但易受多种因素影响如年龄、性别、高蛋白饮食、脱水状态等〔8〕。近年来,随着肾损伤相关检测手段和评价方法的不断改进,多种敏感性好、特异性高的标志物不断涌现,目前有较多证据支持的新型标志物是NGAL〔9~12〕。有研究显示,检测NGAL水平不仅能早期发现CIN,还能预测肾损伤的严重程度〔13〕。本研究结果说明用药后肾组织损伤程度有所改善。
目前CIN的发病机制尚不明确,比较公认的有对比剂诱发肾小管氧化应激损伤,促进氧自由基及脂质过氧化物形成,促进肾血管收缩物质的释放从而抑制NO生成,加重肾缺血缺氧,诱导肾小管细胞凋亡等。CIN的防治措施比较明确的有水化治疗,但临床上被证实确切有效的药物并不多。近年来有研究发现山莨菪碱、普罗布考有改善CIN肾损伤的作用〔14,15〕。山莨菪碱是茄科植物唐古特莨菪中的一种生物碱,其改善肾功能的机制为〔16〕:(1)通过提高清除氧自由基的能力,提高机体对缺血缺氧的耐受性,激活SOD起到抗氧化应激的作用。(2)抑制脂质过氧化反应,降低MDA含量。(3)通过增加NO含量发挥改善微循环的效应。(4)抑制肾脏细胞凋亡。普罗布考是唯一FDA认证的人工合成抗氧化药物,最初作为降脂药物应用于临床。近年来因其强大的抗氧化作用、防止过氧化物对内皮的损伤等功能成为抗动脉粥样硬化、预防高脂血症内皮损伤的热点药物〔17〕。赵凯等〔18〕研究发现,接受PCI治疗的不稳定型心绞痛老年患者预防性应用普罗布考可有效减少CIN的发生。耿毓汕〔19〕研究表明普罗布考通过改善机体氧化应激状态、降低血清C反应蛋白(CRP)和炎性介质的释放起到保护CIN肾功能的作用。本研究表明山莨菪碱、普罗布考通过提高NO、NOS含量,抑制脂质过氧化反应起到抗氧化应激反应、改善肾小管上皮细胞微循环、促进肾组织结构恢复的作用,达到改善肾功能的目的。
CIN 发生进展中,细胞凋亡是其发病机制之一。经典的细胞凋亡信号途径有外源性途径和内源性途径,分别由死亡受体介导和线粒体途径介导。内源性细胞凋亡途径中最主要的调控因子为线体Bcl-2家族,其中抗凋亡基因Bcl-2和促凋亡基因Bax在家族中最具代表性。体外研究〔20〕已证实,对比剂可通过激活活性氧(ROS)磷酸化p53,影响线粒体Bcl-2基因的表达使Bcl-2/Bax比值下调,并通过激活线粒体caspase信号通路,导致caspase-3/9表达量增加,促进肾细胞凋亡。Andreucci等〔21〕通过体外研究发现,Akt/mTOR/P70S6K 途径去磷酸化失活参与了造影剂引起的肾小管上皮细胞凋亡。动物实验表明〔22〕,肾缺血可诱导JNK活性增加,诱导细胞凋亡。有研究认为〔23,24〕激活ERK通路可有效抑制缺氧再灌注导致的心肌细胞调亡的发生。本研究结果提示,山莨菪碱通过上调Bcl-2/Bax比值,恢复了线粒体Bcl-2家族的平衡,并通过其强大的抗氧化功效激活磷酸化的Akt/mTOR/P70S6K信号通路和p-ERK的磷酸化信号途径,下调促调亡上游信号p-JNK的表达,最终经家族传递“保护”信息,从而抑制了线粒体caspase-3/9通路的激活,起到减轻肾细胞凋亡、保护肾功能的作用。
综上所述,山莨菪碱通过抗氧化应激、抑制脂质过氧化反应、上调Bcl-2/Bax比值、激活磷酸化的Akt/mTOR/P70S6K和p-ERK信号通路,抑制caspase-3/9通路的激活,发挥了保护糖尿病大鼠对比剂急性肾损伤的作用。

