分化型甲状腺癌131I治疗后再次停用左旋甲状腺激素血清促甲状腺激素未升高伴高甲状腺球蛋白血症1例
薛佳辰 赵明
(大连大学附属中山医院核医学科,辽宁 大连 116000)
甲状腺癌是最常见的内分泌系统恶性肿瘤,其中分化型甲状腺癌(DTC)占所有甲状腺癌的90%以上,其发病率在世界上呈逐年上升趋势,位居女性恶性肿瘤前十位,包括甲状腺乳头状癌(PTC)和滤泡状癌,其中PTC较为常见且预后良好〔1〕。甲状腺全切除术或近甲状腺切除手术后放射性131I治疗是DTC的标准治疗方式,可以清除残余的甲状腺组织,有助于临床监测肿瘤的复发或远处转移情况〔2〕。正常情况下PTC患者行131I治疗前需停用左旋甲状腺激素(L-T4)4 w左右,使机体处于“碘饥饿”状态。并且DTC随访中的血清Tg测定包括:促甲状腺激素(TSH)抑制状态下和TSH刺激后的Tg测定。由于TSH抑制状态下肿瘤细胞分泌Tg的能力可能也会受到抑制。故为更准确地反映病情,应通过停用L-T4或应用重组人促甲状腺激素(rhTSH)的方法,使血清TSH水平升高至>30 mIU/L之后再进行Tg检测,即TSH刺激后的Tg测定〔3〕。但是许多DTC患者因长期服用L-T4抑制治疗,停用后垂体长期处于被抑制状态,其功能恢复需要一定的时间,所以血清TSH上升可能较慢;年龄较大者,因垂体功能储备降低,在停用L-T4后也可能不导致TSH水平增高。而本文患者为43岁中年女性,前两次停用优甲乐后TSH均能上升至100 μIU/ml以上,仅4个月后第3次停用L-T4 28 d TSH未见增高。既往文献并未见到与本病例相似,故本文就此情况做一报道。
1 临床资料
43岁,女性患者,2016年10月28日行右侧甲状腺癌根治术+左甲状腺全切术。术后病理:甲状腺乳头状癌,侵犯被膜,未见脉管神经侵犯;右甲状腺乳头状癌(直径0.6 cm),侵犯被膜,另见淋巴结2枚(2/2);右侧甲状腺滤泡扩张,胶质潴留;右侧中央区淋巴结见转移癌(1/1)(图1)。根据2015年ATA指南复发危险分层及刺激性Tg的水平该患者术后属于高危组患者〔4〕。术后予L-T4抑制治疗。
2017年1月5日行第1次131I治疗,根据我国《甲状腺结节和分化型甲状腺癌诊治指南》推荐:中高危DTC患者兼顾清灶目的的清甲治疗,可直接给予3.7~7.4 GBq(100~200 mCi)。所以给予患者治疗剂量为150 mCi。治疗前停用L-T4 28 d,治疗前当天复查TSH>100 μIU/ml,Tg>500 ng/ml。治疗后4 d行全身碘显像(WBS)示:甲状腺术后残留组织显影(图2)。治疗后第3天继续予L-T4抑制替代治疗。 有研究指出,较高的TSH(≥30 μIU/ml)可增加甲状腺滤泡细胞内的钠-碘同向转运体的表达,从而增加残留甲状腺组织和DTC细胞摄取131I的能力,不但利于清除残余病灶,并且可避免131I甲状腺显像假阴性的发生〔5,6〕。所以让患者停用左旋甲状腺激素来提高TSH的水平。

图1 第1次术后病理
治疗后连续2个月门诊随诊复查甲功及甲状腺球蛋白(Tg)示:游离三碘甲状腺原氨酸(FT3)、游离甲状腺激素(FT4)及Tg抗体(TgAb)均在正常范围内,TSH 0.075 μIU/ml、0.016 μIU/ml,Tg 9.58 ng/ml、5.54 ng/ml。2017年5月2日行甲状腺彩超:左侧颈部Ⅳ区(0.4 cm×0.4 cm)及Ⅳ区多发肿大淋巴结(0.9 cm×0.9 cm)。血液检查提示第1次131I治疗有效。
由于患者WBS示患者仍存在甲状腺残留组织显影,彩超结果显示仍存在肿大淋巴结且Tg水平较高,故根据2015年美国甲状腺协会(ATA)指南的中提到的:对于血清刺激性Tg>10 ng/ml且WBS可见功能性核素摄取灶但未见转移灶的情况,直接给予第2次的经验性131I治疗。2017年5月2日行第2次131I治疗,治疗前停用L-T4 30 d,复查TSH>100 μIU/ml,Tg>500 ng/ml,予131I剂量为150 mCi。治疗后4 d行WBS示:未见异常放射性摄取,与2017年1月5日WBS相比原放射性浓聚灶消失(图3)。治疗后第3天继续予优甲乐抑制治疗。
第2次131I治疗后第1个月和第2个月复查甲状腺功能及Tg均显示TSH<0.1 μIU/ml及Tg<10 ng/ml且处于逐渐下降的状态,表示第2次131I治疗有效。2017年9月4日复查甲状腺彩超:左侧颈部Ⅳ区(0.3 cm×0.3 cm)及Ⅵ区多发肿大淋巴结(1.0 cm×0.7 cm),且患者第2次131I治疗前刺激性Tg>500 ng/ml,所以患者的TSH抑制治疗有效,但可能存在肿瘤组织产生Tg能力被抑制的情况,所以决定4个月后评估患者刺激性Tg的水平。

甲状腺床可见功能性核素摄取图2 第1次131I治疗后WBS
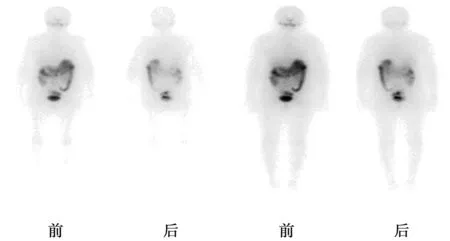
WBS未见异常放射性摄取图3 第2次131I治疗后WBS
患者第3次(2017年9月4日)停用L-T4及禁碘饮食28 d,入院当天复查TSH 0.078 μIU /ml,Tg 20.99 ng/ml,FT3、FT4、TgAb均在正常值范围内。患者已停用L-T4 28 d,甲状腺功能水平未达到甲状腺功能减退症的状态,且胸部CT及腹部彩超均未见明显异常。该患者TSH<0.1 μIU/ml,FT3、FT4未见下降趋势,所以不考虑让患者继续停用L-T4等待TSH上升的方法。
该患者TSH并未升高,但对此产生了疑问,在4个月前的第2次治疗TSH可达到>30 μIU/ml的基础上,且患者第2次131I治疗后行WBS已未见残留及转移灶显影,为什么会出现甲状腺功能结果完全处于正常值的状态。患者胸部CT及腹部彩超均未见明显异常,仅甲状腺彩超示颈部多发肿大淋巴结。以上检查结果均未显示患者存在远处转移灶。遂建议患者行PET-CT明确全身病情(图4)。
2017年11月2日患者于大连大学附属中山医院行左Ⅵ区淋巴结清扫术+左侧功能性淋巴结清扫。术后病理:左Ⅱ区淋巴结1/7,Ⅲ区淋巴结9/13,Ⅳ区淋巴结1/2,Ⅵ区淋巴结1/1,气管左侧淋巴结2/2转移癌,Ⅴ区淋巴结未见转移癌。见图4,5。
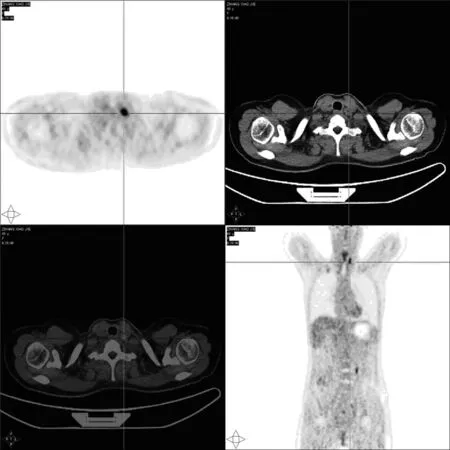
甲状腺床区多枚FDG代谢增高小淋巴结,左侧颈Ⅳ区最大者径约1.1 cm,放射性摄取最高,SUVmax约11.0,延迟显像约为12.9,均首先考虑转移瘤图4 2017年9月8日PET-CT
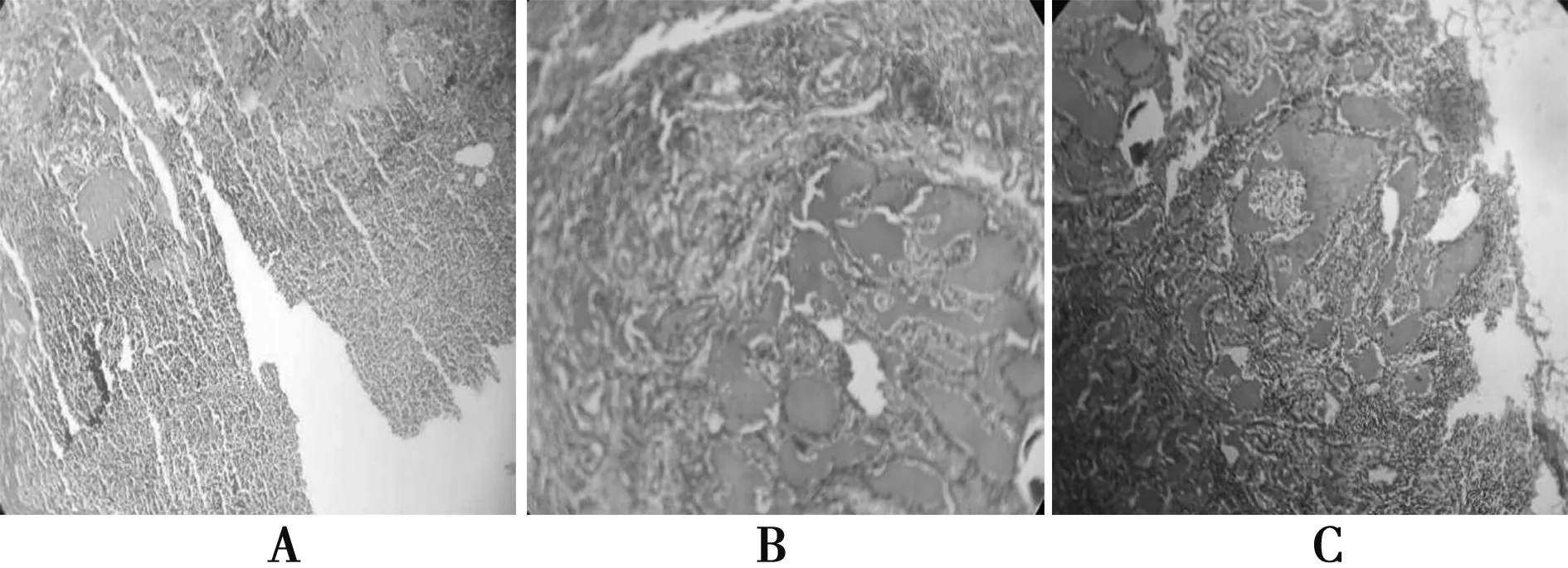
A、B、C均为颈部淋巴结转移癌病理图5 第2次手术术后病理(×100)
2 讨 论
尽管PTC死亡率低,预后良好,但据报道最多有30%的患者在甲状腺床或颈部局部复发〔7〕。PTC术后131I治疗和长期TSH抑制治疗是传统的治疗方法〔8〕。TSH抑制治疗是指对DTC术后患者给予超过生理需要量的甲状腺激素以抑制垂体TSH的分泌,进而减少TSH依赖性癌肿的复发和转移,降低癌肿相关性的死亡。有研究表明TSH的水平与甲状腺癌具有密切关系,多种类型甲状腺癌细胞表面具有TSH受体,能够影响甲状腺上皮细胞和滤泡细胞的生长〔9〕。对于TSH抑制程度,2009年ATA提出了具体的方案:对于高危组且肿瘤持续存在的患者,ATA建议将TSH抑制到<0.1 μIU/ml,而对于初治的低危组患者,ATA建议将TSH抑制到0.1~0.5 μIU/ml;对于高危组的无瘤随访期患者,ATA指南建议TSH维持在0.1~0.5 μIU/ml 5~10年;无病随访的低危组患者,ATA建议将TSH抑制于正常值下限水平〔10〕。而Tg是PTC接受全甲状腺切除术的最有效的预后预测因素,有研究已表明,Tg、ATG、TSH水平可成为监测DTC术后复发及转移的特异性指标〔11〕。
本文中的患者在甲状腺癌根治术后长期服用优甲乐抑制治疗,根据2015年ATA指南复发危险分层该患者术后属于中危组患者,在第1次和第2次131I治疗后的第1、2个月复查TSH均可以达到0.1 μIU/ml左右的标准,符合ATA指南中危组建议的TSH抑制目标。但该患者在2次治疗前存在刺激性Tg>500 ng/ml的情况,表明该患者存在肿瘤活动性的证据,但该患者在第2次131I治疗后行WBS为阴性,且门诊随访期间Tg指标处于逐渐下降状态(治疗后第1、2个月Tg 分别为6.92及5.05 ng/ml),所以考虑患者TSH抑制治疗是有效的。DTC随访中的血清Tg测定应包括TSH抑制状态下和TSH刺激后的Tg测定,由于TSH抑制状态下肿瘤细胞分泌Tg的能力可能也会受到抑制,故为更准确地反映病情,应通过停用L-T4或应用rhTSH的方法,使血清TSH水平升高至>30 mIU/L之后再进行Tg检测,即TSH刺激后的Tg测定〔12〕。所以为了评估患者的具体情况,在第2次治疗后4个月,再次对患者停用L-T4 28 d,复查甲状腺功能示患者FT3、FT4处于正常水平且TSH小于0.1 μIU/ml,基本上处于未停用优甲乐的状态,Tg 20.99 ng/ml,复查甲状腺彩超均示颈部肿大淋巴结,且大小和数量与4个月前未见明显变化。但患者体内的肿瘤产生Tg的能力在TSH抑制状态下也可能被抑制的前提下选择了第3次监测其刺激性Tg的水平,而本次患者的TSH却并未升高,由此我们提出了以下几点可能影响TSH的因素,并对其进行了分析讨论:①患者未提供准确信息:患者TSH未升高很可能由于患者未停用L-T4而未提供准确的信息,但是该患者为我科依从性较好患者,且无精神障碍及神经系统相关疾病,医务人员同时再三询问患者和家属,患者出现自行服用L-T4的可能性较小。②TSH检测因素影响:患者3次测量停用L-T4情况下的TSH均于我院检验科测量,检测仪器均为雅培i2000,检测方法均为化学发光微粒子免疫检测法,且第3次TSH未升高后进行了第2次的重复检测并无太大出入。所以对TSH检测因素的影响不予以考虑。③131I破坏垂体:一般来讲多次131I治疗后患者体内累积剂量>1 000 mCi才会出现组织器官的损伤,该患者累积剂量仅300 mCi。并且并未查阅到相关文献存在131I可以破坏垂体的证据,所以这一点不予以考虑。④年龄较大患者垂体储备功能降低:对于年龄较大的患者其垂体储备功能低,也会导致停用左旋甲状腺激素后出现TSH不及时上升的情况。但是本文患者为中年女性,所以这种情况不予以考虑。⑤垂体长期抑制状态:如果患者的垂体长期处于被抑制的状态,停用左旋甲状腺激素后期功能恢复较慢。但是本文患者4个月前可正常增高,仅短期内出现TSH不上升的情况,所以这一点同样不成立。⑥生物素影响:生物素(维生素H)为普遍存在的水溶性维生素,美国医学研究所推荐的成年人每日摄入量为30 μg生物素。生物素对甲状腺功能测试的干扰首先在1996年一项新生儿研究中被提出〔13〕。也有研究显示对于多发性硬化患者应用治疗剂量的生物素对甲状腺功能会存在影响,该文章中应用生物素后患者出现TSH降低及T3、T4升高的情况〔13〕。生物素食物药物来源:牛奶、牛肝、蛋黄、动物肾脏、草莓、柚子、葡萄、瘦肉、糙米、啤酒、小麦、复合维生素(善存)。本文患者第3次停用L-T4前未大剂量服用含生物素的食物或药物,但是不排除患者未提供准确信息的情况,所以对于是否大量服用生物素无法确定,我们对此项保持怀疑的观点。但是综合患者的整体情况,没有让患者进行生物素的检测,而是进一步行PET-CT明确病情。⑦转移灶功能较强:患者第2次WBS阴性,表明转移灶不摄取131I,但是患者在第2次和第3次停用左旋甲状腺激素之间的4个月可能会存在转移灶变异的情况,短期内失分化为分泌功能较强的转移灶。但考虑到患者的综合因素和病情我们没有行全身碘显像来验证这一点。
基于以上几种可能的情况,对患者提出了2点解决方案:①继续停用优甲乐或应用rhTSH使TSH升高。但是患者这种情况是在第2次131I治疗后WBS阴性情况下短短4个月后出现,TSH<0.1 μIU/ml,并不是TSH在停用优甲乐后存在TSH升高,但未达到行131I治疗标准的情况,所以该患者继续停用优甲乐TSH仍然不会升高。并且仅为了评估患者的病情,所以应用rhTSH意义不大。②行PET-CT明确病情:对于随访过程中出现不明原因的血清Tg升高而WBS阴性的患者,如果血清刺激性Tg水平>10 ng/ml,可考虑行18F-FDG PET-CT定位病灶〔14〕。所以建议该患者行PET-CT检查,结果仅提示甲状腺床区多枚FDG代谢增高小淋巴结考虑转移瘤,未见远处转移。该患者PET-CT FDG阳性表达,有研究显示FDG阳性的高糖代谢病灶通常不摄取碘,患者往往无法从131I治疗获益而改变其不良预后,此时应考虑131I之外的其他治疗如手术、放疗或靶向治疗等〔15〕。因此,没有考虑给患者应用rhTSH制剂来提高TSH水平,而是进行了外科手术治疗,术后颈部淋巴结病理证实为甲状腺乳头状癌转移相关淋巴结。
Wang等〔16〕通过对近50年约3 000例患者的回顾性分析发现,约13%的甲状腺癌术后转移患者早期转移灶内有131I的摄取,24个131I治疗疗程后转移灶发生失分化不摄取131I,而18F-FDG显像则呈阳性,提示甲状腺癌细胞的分化程度降低,可能与钠碘转运体功能丧失有关。所以这个病例提示:①仅仅依靠术后病理诊断决定“复发危险分度”有时不可靠,本案例即要求临床应结合TSH刺激下的甲状腺球蛋白水平;②第2次手术后患者Tg仍未达到理想的下限,需要密切的随访和动态的精细化评估;③从本案例随访中TSH与Tg的变化关联度看,L-T4 TSH抑制治疗是非常必需和有效的。为此,对于没有131I聚集能力的失分化肿瘤或转移灶,恢复NIS表达,使其再分化,对甲状腺癌的131I治疗相当重要,当然对于可以手术切除的实质性病灶,手术切除是非常必要的。

