蜘蛛丝和桑蚕丝三级红外光谱研究
武玉洁,赵英淋,殷俊荣,张 莹 ,封卓帆 ,辛 畅 ,肖 霄 ,于宏伟
(1.河北一品制药股份有限公司,河北 石家庄 052165;2.石家庄学院 化工学院,河北 石家庄 050035)
0 引言
蜘蛛丝是一种天然动物纤维.在力学强度方面,蜘蛛丝与强度最高的碳纤维及高强度合成纤维等强度相接近,但它的韧性明显优于上述几种纤维.因此,蜘蛛丝在国防军事[1]、体育科学[2,3]、生命科学[4]等领域具有广阔的应用前景.蜘蛛丝的优异理化性能与其特殊的结构有关.红外光谱法广泛应用在天然纤维的结构研究方面[5-11],但蜘蛛丝的研究却少见报道.本研究以蜘蛛丝为研究对象,而以桑蚕丝作为对比研究对象[12,13],分别开展了蜘蛛丝和桑蚕丝的三级红外光谱的研究,包括:红外(IR)光谱、变温红外(TD-IR)光谱和二维红外(2D-IR)光谱,为天然动物纤维的应用及改性研究提供了有益的科学借鉴.
1 材料与方法
1.1 材料
大腹园蛛生丝,生桑蚕丝.
1.2 仪器及操作方法
傅里叶中红外光谱仪(Spectrum 100型号,美国PE公司);单次内反射ATR-FTIR附件(Golden Gate型号,英国Specac公司);ATR-FTIR变温控件(WEST 6100+型号,英国Specac公司).
红外光谱实验以空气为背景,每次对信号进行8次扫描累加;测温范围303~393 K(变温步长10 K).
1.3 IR光谱数据获得及图形处理
IR光谱采用Spectrum v 6.3.5软件;2D-IR光谱的数据获得采用TD Version 4.2软件.
2 结果与讨论
2.1 蜘蛛丝和桑蚕丝的IR光谱研究
2.1.1 蜘蛛丝的IR光谱研究
开展了蜘蛛丝的一维IR光谱研究,见图1(a).根据文献[14]报道3 282 cm-1处的吸收峰是蜘蛛丝NH和OH的伸缩振动组合模式(νNH-spidersilk+νOH-spidersilk);2 921 cm-1处的吸收峰是蜘蛛丝CH2不对称伸缩振动模式(νasCH2-spidersilk);2 852 cm-1处的吸收峰是蜘蛛丝 CH2对称伸缩振动模式(νsCH2-spidersilk);1 627 cm-1处的吸收峰是蜘蛛丝酰胺Ⅰ带吸收模式(νamide-Ⅰ-spidersilk);1 516 cm-1处的吸收峰是蜘蛛丝酰胺Ⅱ带吸收模式(νamide-Ⅱ-spidersilk),而1 236 cm-1处的吸收峰是蜘蛛丝酰胺Ⅲ带吸收模式(νamide-Ⅲ-spidersilk).进一步研究了蜘蛛丝的二阶导数IR光谱,见图1(b),发现其谱图分辨能力有了一定提高.其中蜘蛛丝νamide-Ⅰ-spidersilk对应的吸收频率包括:1 660 cm-1(νamide-Ⅰ-spider silk-1),1649cm-1(νamide-Ⅰ-spider silk-2),1632cm-1(νamide-Ⅰ-spider silk-3)和1624cm-1(νamide-Ⅰ-spider silk-4);蜘蛛丝νamide-Ⅱ-spider silk对应的吸收频率包括:1539cm-1(νamide-Ⅱ-spidersilk-1),1529cm-1(νamide-Ⅱ-spidersilk-2)和1513cm-1(νamide-Ⅱ-spidersilk-3);而1235cm-1处的吸收峰归属于酰胺Ⅲ带吸收模式(νamide-Ⅲ-spidersilk),相关光谱信息见表1.
2.1.2 桑蚕丝的IR光谱研究

图1 蜘蛛丝IR光谱(313 K)

表1 蜘蛛丝和桑蚕丝IR光谱数据(313 K)cm-1

图2 桑蚕丝IR光谱(313 K)
首先开展了桑蚕丝的一维IR光谱研究,如图2(a)所示.根据文献[14]的报道,3 277 cm-1处的吸收峰是νNH-mulberrysilk+νOH-mulberrysilk;1621cm-1处的吸收峰是 νamide-Ⅰ-mulberrysilk;1514cm-1处的吸收峰是 νamide-Ⅱ-mulberrysilk,而 1230cm-1处的吸收峰是νamide-Ⅲ-mulberrysilk.进一步研究了桑蚕丝的二阶导数IR光谱,如图2(b)所示,发现其谱图分辨能力有了一定的提高.其中,桑蚕丝νamide-Ⅰ-mulberrysilk对应的吸收频率包括:1 660 cm-1(νamide-Ⅰ-mulberrysilk-1),1 649 cm-1(νamide-Ⅰ-mulberrysilk-2),1 633 cm-1(νamide-Ⅰ-mulberrysilk-3)和1 618 cm-1(νamide-Ⅰ-mulberrysilk-4);而桑蚕丝νamide-Ⅱ-mulberrysilk对应的吸收频率包括:1 540 cm-1(νamide-Ⅱ-mulberrysilk-1)和1 513 cm-1(νamide-Ⅱ-mulberrysilk-2),相关IR光谱信息见表1.
由表1数据可知,蜘蛛丝νasCH2和νsCH2对应的吸收强度较大,则证明蜘蛛丝中烃类及其衍生物的含量高于相应的桑蚕丝.此外,蜘蛛丝和桑蚕丝νamide-Ⅰ,νamide-Ⅱ和νamide-Ⅲ对应的吸收频率有较大的差异.这主要是因为,尽管桑蚕丝和蜘蛛丝的主要化学组成基本相同(均为蛋白质),但蛋白质的种类及排列方式存在着较大的差异.
2.2 蜘蛛丝和桑蚕丝的TD-IR光谱研究
蜘蛛丝和桑蚕丝的主要吸收频率集中在3 600~2 800 cm-1,1 700~1 500 cm-1,1 250~1200 cm-13个频率区间,因此分别在这3个区间开展了桑蚕丝和蜘蛛丝的TD-IR光谱研究,来进一步研究温度变化对于桑蚕丝和蜘蛛丝分子结构的影响.
2.2.1 3 600~2 800 cm-1频率范围内蜘蛛丝和桑蚕丝的TD-IR光谱研究
2.2.1.1 3 600~2 800 cm-1频率范围内蜘蛛丝TD-IR光谱研究
开展了蜘蛛丝的一维TD-IR光谱研究,见图3(a),实验发现:随着测定温度的升高,蜘蛛丝νNH-spidersilk+νOH-spidersilk,νasCH2-spidersilk和νsCH2-spidersilk对应的吸收强度增加,而相应吸收频率出现蓝移现象.进一步开展了蜘蛛丝的二阶导数TD-IR 光谱研究,见图3(b),研究发现,随着测定温度的升高,蜘蛛丝νNH-spidersilk+νOH-spidersilk,νasCH2-spidersilk和νsCH2-spidersilk对应吸收频率出现了明显的蓝移现象.蜘蛛丝νNH-spidersilk+νOH-spidersilk对应吸收强度增加,而蜘蛛丝νasCH2-spidersilk和νsCH2-spidersilk对应吸收强度降低(表2).

图 3 3 600~2 800 cm-1范围内蜘蛛丝TD-IR 光谱(313~393 K)

表2 蜘蛛丝TD-IR光谱数据(313~393 K)cm-1
2.2.1.2 3 600~2 800 cm-1频率范围内桑蚕丝的TD-IR光谱研究
首先开展了桑蚕丝的一维TD-IR光谱研究,如图4(a)所示,实验发现:随着测定温度的升高,桑蚕丝νNH-mulberrysilk+νOH-mulberrysilk对应的吸收强度和频率并没有发生明显的改变.进一步开展了桑蚕丝的二阶导数TDIR光谱研究,见图4(b),并没有得到有价值的光谱信息(表3).
2.2.2 1 700~1 500 cm-1频率范围内蜘蛛丝和桑蚕丝的TD-IR光谱研究
2.2.2.1 1 700~1 500 cm-1频率范围内蜘蛛丝TD-IR光谱研究

图 4 3 600~2 800 cm-1范围内桑蚕丝TD-IR光谱(313~393 K)

表3 桑蚕丝TD-IR光谱数据(313~393 K)cm-1

图5 1 700~1 500 cm-1范围内蜘蛛丝TD-IR 光谱(303~393 K)
开展了蜘蛛丝的一维TD-IR光谱研究,见图5(a).研究发现:随着测定温度的升高,蜘蛛丝νamide-Ⅰ-spidersilk和νamide-Ⅱ-spidersilk对应的吸收频率没有明显变化,而相应的吸收强度略有增加.进一步研究了蜘蛛丝的二阶导数TD-IR光谱,见图5(b),则得到了同样的光谱信息(表2).
2.2.2.2 1 700~1 500 cm-1频率范围内桑蚕丝的TD-IR光谱研究
首先开展了桑蚕丝的一维TD-IR光谱研究,如图6(a)所示.研究发现:随着测定温度的升高,桑蚕丝νamide-Ⅰ-mulberrysilk对应的吸收频率出现了蓝移现象,而νamide-Ⅱ-mulberrysilk对应的吸收频率出现了红移现象.随着测定温度的升高,桑蚕丝νamide-Ⅰ-mulberrysilk和νamide-Ⅱ-mulberrysilk对应的吸收强度增加.进一步研究了桑蚕丝的二阶导数TD-IR 光谱研究,见图 6(b),随着测定温度的升高,桑蚕丝 νamide-Ⅰ-mulberrysilk-4和 νamide-Ⅱ-mulberrysilk-2对应的吸收频率出现了明显的蓝移现象.显然桑蚕丝的νamide-Ⅰ-mulberrysilk-4和νamide-Ⅱ-mulberrysilk-2对于温度变化非常敏感(表3).
2.2.3 1 250~1 200 cm-1频率范围内蜘蛛丝和桑蚕丝的TD-IR光谱研究
2.2.3.1 1 250~1 200 cm-1频率范围内蜘蛛丝的TD-IR光谱研究
开展了蜘蛛丝的一维TD-IR光谱研究,见图7(a).实验发现:随着测定温度的升高,蜘蛛丝νamide-Ⅲ-spidersilk对应的吸收频率出现了红移,相应的吸收强度增加.进一步研究了蜘蛛丝νamide-Ⅲ-spidersilk相应的二阶导数TDIR光谱,见图7(b),实验发现νamide-Ⅲ-spidersilk对应的吸收频率出现了红移,但相应的吸收强度降低(表2).

图 6 1 700~1 500 cm-1桑蚕丝 TD-IR 光谱(313~393 K)

图 7 1 250~1 200 cm-1范围内蜘蛛丝TD-IR光谱(313~393 K)
2.2.3.2 1 250~1 200 cm-1频率范围内桑蚕丝的TD-IR光谱研究
首先开展了桑蚕丝的一维TD-IR光谱研究,如图8(a)所示.研究发现:随着测定温度的升高,桑蚕丝νamide-Ⅲ-mulberrysilk对应的吸收频率出现了红移,相应的吸收强度增加.进一步研究了桑蚕丝νamide-Ⅲ-mulberrysilk相应的二阶导数TD-IR光谱,如图8(b)所示,则得到了同样的光谱信息(表3).

图 8 1 250~1 200 cm-1范围内桑蚕丝TD-IR光谱(313~393 K)
根据表2数据可知,蜘蛛丝的热稳定较好,随着测定温度的升高,蜘蛛丝主要官能团对应的吸收频率、强度及峰型均没有发生明显的改变.
根据表3数据可知,桑蚕丝的热稳定较差,随着测定温度的升高,桑蚕丝νamide-Ⅰ-mulberrysilk和νamide-Ⅱ-mulberrysilk对应的吸收频率、强度及峰型均发生了明显的改变.
2.3 蜘蛛丝和桑蚕丝的2D-IR光谱研究
由于蜘蛛丝和桑蚕丝νamide-Ⅰ对应的吸收强度较大,并且对于温度比较敏感,因此重点开展了蜘蛛丝和桑蚕丝νamide-Ⅰ的2D-IR光谱研究,来进一步研究温度变化对于蜘蛛丝和桑蚕丝蛋白质微观结构的影响.
2.3.1 蜘蛛丝νamide-Ⅰ-spidersilk的2D-IR光谱研究
开展了蜘蛛丝 νamide-Ⅰ-spidersilk的同步 2D-IR 光谱的研究,如图 9(a)所示. 首先在(1 626 cm-1,1 626 cm-1)和(1 652 cm-1,1 652 cm-1)处发现了2个相对强度较大的自动峰,此外在(1 626 cm-1,1 652 cm-1)处发现了 1个相对强度较大的交叉峰.进一步开展了蜘蛛丝νamide-Ⅰ-spidersilk的异步2D-IR光谱的研究,如图9(b)所示.在(1 626 cm-1,1 652 cm-1)处发现了1个相对强度较大的交叉峰.蜘蛛丝2D-IR光谱则进一步证明:蜘蛛丝的νamide-Ⅰ-spidersilk对应的吸收频率包括:1 626 cm-1和 1 652 cm-1. 根据文献报道[9,10],1 626 cm-1频率的吸收峰归属于蛋白质β-sheet构象,而1 652 cm-1频率的吸收峰归属于蛋白质α-helix构象,相关2D-IR光谱信息见表4.
根据NODA原则[15-19]和表4数据可知,随着测定温度的升高,蜘蛛丝νamide-Ⅰ-spidersilk吸收峰变化快慢的顺序为:1 626 cm-1(β-sheet-spider silk)>1 652 cm-1(α-helix-spider silk).实验发现:蜘蛛丝蛋白质结构中,β-sheetspider silk构象结构对于温度变化比较敏感,随着温度的升高,其结构最先改变,而α-helix-spider silk构象结构相对较为稳定.

图 9 蜘蛛丝 νamide-Ⅰ-spider silk的 2D-IR 光谱(1 680~1 610 cm-1)

表 4 蜘蛛丝 νamide-Ⅰ-spider silk的 2D-IR 光谱解释(1 680~1 610 cm-1)
2.3.2 桑蚕丝νamide-Ⅰ-mulberrysilk的2D-IR光谱研究
开展了桑蚕丝 νamide-Ⅰ-mulberrysilk的同步 2D-IR 光谱研究,见图 10(a). 首先在(1 626 cm-1,1 626 cm-1)和(1 658 cm-1,1 658 cm-1)处发现 2 个相对强度较大的自动峰. 此外在(1 626 cm-1,1 658 cm-1)处发现 1 个相对强度较大的交叉峰.进一步开展桑蚕丝νamide-Ⅰ的异步2D-IR光谱的研究,见图10(b).在(1624cm-1,1658cm-1),(1624cm-1,1665cm-1),(1658cm-1,1665cm-1)等处发现了3个相对强度较大的交叉峰.桑蚕丝2D-IR光谱数据证明:桑蚕丝的 νamide-Ⅰ-mulberrysilk对应的吸收频率包括:1624,1658,1665cm-1.根据文献[9,10]的报道,1624cm-1频率处的吸收峰归属于蛋白质β-sheet-mulberry silk构象,1 658 cm-1频率处的吸收峰归属于蛋白质α-helixmulberry silk构象;而1 665 cm-1频率处的吸收峰归属于蛋白质random coil-mulberry silk构象,相关2D-IR光谱信息见表5.
根据NODA原则[15-19]和表5数据可知,随着测定温度的升高,桑蚕丝νamide-Ⅰ-mulberrysilk吸收峰变化快慢的顺序为:1 658 cm-1(α-helix-mulberry silk)>1 624 cm-1(β-sheet-mulberry silk)>1 665 cm-1(random coil-mulberry silk).实验发现:桑蚕丝蛋白质结构中,α-helix-mulberry silk构象对于温度变化比较敏感,随着温度的升高,其结构最先改变,而random coil-mulberry silk构象结构相对较为稳定.

图 10 桑蚕丝 νamide-Ⅰ-mulberry silk的 2D-IR 光谱(1 680~1 610 cm-1)
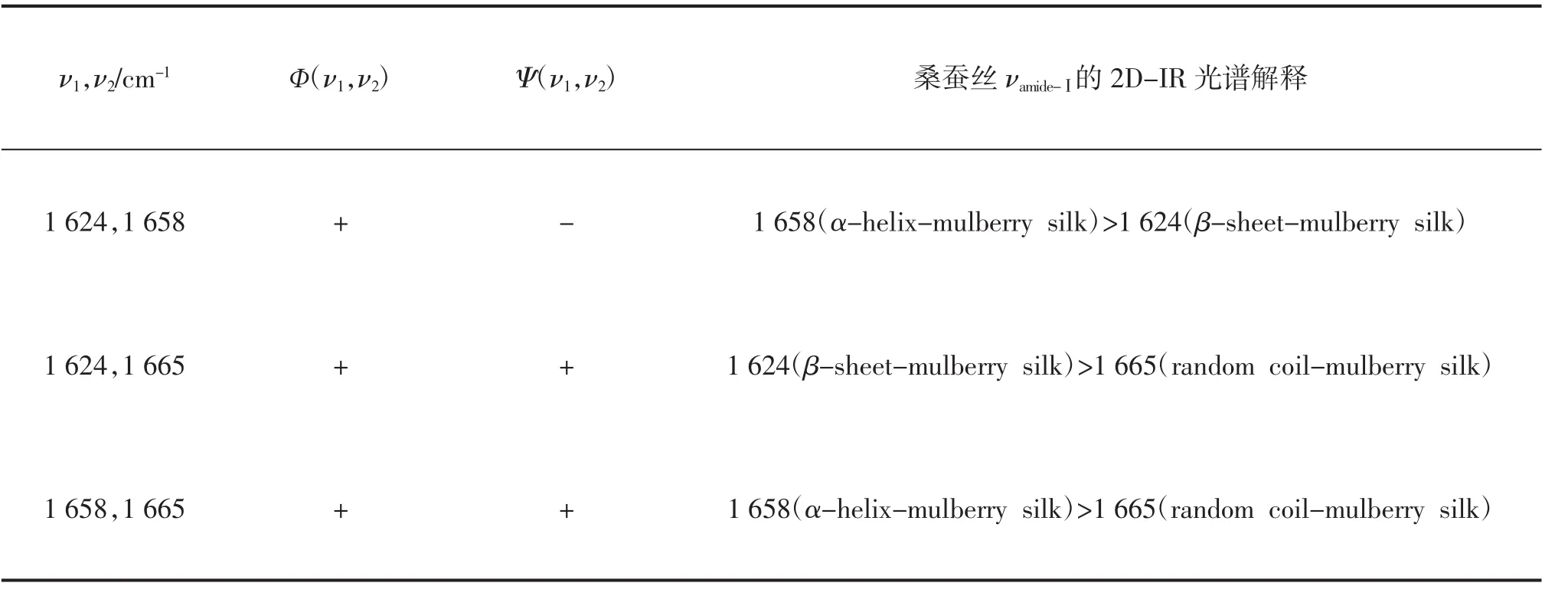
表5 桑蚕丝νamide-Ⅰ的2D-IR光谱解释(1 680~1 610 cm-1)
3 结论
首先开展了蜘蛛丝和桑蚕丝的IR光谱研究.实验发现:蜘蛛丝和桑蚕丝存在νNH+νOH,νasCH2,νsCH2,νamide-Ⅰ,νamide-Ⅱ,νamide-Ⅲ等6种红外吸收模式.在313~393 K的测定温度范围内,进一步开展蜘蛛丝和桑蚕丝的TD-IR光谱研究,实验发现桑蚕丝的热稳定较差.以蜘蛛丝和桑蚕丝νamide-Ⅰ为研究对象,进一步开展了相关2D-IR光谱的研究.实验发现:蜘蛛丝的νamide-Ⅰ-spidersilk对应的吸收频率包括:1 626 cm-1(β-sheet-spider silk)和1 652 cm-1(α-helix-spider silk),随着测定温度的升高,蜘蛛丝νamide-Ⅰ-spidersilk吸收峰变化快慢的顺序为:1626 cm-1(β-sheet-spider silk)>1 652 cm-1(α-helix-spider silk);桑蚕丝 νamide-Ⅰ-mulberrysilk对应的吸收频率包括:1 624 cm-1(β-sheet-mulberry silk),1658cm-1(α-helix-mulberry silk),1 665 cm-1(random coil-mulberry silk).随着测定温度的升高,桑蚕丝 νamide-Ⅰ-mulberrysilk吸收峰变化快慢的顺序为:1 658 cm-1(α-helix-mulberry silk)>1 624 cm-1(βsheet-mulberry silk)>1665cm-1(random coil-mulberry silk).

