姜黄素诱导K562细胞自噬的抗瘤作用研究
于 鑫,卢发强,宗成国,张卫军,牟 锐,魏丹冰,范世珍,于波海*
(1.大连大学附属中山医院 检验科,辽宁 大连116001;2.广州中医药大学深圳医院)
姜黄素(curcumin)是从植物姜黄根茎中提取的天然多酚化合物,是姜黄能发挥药理学作用的主要成分[1]。大量研究表明姜黄素具有多种生物学功能,包括抗氧化、抗炎及抗肿瘤等特性。姜黄素可通过选择性的细胞毒性对多种肿瘤细胞产生抗瘤效应,例如,抑制结肠癌和肺癌的肿瘤细胞增殖,减缓乳腺癌和肝癌等的发展,在肿瘤的临床治疗中具有广阔的应用前景[2,3]。自噬(autophagy)是细胞内大分子和细胞器降解和循环利用的分解代谢过程,普遍存在于真核细胞中。自噬是细胞在不利存活的环境中为保持细胞完整性的生存机制,同时也可作为细胞死亡的一种方式,称为Ⅱ型程序性细胞死亡。慢性粒细胞白血病(chronic myelogenous leukemia,CML)是骨髓恶性增殖性疾病,约有95%的病例有骨髓细胞的克隆性增殖,其特征是包含Ph染色体,导致BCR-ABL融合蛋白的产生[3,4]。
研究显示姜黄素对于肿瘤细胞的主要毒性作用是凋亡,自噬可能在肿瘤的发展过程中起到双重作用:促进或抑制肿瘤细胞的死亡[4]。本课题以CML细胞系K562细胞为实验模型,研究姜黄素诱导细胞自噬在抗瘤过程中的作用,为临床治疗提供可靠的依据。
1 材料与方法
1.1 细胞株
K562细胞购自和元生物技术(上海)股份有限公司。
1.2 药物与试剂
姜黄素,3-甲基腺嘌呤(3-methyladenine,3-MA),噻唑蓝(MTT),二甲基亚砜(DMSO)购自Sigma-Aldrich公司;RPMI-1640培养基,青-链霉素抗菌液购自美国GIBCO公司;胎牛血清(fetal bovine serum,FBS)购自以色列Biological Industries公司;TRIzol试剂购自美国Life Technologies公司;cDNA合成试剂盒购自美国Thermo Fisher公司;Wsetern Blotting ECM增强显色法检测试剂盒,SDS-PAGE凝胶配制试剂盒购自武汉博士德生物工程有限公司;兔抗鼠LC3 IgG,Beclin1 IgG购自日本MBL公司;GAPDH内参抗体购自北京中杉金桥公司;蛋白质定量试剂盒购自美国Bio-Rad公司。其余试剂均为国产分析纯。姜黄素溶于DMSO,制成10mM储存液,避光保存备用。实验中对照组DMSO的终浓度均<0.1%。
1.3 主要仪器
酶标仪,垂直电泳槽,转移电泳槽(美国Bio-Rad公司);MCO-17A1二氧化碳培养箱(日本Sanyo公司);Heal Force生物安全柜(上海力申公司);7500型qPCR仪(美国ABI公司);5700型PCR仪(美国ABI公司)。
1.4 实验方法
1.4.1细胞培养
用含10%FBS和1%青-链霉素的RPMI-1640培养基培养K562细胞,置于37℃,5%CO2的培养箱中,每2-3天传代一次。
1.4.2MTT实验检测细胞增殖
取对数生长期细胞,以每孔2×104个细胞接种于96孔板,置于37℃,5%CO2的培养箱中培养24 h。弃去上清后,分别加入含5 μM,10 μM,20 μM,40 μM姜黄素的培养液,在培养12 h,24 h,48 h,72 h后弃上清,每孔加MTT(5 mg/ml)溶液20 μl,37℃培养4 h。离心后弃上清,每孔加150 μl DMSO,震荡10 min后,用酶标仪于570 nm波长处测定每孔的吸光度值。抑制自噬需加入2.5 mM 3-MA预处理3 h,再进行后续实验。设置对照组(<0.1%DMSO),空白对照组(不含细胞),实验组与对照组均设3个重复孔。细胞生存率=(实验组OD值-空白对照组OD值)/(对照组OD值-空白对照组OD值)×100%,生长抑制率=1-细胞生存率。
1.4.3Western blot实验检测自噬相关蛋白
K562细胞分别与0 μM,10 μM,20 μM,40 μM姜黄素共培养48 h,抑制自噬需加入2.5 mM 3-MA预处理3 h。收集2×106个细胞,加入预冷的细胞裂解液,冰上裂解30 min。利用Bradford对蛋白浓度进行定量,获取20 μg蛋白加入到12%SDS-PAGE的凝胶中进行电泳,内参选用GAPDH。电泳结束后将其转印至经甲醇浸泡过30 s的PVDF膜上,用5%的BSA室温下封闭1 h,加入一抗孵育12 h,洗膜后二抗孵育,电化学发光显影分析。
1.4.4实时定量PCR检测BCR-ABL融合基因
K562细胞以每孔2×106个细胞接种于6孔板,分别设置对照组(<0.1%DMSO),3-MA(2.5 mM)处理组,姜黄素(40 μM)处理组,自噬抑制组(姜黄素与3-MA),培养48 h。收集细胞,TRIzol提取总RNA,1 μg总RNA逆转录合成cDNA。qPCR反应总体积为15 μl,包括Mix7.5 μl,BCR-ABL上游引物1.5 μl,BCR-ABL下游引物1.5 μl,TaqMan探针1.5 μl,cDNA0.5 μl,去离子水2.5 μl。反应条件为95℃,10 min 1个循环;95℃,15 s和60℃,1 min 40个循环。反应结束后,对目标序列进行定量分析。
1.4.5统计学分析
使用SPSS19.0统计软件进行数据分析,结果以mean±SEM表示,组间比较进行单因素方差分析,P<0.05时具有统计学意义。
2 结果
2.1 姜黄素抑制K562细胞增殖
K562细胞与不同浓度的姜黄素培养不同的时间,结果如图1所示,姜黄素对K562细胞的增殖有明显的抑制作用,且呈剂量与时间的依赖关系。我们发现细胞与20 μM和40 μM姜黄素培养48 h,生存率显著降低,因此后续实验采用48 h作为时间点。

图1 不同浓度姜黄素对K562细胞增殖的作用
**P<0.01
2.2 姜黄素诱导K562细胞自噬
Western blot检测自噬标志蛋白Beclin1、LC3-Ⅱ和LC3-Ⅰ,结果显示,随着姜黄素浓度的增加,Beclin1和LC3-Ⅱ的表达逐渐增强(图2A),同时LC3-Ⅱ/LC3-Ⅰ的比值逐渐升高(图2B)。结果表明姜黄素可诱导K562细胞发生自噬。

图2 (A)Western blot检测自噬标志蛋白的表达 (B)不同浓度姜黄素对LC3-Ⅱ/LC3-Ⅰ比值的影响
2.3 3-MA抑制自噬降低姜黄素对K562细胞增殖的影响
MTT检测不同处理组细胞增殖情况,结果显示,与对照组相比,姜黄素处理组的细胞增殖明显降低,3-MA处理组的细胞增殖变化不大;与姜黄素处理组相比,自噬抑制组的细胞增殖显著提高(图3A)。Western blot检测自噬标志蛋白的结果显示,与姜黄素处理组相比,自噬抑制组的 Beclin1和LC3-Ⅱ的表达减弱,LC3-Ⅱ/LC3-Ⅰ的比值降低(图3B)。结果表明3-MA可通过抑制自噬来降低姜黄素对K562细胞增殖的抑制作用。
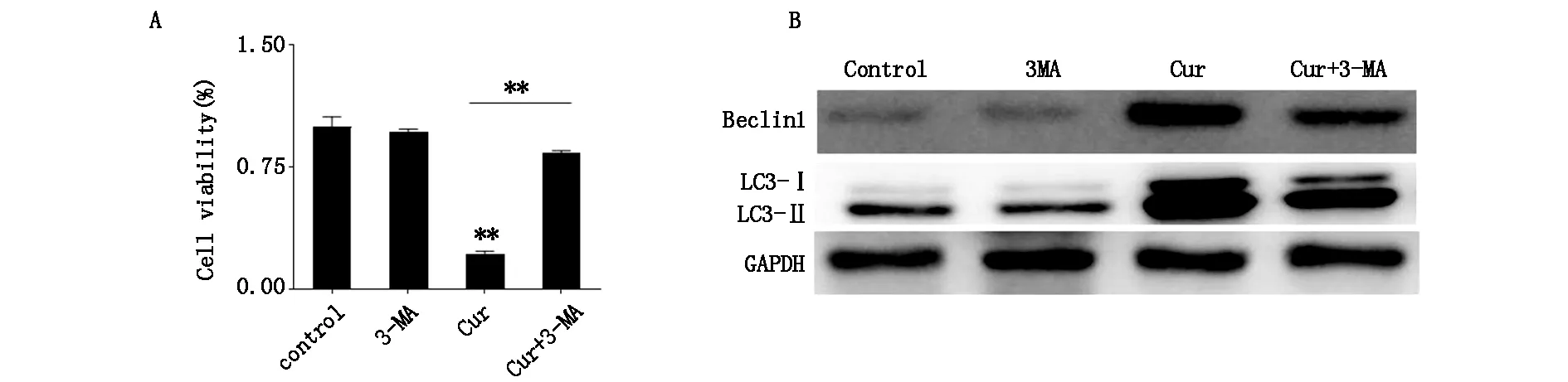
图3 (A)不同处理组的细胞增殖情况 (B)不同处理组的自噬标志蛋白表达情况
2.4 姜黄素下调K562细胞的BCR-ABL融合基因表达
qPCR检测BCR-ABL融合基因表达,结果如图4所示,与对照组相比,姜黄素处理组BCR-ABL mRNA的水平明显降低;与姜黄素处理组相比,自噬抑制组的BCR-ABL mRNA水平升高,具有统计学意义。结果表明姜黄素可通过自噬抑制BCR-ABL融合基因的表达。
3 讨论
姜黄素是一种天然的生物活性化合物,在一些国家作为食用香料和传统药物已经应用了几个世纪。姜黄素具有多种药理学作用,例如,抗炎症、抗凝血、抗氧化、清除自由基、抗动脉粥样硬化等。大量研究表明,姜黄素可对多种肿瘤细胞和肿瘤动物模型表现出抑制细胞增殖及促凋亡效应,日常服用姜黄素可提高机体的抗癌能力且安全易吸收[2,4]。有文献报道,成人每天摄入4 g姜黄素可降低结肠癌的发生率[5]。在肿瘤治疗的过程中,姜黄素作为天然物质较其他化疗药物更安全,更易进行生物降解且抗药性更小[6]。以上特性均表明姜黄素作为安全有效的抗肿瘤药物在临床治疗中具有较高的应用价值。
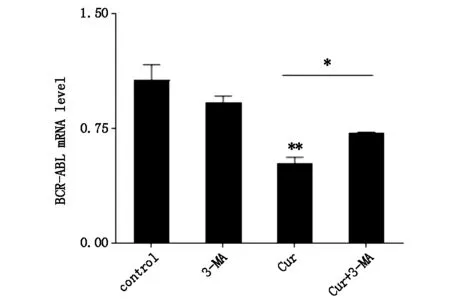
图4 qPCR检测不同处理组的BCR-ABL融合基因表达水平
CML是一种造血干细胞肿瘤,表现为髓系细胞的进行性增多及其在血液和骨髓中的聚集,其细胞学特征是位于22号染色体上的bcr基因与位于9号染色体上的c-abl基因易位融合,形成费城(Ph)染色体[3,5]。融合基因表达的BCR-ABL蛋白是一种具有酪氨酸激酶活性的融合蛋白,可激活多种下游通路导致细胞持续增殖,失去粘附作用,影响细胞分化及抑制程序性细胞死亡[7]。虽然以融合蛋白为目标的靶向治疗药物可有效治疗CML,但细胞耐药性的产生促使人们对抗药性更小的植物成分化合物展开了广泛的研究。
姜黄素抑制肿瘤细胞增殖的主要作用机制是凋亡,自噬在姜黄素引起的细胞死亡中扮演何种角色并不十分清楚。我们的研究以K562细胞为对象,分别与不同浓度的姜黄素培养不同的时间,检测细胞增殖情况。结果显示,姜黄素可以剂量和时间的依赖方式明显抑制K562细胞的增殖。为了明确自噬是否参与了姜黄素抑制细胞增殖的过程,我们加入自噬特异性抑制剂3-MA作为对照,结果发现与姜黄素处理组相比,自噬抑制组的细胞生存率显著提高,说明自噬抑制了细胞增殖。
为了进一步证实姜黄素诱导K562细胞发生自噬,我们检测了自噬相关蛋白的表达情况。Beclin1是构成自噬泡的必需成分,它的水平可以反映自噬是否发生。在自噬过程中,LC3的胞质型(LC3-Ⅰ)逐渐转变为膜型(LC3-Ⅱ),成为自噬体的一部分。所以,Beclin1和LC3-Ⅱ/ LC3-Ⅰ是用来评价自噬的标志[4]。Western blot结果表明,与姜黄素处理组相比,自噬抑制组的Beclin1表达水平和LC3-Ⅱ/ LC3-Ⅰ的比值明显降低,说明姜黄素确实诱导K562细胞发生了自噬。
有文献报道,三氧化二砷可通过自噬降低BCR-ABL融合蛋白的表达水平,抑制自噬可逆转这种效应[8]。在我们的研究中,通过实时定量PCR检测姜黄素诱导自噬对BCR-ABL融合基因表达的影响。结果显示,姜黄素可有效降低BCR-ABL融合基因的表达水平,而加入3-MA可抑制这种效应,说明姜黄素可以通过自噬调节BCR-ABL融合基因的表达。
尽管作了大量的研究,姜黄素抗瘤的具体分子机制仍不清楚。姜黄素的主要细胞毒性作用是凋亡,但凋亡与自噬之间具有复杂的联系,可能相互影响与促进。目前认为,姜黄素可通过调节细胞内信号通路的相关基因表达来发挥抗瘤作用,如NF-κB,蛋白激酶B(AKT),有丝分裂原活化的蛋白激酶(MAPK),p53等[9]。有研究表明,姜黄素作用于K562细胞,可使BAX和生存素持续表达,同时损害抗凋亡蛋白BCL-2和XIAP,导致细胞周期停滞,从而触发细胞凋亡性死亡[3];姜黄素可通过抑制PI3K/Akt/mTOR通路调节细胞凋亡和自噬发挥抗瘤作用[4];姜黄素与K562细胞共培养,可导致PTEN的水平升高,AKT的磷酸化以及VEGF的表达和释放降低,通过升高细胞内的miR-196b水平来下调BCR-ABL的表达[7]。
综上所述,我们的研究结果表明,姜黄素可通过诱导自噬下调BCR-ABL融合基因的表达水平并抑制K562细胞增殖。在之后的工作中,我们将着手研究姜黄素发挥抗瘤效应的可能分子机制以及在此过程中凋亡与自噬的相互作用,进一步为CML的临床治疗提供理论依据。

