子宫内膜癌组织中AEG-1的表达及与微血管生成的关系
赵书珍,杨艺全,司军英,杨晓萍,李 薇
(1.冀中能源峰峰集团有限公司总医院,河北 邯郸056000;2.邯郸市第三医院,河北 邯郸056000;3.邯郸市中心医院,河北 邯郸056000)
子宫内膜癌(EC)是妇科肿瘤死亡重要原因[1],目前有关EC的发生机制尚不完全清楚。星形胶质细胞上调基因1(AEG-1)由HIV-1或TNF-α诱导[2],已在人类多种肿瘤中有所研究。AEG-1不仅在细胞生长的各个重要阶段都发挥作用,如增殖、转移及EMT[3],与此同时,还参与调节并加速肿瘤血管形成[4],目前此方面的研究主要集中在非小细胞肺癌[5]和乳腺癌[6],但有关AEG-1与EC的关系尤其是涉及微血管生成方面研究未见报道。因此本研究采用免疫组织化学染色法检测EC肿瘤组织中AEG-1、VEGF及肿瘤微血管内皮标志物( CD34)的表达,并对其相关性进行分析,为EC临床诊断及治疗寻找有效靶点。
1 资料与方法
1.1 临床资料
本实验选取64例邯郸市妇幼保健院EC患者癌组织手术标本,术后诊断均经病理证实。患者术前术后除接受EC手术外,均未行其他治疗。以医院同期35 例良性子宫肌瘤行子宫切除术患者正常组织做为对照组。患者均获得知情同意书,并通过医院伦理委员会批准。
1.2 免疫组织化学染色法
组织石蜡包埋、切片及脱蜡,0.3%双氧水消除内源性过氧化物酶活性,结束后倾去残液即可,热源修复抗原后BSA封闭,时间到达后轻轻甩去载玻片上残余液体。随后37℃温育一抗90 min,本实验中应用的抗体均购买于北京ZSGB(兔抗人AEG-1或VEGF多克隆抗体及鼠抗人CD34 单克隆抗体),注意一抗温育后室温下恢复几分钟再进行PBS冲洗。随后二抗孵育20 min,根据DAB试剂盒说明进行配液后进行显色3-5 min并观察。
1.3 免疫染色评估
根据染色比例和染色强度评估子宫内膜癌组织中AEG-1和VEGF蛋白的表达。将细胞呈黄色或棕色定为阳性细胞。阳性细胞百分比评分:<25%为0;25%∽50%为1;50%∽75%为2;> 75%为3。阳性强度评分:无染色0;淡黄色1;棕黄色2;显微镜下取不同视野仔细确定染色情况,染色百分比*强度评分=染色程度。根据染色程度分数进一步确定AEG-1在组织中表达情况,即≤2阴性染色即低表达,阳性染色≥3即高表达。
1.4 微血管密度 (MVD) 评估
采用血管内皮标志物CD34进行染色,Weidner法计数评估。将染成棕黄色的内皮细胞(簇)视为单个计数血管,显微镜下5视野平均值定为MVD 。
1.5 蛋白印记法(Western blot,WB)
样本冰上匀浆裂解,预冷离心机后15000转/次离心两次,取上清液。BSA蛋白定量后,按照标准蛋白量做出标准曲线,并计算各个样本蛋白含量,配置出标准液,随后进行蛋白变性备用。根据蛋白大小不同配置不同浓度的胶,恒压条件下90v凝胶电泳分离蛋白并转PVDF膜90分。牛奶封闭后一抗(1∶1000)4℃过夜,次日二抗(1∶1500)室温2 h。冲洗后显影液AB液1∶1暗盒混匀,将膜浸泡在黑暗处显影液中2 min,操作曝光仪进行曝光、拍片及统计。
1.6 统计学方法
2 结果
2.1 子宫内膜癌组织中AEG-1呈高表达
应用免疫组化法观察了EC组织中AEG-1表达。由图1a,1b可见,AEG-1阳性表达主要在细胞质中,阳性表达率可达76.6%(49/64)。正常组织中AEG-1表达呈弱染色,阳性表达率22.9%(8/35),两组差异显著(P<0.05)。此外,WB结果也发现AEG-1在EC组织中表达显著高于对照组(P<0.05)。以上结果表明,AEG-1在EC组织中呈高表达。
2.2 子宫内膜癌组织中AEG-1表达与临床病理特征相关性
将AEG-1在EC组织表达情况与临床病理特征进行了统计分析(表1)。AEG-1 表达与肿瘤组织分级、FIGO分期及淋巴结转移显著相关(P<0.05),而与患者年龄和肌层浸润无相关性(P>0.05)。

图1 AEG-1在组织中表达情况。 免疫组化检测EC组织(a)和正常组织(b)中AEG-1表达。WB比较AEG-1在两种组织中表达(c),#P<0.05。
2.3 子宫内膜癌组织中AEG-1与VEGF表达相关性
通过免疫组织化学发现EC组织中VEGF在细胞质和细胞膜均有表达(图2a,2b),图2c所示,AEG-1高表达(hAEG-1)组织VEGF蛋白表达量明显高于低表达(lAEG-1)组织(P<0.05),同时,表1也可看出,VEGF阳性率在hAEG-1组织中表达显著,二者呈正相关(P<0.05)。
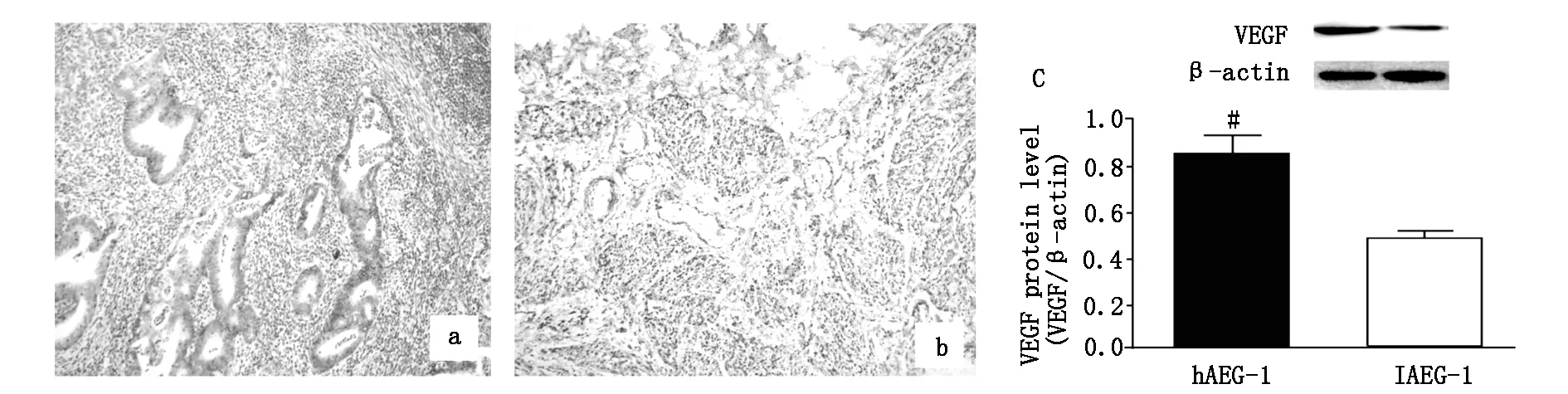
图2 VEGF在组织中表达情况。免疫组化检测VEGF在hAEG-1组织(a)和lAEG-1组织(b)表达;WB比较VEGF在两种组织中表达(c),#P<0.05。
2.4 子宫内膜癌组织中AEG-1与MVD相关性
如图3 所示,在AEG-1高表达EC组织中CD34表达强烈,呈棕黄色颗粒主要在细胞质中,MVD为24.59±6.82,而CD34在AEG-1低表达EC组织中表达较弱MVD为52.18±10.43,AEG-1高表达组织中MVD水平显著高于低表达组织,二者呈正相关(P<0.05)。
3 讨论
AEG-1在多种癌症中已发现显著过表达,且与不同临床特征如肿瘤分期、类型及转移紧密相连。例如,非小细胞肺癌组织AEG-1过表达,与肿瘤分级和淋巴结转移相关[5]。Liu L 等[7]发现AEG-1 在子宫颈癌中表达出现显著增加,并与临床分期和病理分级呈正相关。提示,AEG-1可从临床不同方面调控多种癌症的产生及后续的延伸。不仅如此,Dong L[8]在其有关胃癌相关研究发现,癌组织中AEG-1在基因及蛋白水平均发生上调,并与多种病理特征显著相关。与上述结果相似,本研究发现,EC组织AEG-1阳性表达显著高于正常组织,且与肿瘤FIGO分期、组织分级及淋巴结转移有关。这表明,AEG-1高表达在EC发生发展中起到至关重要的作用。提示AEG-1提高可作为EC早期诊断及预防的预测靶标。
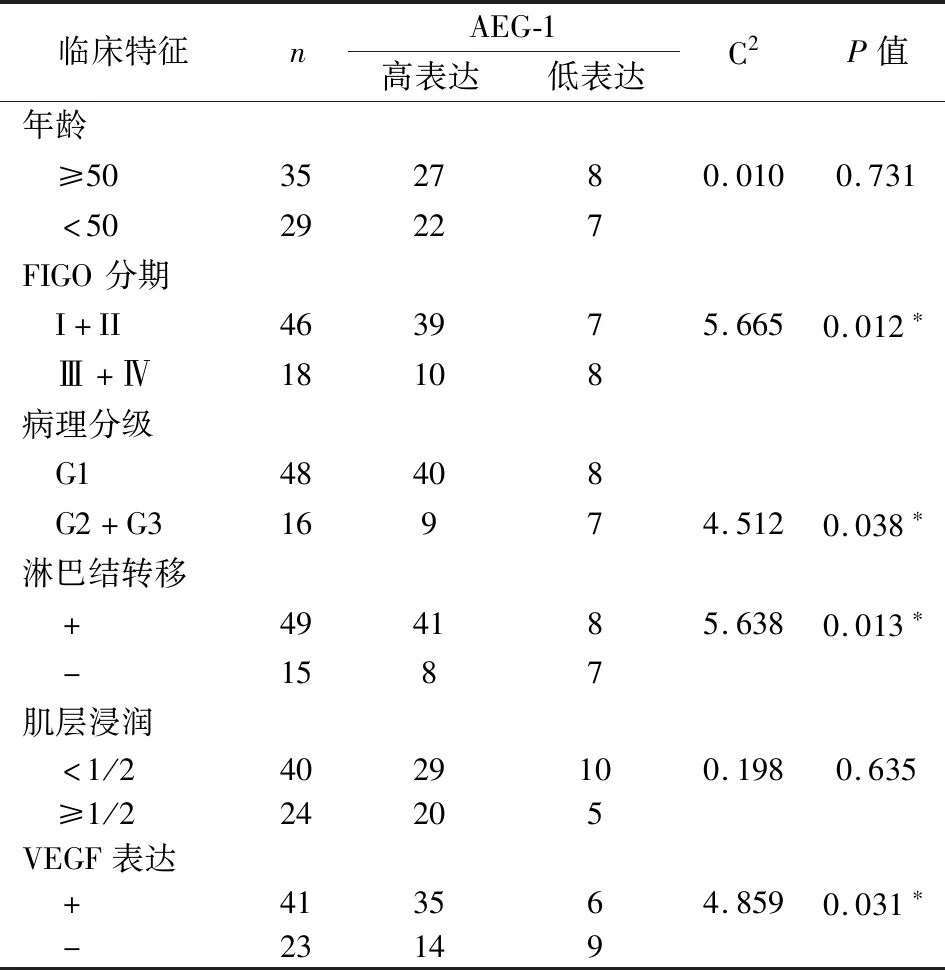
表1 EC肿瘤组织中AEG-1表达与患者临床病理特征比较(例)

图3 CD34在组织中表达情况。免疫组化检测hAEG-1组织(a)和lAEG-1组织(b)中CD34表达;两组织中MVD结果比较(c),#P<0.05。
众所周知,血管生成与肿瘤发生发展密切相关,因此,抑制血管生成可作为肿瘤防治的有效途径。VEGF作为重要诱导剂,可通过改变血管细胞生理特性促进血管生成。很多研究认为肿瘤细胞增殖、侵袭及转移的能力可被VEGF提高,因此,VEGF成为肿瘤发生发展重要调控因子[9]。此外也有研究发现AEG-1高表达可增加微血管密度,这一机制可能与激活PI3/Akt通路,增加HIFI表达,间接提高VEGF水平有关[10]。本研究也发现,在AEG-1高表达组,VEGF表达及MVD微血管生成量明显增多,且AEG-1表达与VEGF及MVD水平呈显著正相关,提示在EC中,AEG-1可能通过增加VEGF表达及微血管生成调节EC肿瘤的发生和发展,但其具体调控机制有待进一步研究。
综上所述,AEG-1不仅参与EC的发生与发展还发挥重要的调节作用,这一过程与肿瘤相关血管生成紧密相连。因此,临床在EC治疗上可将靶抑制AEG-1表达作为有效手段和途径。

