碳材料在电化学催化还原CO2领域的应用
郝 健, 夏洪强, 郭庆杰, 陈君飞
(宁夏大学 省部共建煤炭高效利用与绿色化工国家重点实验室,宁夏 银川 750021)
随着人类对化石能源需求和人类活动的日益增长,温室气体在大气中的含量急剧升高,严重破坏了生态系统平衡[1-2]。在众多温室气体中,CO2对温室效应的贡献最大,超过50%。因此,如何有效地解决由CO2排放造成的温室效应和环境问题已成为人类可持续发展的前提。CO2不但是引起全球温室效应的主要气体,同时也是储量丰富的化工原料,可用于合成多种精细化学品及化学染料[3-6]。通过化学转化实现CO2的资源化利用,不仅可以固定CO2,降低大气中CO2的含量,还可以获得多种高附加值的化工产品和化学燃料。若使用可再生能源驱动该过程,更可减少生产过程对环境和能源的影响[7-8]。电化学催化CO2还原法因其具有操作条件相对温和(常温、常压)、设备简单、反应过程易于控制、转化率高、可利用洁净可再生能源(如太阳能、风能)以及电化学反应系统紧凑灵活、可模块化、易于放大生产等优点,已引起国内外研究人员的广泛兴趣[9]。
最早的关于CO2电化学还原研究可以追溯到 19 世纪。CO2电还原过程比较复杂,反应速率较慢,在不同的电极材料、还原电位、溶液及pH值等反应条件下,生成的产物多种多样。然而电还原催化剂始终是CO2电化学还原技术发展的核心及根本,决定了催化反应的机理、反应速率及产物分布[10-11]。目前,电还原CO2催化材料可分为金属及其复合材料、碳材料、有机材料和生物催化材料。至今,绝大部分金属几乎均被纳入实验范围,其相关研究的综述文章也较多。金属催化剂普遍存在着成本高、适应性差及由于活性组分溢出而导致的稳定性差等问题。非金属材料,尤其是碳材料,因其来源广泛、价格低廉、组成可控、能量效率高和稳定性优异等特点吸引了众多研究者的关注。近几年来碳基催化剂的研究取得了较大进展,但此研究方向的综述总结较少。笔者从制备方法、催化性能、催化过程及活性位点等方面综述了碳基催化剂在电催化还原CO2领域的应用研究,归纳总结碳基催化剂的发展趋势。
1 电化学催化还原CO2机理
在电化学催化还原过程中,CO2直接在阴极表面上发生催化加氢反应。电化学催化还原CO2的机制极其复杂。CO2电化学还原反应在不同电催化剂表面可以通过使CO2失去2、4、6和8个电子来完成。在中性水溶液中,在不同的标准电极电势下,电化学催化还原CO2可得到各种不同的化合物,如CO、CH4、C2H4、HCOOH、CH3OH和CH3CH2OH等,如表1所示。一般情况下,CO2电化学催化还原产物并不是单一物种,而是混合物。其选择性和转化率取决于电极材料种类、催化剂性质、电解质溶液及外加电压等诸多影响因素[12-13]。其中,催化剂种类对还原产物的影响最为敏感:以Pb、Hg、In、Sn、Cd、Bi、Hg/Cu、Sn-Cd和Sn-Zn等为催化剂,主要还原产物为HCOOH;以Au、Ag、Zn、Pd、Ga和 Ni-Cd 等为催化剂,主要还原产物为CO;以Ni、Fe和Pt等为催化剂,主要产物为H2;Cu为催化剂的主要产物为CO、烷烃、醇和酸等。因此,开发具有高催化活性、高选择性和高稳定性的CO2电化学催化还原催化剂,一直是该领域研究的重点和热点。相对于金属价格高和储量低的不足,碳基催化材料,因其来源广泛、价格低廉、形貌组成可控、比表面积大、析氢过电位高及稳定性好等特点,成为CO2电化学催化还原催化剂的研究重点。

表1 CO2电化学催化还原反应在中性水溶液中的电极电势和对应产物[9]Table 1 Selected standard potentials of CO2 electroreductionhalf reactions in aqueous solution[9]
2 碳基催化剂制备
1997年Hara等[14]发现,在高压条件下玻碳电极表面可以直接发生CO2还原反应,其产物包括CO、HCOOH和少量烃。近年来,随着纳米技术的迅速发展,碳纳米材料被发现具有良好的电化学催化潜力。其主要包含有碳纳米管[15]、碳纳米纤维[16]、石墨烯[17]、多孔碳材料[18]、纳米碳基复合材料[19]及特殊形貌纳米碳材料(如纳米金刚石[20]和介孔碳材料[21])等。研究发现,碳基催化材料优异的催化性能与杂原子掺杂有着密切联系。Zhang等[15]发现,纯碳纳米管可以将CO2还原为HCOOH,其法拉第电流效率为5%,然而氮掺杂碳纳米管的法拉第电流效率可提高到59%。当氮元素掺杂质量分数为7%时,碳纳米管的电催化法拉第电流效率达到最大。因此,制备杂元素(氮、硼及硫)掺杂碳基催化剂一直是CO2电化学催化还原领域重要的研究方向。
目前,杂元素(以氮元素为例)掺杂技术主要包括:(1)前掺杂或原位掺杂,即在石墨结构形成时同步掺入氮原子,如气相沉积法(CVD)。该方法可获得较高的氮含量,而且氮掺杂量及掺杂类型可以通过氮源种类和反应温度进行调控。Liu等[20]发现,当CVD反应温度为450 ℃和550 ℃时,均可获得微观形貌相似的氮掺杂纳米金刚石材料(NDD)。但是,反应温度为450 ℃时所制备的材料含有更丰富的N-sp3结构。(2)后掺杂,即通过对碳材料进行氧化、热解和取代等后处理掺入氮原子,后掺杂时碳材料石墨层早已形成,因此氮原子无法进入,因此获得的氮原子掺杂量相对较低。Zhang等[15]利用氨等离子体技术制备氮掺杂碳纳米管,其氮掺杂量可以通过等离子体功率强度、腔室压力和反应时间进行调控。(3)直接热解法,通过直接热解含氮前驱体,获得氮掺杂碳材料。如热解生物质材料,获得氮掺杂多孔碳材料。但是高温热解容易导致活性氮大量损失,无法控制碳材料微观孔径结构。由此可见,开发杂元素掺杂量及种类可控的高效制备方法对提升材料电化学催化性能具有积极影响。目前,一些辅助CVD法(如微波、等离子体及热场)等新型制备方法已经被应用于杂元素掺杂碳材料制备领域。
3 碳基催化剂性能
3.1 碳纳米纤维、碳纳米管基催化剂
Kumar等[16]碳化聚苯胺获得直径500 nm的碳纳米纤维,该材料可在0.17 V电势下催化CO2还原为CO,法拉第电流效率可达98%。Wang等[18]制备的氮掺杂纳米多孔碳/碳纳米管复合材料可以将CO2还原为HCOOH,法拉第效率为81%,研究者认为该材料优异的催化性能主要取决于材料的分级孔结构和高导电性。Lu等[19]将石墨碳氮化物与多壁碳纳米管共价复合(g-C3N4/MWCNT)电化学催化CO2还原为CO,该材料的催化活性在反应50 h后并未出现衰减。值得注意的是,杂原子掺杂的碳基催化剂可以表现出比金属催化剂更为优异的电化学催化性能。Zhang等[15]报道的PEI-NCNT材料,可以将CO2电化学催化还原为HCOOH,如图1 所示。其电流密度为9.5 mA/cm2,催化性能与Sn催化剂相当。这是由于PEI层通过氢键作用稳定反应中间体CO2·-,可以降低CO2转变为CO2·-过程的反应电势。

图1 不同结构CNT催化剂的阴极线性伏安扫描曲线和甲酸产生法拉第电流效率[15]Fig.1 Cathodic linear sweep volt ammetry and Faradaic efficiencies for HCOOH of different CNT catalysts[15](a) Cathodic linear sweep volt ammetry;(b) Faradaic efficiencies for HCOOH
Kumar等[16]研究发现,氮掺杂碳纳米纤维的电流密度为块体银电极的13倍、是纳米银电极的4倍,同时其CO2最高还原电位为0.17 V,低于银纳米电极。Wu等[22]制备的氮掺杂碳纳米管阵列过电位为0.18 V,低于大部分金属纳米粒子催化剂。目前,氮掺杂碳纳米管电催化还原CO2的产物主要为CO,其法拉第电流效率主要分布在60%~98%[18,23-24]。
3.2 石墨烯基催化剂
除碳纳米管材料展示出优异的电化学催化性能外,石墨烯类催化剂近几年也获得了许多研究成果。Sun等[17]研究发现,石墨烯在CO2水溶液体系中电催化的产物主要为H2,而氮掺杂石墨烯(NGMs)则可以在水溶液体系中将CO2还原为CH4,其法拉利电流效率高达90%。进一步将氮掺杂类石墨烯碳与碳纸复合,可以将CO2还原为CH4的法拉第电流效率提高到94%,电流密度为相同测试条件下铜电极的6倍。Wu等[25]制备的氮掺杂石墨烯泡沫在 -0.47 V 下可将CO2催化还原为CO,其法拉第电流效率为85%,其电化学催化性能优于贵金属催化剂金纳米粒子及银纳米催化剂。Wang等[26]报道了氮掺杂石墨烯可以在-0.84 V下将CO2催化还原为HCOOH,如图2所示。其法拉第电流效率为73%,催化性能优于PEI-NCNT(优于Sn)。该催化剂持续催化12 h,电流密度和法拉第电流效率均保持不变。
Zhu等[27]制备的氧化石墨烯-碳纳米管-碳布复合材料在离子液体/乙氰电解质溶液中可以将CO2电催化还原为CO,其法拉第电流效率为85%,电流密度为2.3 mA/cm2。研究发现,除氮掺杂外,硼掺杂的石墨烯也具有催化性能。Sreekanth等[28]在惰性气氛下高温热解氧化石墨烯和硼酸混合物制备了硼掺杂的石墨烯材料,硼原子摩尔分数为4.1%。该材料可以将CO2催化还原为HCOOH,其还原电位为-1.4 V,法拉第电流效率为66%。然而在相同条件下测试Bi催化剂的法拉第电流效率仅为20%。

图2 N-石墨烯催化剂的LSV扫描曲线、甲酸产生的电流密度与电极电势关系曲线、甲酸的法拉第电流效率曲线和法拉第电流效率稳定性曲线[26]Fig.2 LSV scans, partial current density of formate versus applied electrode potential,Faradaic efficiencies for formate, and long-term durability of N-graphene catalyst[26](a) LSV scans for N-graphenes catalyst in Ar or CO2 saturated 0.5 mol/L KHCO3; (b) Partial current density of formate versus appliedelectrode potential; (c) Faradaic efficiencies for formate; (d) Long-term durability of N-graphenes operated at -0.84 V for 12 h
3.3 其他杂原子掺杂碳基催化剂
另外,其他类型的碳材料也被应用于CO2电催化还原反应。Liu等[20]利用微波等离子体化学气相沉积法在硅纳米柱阵列表面沉积氮掺杂纳米金刚石,获得了氮掺杂纳米金刚石/硅纳米柱阵列(NDD/Si RA)。研究发现,该材料在-0.8 V~-1.0 V电压区间内可以将CO2催化还原为CH3COOH,其法拉第电流效率高达91.2%~91.8%。Song等[21]利用氮掺杂介孔碳圆柱(c-NC)为催化剂,实现了电催化还原CO2为CH3CH2OH。该催化剂的选择性接近100%,法拉第效率为77%。对比孔径结构相同的c-NC与氮掺杂介孔碳材料(i-NC),发现微观形貌严重影响氮掺杂碳基催化剂的电化学催化性能。如图3所示,i-NC催化剂产生CH3CH2OH的法拉第电流效率远远低于c-NC。

图3 在各个应用电势下,c-NC和i-NC催化剂上的CO2电还原产物的法拉第电流效率[21]Fig.3 Faradaic efficiencies of CO2 electroreduction productsover c-NC and i-NC catalysts at various applied potentials[21]
Liu等[29]采用CVD法制备了氮硼共掺杂的纳米金刚石材料。该材料可将CO2电催化还原为CH3CH2OH,法拉第电流效率为93.2%,材料如此突出的电催化能力主要取决于氮、硼元素的共掺杂协同作用。通过DFT计算,笔者认为CO2催化还原反应路径可能为(图4):Nakata等[30]发现,P型硼掺杂的纳米金刚石可以将CO2催化还原为HCHO,其法拉第电流效率为74%,高于在相同测试条件下金属催化剂Cu,Ag或Sn的催化性能。此外,P型硼掺杂的纳米金刚石材料在腐蚀性海水电解质中仍具有非常稳定催化性能。同时,研究发现,利用生物质制备的多孔碳材料同样也具备CO2电催化还原性能,为农业废弃生物材料的高值化利用提供了新的思路。其中由稻壳制备的多孔碳材料可以将CO2催化还原为CO,法拉第电流效率为84%[31]。由木材为原料制备的多孔碳材料同样也可以将CO2催化还原为CO,其法拉第电流效率为40%[32]。

图4 BND(111)面上CO2还原的自由能图和CO2还原基本步骤中产物结构[29]Fig.4 Free energy diagrams and energetically favorablestructures for elementary steps of CO2 reductionon (111) facet of BND[29](a) Free energy diagrams for CO2 reduction; (b) Energetically favorable structures for elementary steps of CO2 reduction on (111)facet of BND (gray —C, pink—B, blue—N, red—O, white—H)
3.4 碳基催化剂性能总结
以上研究均证实了杂元素掺杂对碳基催化剂材料性能的提升作用。表2为部分杂元素掺杂碳基催化剂的性能总结,包括催化反应溶剂(电解液)、催化产物及法拉第电流效率。在电解液方面,目前电催化CO2还原体系的溶剂以水溶液(KHCO3、NaHCO3)为主,然而水介质中存在严重的析氢现象,影响CO2在电催化剂上的还原选择性。研究发现,使用离子液体作为电解液不仅可以提高CO2的溶解,同时还可以有效避免析氢反应。其中咪唑类离子液体,在CO2电还原过程中可以与CO2形成中间体[CO2-EMIM],降低CO2还原电势,有利于CO2电还原反应进行[33]。同时,大量研究证实,离子液体-水体系由于增加了质子含量,在提升CO2电还原反应效率上起到明显增强作用[34-35]。因此,以离子体-水体系为电解液进行氮掺杂碳材料的CO2电催化还原反应,有利于获取更高的电流效率,进而可提升整个体系的转化效率。目前,大部分碳基催化剂的法拉第电流效率分布在80%~90%。在产物分布方面,氮掺杂碳基催化剂的产物主要为CO,也有部分催化剂的催化产物为CH3CH2OH、HCOOH和CH4等。但是对影响催化产物分布的因素目前还不明确,因此研究杂元素掺杂碳基催化剂材料的催化机理对提高碳基催化剂性能有至关重要的作用。
4 碳基催化剂电化学催化还原CO2活性位点及反应过程
目前,研究者们对氮掺杂碳基材料催化活性位点的认知尚未统一,对影响催化剂选择性的因素也尚不明确。普遍认为,催化活性位点的产生是由于杂原子的引入破坏了碳结构电子平衡,进而引起电子重新分配所导致的。其活性位点可以是掺杂到碳骨架中的吡啶氮、吡咯氮、石墨氮或电正性碳原子,氮元素掺杂示意图如图5所示。

表2 碳基催化剂电催化CO2性能总结Table 2 Carbon catalysts performance in CO2electrochemical reduction reaction
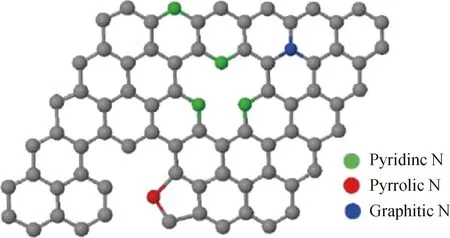
图5 石墨结构中氮元素掺杂结构示意图Fig.5 Schematic representation of differenttypes of N in carbon matrix
2013年,对氮掺杂纳米碳纤维(CNF)的研究,首次提出与氮相邻的碳原子可以起到有效催化活性位点作用。氮元素捕获碳原子上的电子从而产生具有氧化性的碳原子,氧化性碳原子在循环过程中会被还原为还原性碳原子,然后再将CO2吸附在还原性碳原子上对其进一步氧化,如此循环起到催化作用[16]。然而,具有氧化性的碳原子作为活性位点在某种程度上被研究者们所质疑,一些报道证实,氧化的CNF在CO2电催化中不产生任何有价值的产物,其产物主要为H2。因此,氮掺杂碳基催化剂活性位点的研究引起了科研工作者的广泛关注。2015年Sharma等[36]使用氮掺杂碳纳米管(NCNT)作为催化剂,在低过电势(-0.18 V)下高效还原CO2为CO,并详细研究了NCNT的催化活性位点问题。研究发现,NCNT的催化活性取决于碳纳米管与氮结构中的缺陷密度。与原始碳纳米管相比,石墨氮和吡啶氮可显著降低反应过电位,有效提高产物选择性,使得产物向CO的形成方向转化,是催化反应的活性位点。吡咯氮则对催化活性的影响较小。实验结果与DFT计算一致,证实形成反应中间体COOH*的能垒顺序为吡啶氮最低,其次为吡咯氮和石墨氮,如图6所示。这是由于吡啶氮具有孤对电子,能与CO2成键而使之活化。石墨氮电子位于p反键轨道中,使得其与CO2结合力弱于其与吡啶氮的作用。吡咯氮由于几何构型缺陷,使得氮原子转向碳纳米管的内部,导致电子很难与CO2接触,无法暴露活性位点。
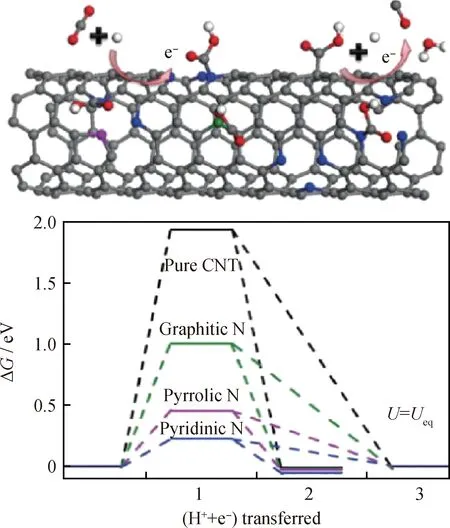
图6 在不同氮掺杂CNT和纯CNT上CO2电催化还原为CO的示意图和平衡电势下的自由能图[36]Fig.6 Schematic illustration of CO formation and thefree-energy diagram at equilibrium potential for CO2reduction on different nitrogen configurations andpristine CNT[36]
Wu等[25]对石墨烯进行了不同类型的氮掺杂,并研究了三维氮掺杂石墨烯电催化还原CO2为CO的过程。研究人员认为,吡啶氮是活化CO2分子的关键位点。Chai等[37]利用密度泛函理论(DFT)和从头算分子动力学计算CO2在氮掺杂石墨烯/碳纳米管电极上的电化学过程,发现氮掺杂和石墨烯曲率的相互作用可以有效地调控石墨烯/碳纳米管(CNT)催化剂的活性及选择性。其中材料的曲率对催化剂的选择性有重要作用,材料吸附催化CO2的自由能变化,如图7所示。石墨结构曲率程度较低更容易催化产生CO和HCOOH,(6,0)CNT具有较大的曲率结构更倾向催化产生HCHO和CH3OH。

图7 Edge-2gN石墨烯催化剂反应过程自由能变化和Edge-2gN(6,0)CNT催化剂反应过程自由能变化[37]Fig.7 Free energy variations between intermediates for Edge-2gN graphene and free energy variationsbetween intermediates for Edge-2gN(6,0) CNT[37](a) Free energy variations between intermediates for Edge-2gN graphene catalyst; (b) Free energy variations between intermediates for Edge-2gN(6,0) CNT catalystThe “*” represents an active site. The unit of free energy is eV.
在石墨烯材料研究中,Wang等[26]认为,氮掺杂石墨烯催化活性位点为与吡啶氮相连的碳原子。Sun等[17]研究了NGMs催化还原CO2为CH4的反应,联系材料法拉第电流效率,认为吡啶氮和吡咯氮均为催化活性位点。Chai等[37]研究了CO2吸附于氮掺杂石墨烯上的吸附能,发现石墨氮和吡啶氮都可以激活CO2吸附,能垒分别为0.72和0.84 eV。研究认为,氮掺杂碳基催化剂的催化性能不仅与掺杂原子的掺杂类型有关,同时也与杂元子掺杂在碳材料上的位置有关。Keith等[38]使用Kohn-Sham密度泛函理论和原子热力学研究CO2在氮掺杂石墨烯片和纳米带上的电化学反应热力学问题,计算结果显示,氮原子的掺入,有利于氢原子接触到CO2进而促进CO2还原反应的进行,对比氮原子掺杂在石墨烯基面,缺陷位及纳米带锯齿形边缘位置的能垒,发现氮原子掺杂在纳米带的锯齿形边缘位是最有可能的催化活性中心。对氮掺杂纳米金刚石材料(NGQDs)的实验研究表明[39],当氮元素位于基面时,材料具有更负的起始电位和较低的C2产物选择性,同时材料的反应速率也会低于氮元素位于边缘位的催化剂。因此,在边缘位置的氮比基面上的氮具有更活跃的催化性能,来诱导C—C键的形成,增加多碳含氧化合物的生成。总的来说,氮掺杂碳基催化剂的活性位点主要有吡啶氮、石墨氮和与氮掺杂剂相邻的碳。现在研究者们大多数认为,吡啶氮最有可能是真正的活性中心。因为CO2电催化还原反应从吸附CO2开始,CO2与催化剂之间强烈的相互作用是影响催化反应的重要因素。研究结果表明,吡啶氮和CO2分子间有较强的酸碱相互作用,故而其有可能是最活跃的催化剂活性位点。此外,研究者们推测吡啶氮具有较强碱性位点,可以起到稳定CO2电催化还原过程中重要中间体CO2·-的作用[40]。
CO2催化还原过程复杂,产物分布广泛。通常研究者们都认为该过程的限速步骤是第一次电子转移即CO2分子形成CO2·-。Zhang等[15]研究了PEI-NCNT材料的电化学催化反应动力学,其中NCNT的Tafel斜率为142 mV/dec,PEI-NCNT的Tafel斜率为134 mV/dec,均接近于单电子转移限速步的118 mV/dec。研究者们发现,氮掺杂石墨和碳量子点的Tafel斜率也同样接近118 mV/dec[22,39,41]。Wu等[22]通过DFT计算发现,中间体COOH*的形成在CO2被活化之后。这一步骤与第1次电子转移过程中的化学势升高有关。在此之后,自由能在热力学上呈现下降趋势,伴随着第2次的电子转移过程,形成CO。因此,形成和稳定高能中间体COOH*是实现高速率和高能效CO2电催化过程的关键。中间体COOH*和CO2·-的形成可能分别是CO2电催化还原过程中热力学和动力学限速步骤。研究发现,稳定反应中间体对催化反应选择性有重要影响。Sun等[17]提出CO和氮掺杂位间存在强烈的相互作用,可防止CO从电极中逸出,进而促进CH4的生成。Wu等[22]发现,NCNT与反应中间体COOH*间存在强烈的相互作用,可促进CO的生成。Liu等[42]研究发现,CO2加氢COOH*吸附于吡咯氮上相比其吸附在吡啶氮和石墨氮上更容易进行,氮掺杂类型可提高产物选择性。
尽管所有的DFT计算均显示氮掺杂可以明显提高碳基催化剂的电化学催化性能,但是当前没有一种统一理论能够解释氮掺杂碳基催化剂催化机理的所有现象。研究者们在氮掺杂碳基催化剂催化作用产生条件上已形成共识,即碳骨架中的氮掺杂位为活性中心,催化剂的选择性取决于材料微观形貌。但有两个问题应当引起重视:第一,非金属程度。实验室制备碳纳米材料(碳纳米管和石墨烯等)的过程中通常会加入金属催化剂。后续洗涤很难将其彻底去除,一般的表征手段,如XPS和XRD等,并不能检测到微量或痕量的金属残留。然而在催化过程中,极少量的残留金属对催化性能有极其明显的影响。第二,产物中碳元素来源。由于杂元素掺杂碳材料中大部分的元素为碳,常规检测催化产物时,并不能区分产物中碳元素的来源是来自于CO2还是碳基催化剂。因此,碳基催化剂的性能仍需要进一步研究,并借助同位素标记等方法来确定催化剂性能。
5 碳基催化剂的发展趋势
尽管在碳基催化剂性能和催化活性位点等方面存在着一些争议,但是现在研究者们普遍认为杂原子掺杂对提升碳材料催化性能有积极的作用,而且研究发现,杂原子掺杂的碳纳米材料催化剂相比金属催化剂具有更高的电流密度、法拉第电流和稳定性。这是由于杂原子掺杂改变了碳材料原有的电子结构和几何形状,产生了吸附CO2分子的活性位点,同时为产生电催化还原反应中关键中间体提供了活性位点。在产物分布方面,目前已经检测到CO、HCOOH、HCHO、CH3COOH、CH3CH2OH、CH4及一些C3含氧化合物等。产品的分布主要取决于催化剂具体的纳米结构和化学成分。值得注意的是,纳米碳材料中少量的金属残留物更可以显著提高CO2电催化还原反应的法拉第电流效率和电流密度,因此要谨慎判断所谓的“无金属”催化剂。
虽然碳基催化剂具有较为优异的性能,但CO2电化学还原技术面对实用化和工业化应用,仍然有很多关键问题亟需解决。首先,催化剂活性低。其次,产物选择性差。目前,一部分催化剂得到的产物常是混合物。再者,催化剂稳定性低。因此,开发具有高催化活性、高选择性和高稳定性的CO2电催化还原电极材料仍是CO2电化学还原技术发展的核心及根本。结合碳基催化剂研究进展,笔者总结提出碳基催化的几个发展方向:
(1)制备新型掺杂纳米结构碳催化剂。增加杂元素含量,调控杂原子的掺杂形态和位置,利用有效的合成方法制备性能优异的催化剂材料,如增加吡啶氮含量或在碳纳米材料边缘位上增加氮掺杂量等。此外,不同尺寸维度(一维、二维和三维)的组合和碳元素杂化形态(sp2和sp3)的调整也都可能影响材料在CO2电催化过程中的催化性能。
(2)研究反应机制。使用先进的实验方法,如利用原位技术,获取更多的反应过程信息。利用第一性原理法研究反应机理,验证实验方法无法检测和表征各种反应中间体。CO2电催化还原过程中的催化活性位点、电子结构、能垒及反应路径等研究需要借助于理论计算和实验过程相结合的方法进行详细研究。
(3)掺杂元素之间的协同作用一直是CO2还原领域的热门话题,应该进一步研究多种元素共掺杂碳基催化剂的催化性能。诸如氮、硼或氮、硫等双掺杂碳基催化剂具有提高碳基催化性能材料潜力。多元素共掺杂碳基催化剂的探索可以提供一个提高碳基催化剂性能的有效途径,为碳基催化剂材料的研发奠定研究基础和理论依据。
(4)利用新型电解液(离子液体,离子液体-有机溶剂),避免析氢反应,提高对CO2的捕捉能力,并研究电解质溶液与反应中间体间的相互作用,提高催化剂选择性。

