基于猪流行性腹泻病毒N蛋白间接ELISA抗体检测方法的建立及初步应用
杨朋霞,闫若潜,王华俊,马震原,王淑娟,赵雪丽,谢彩华,赵月龙,李 孟
(1.河南农业大学牧医工程学院,河南 郑州 450002;2.河南省动物疫病预防控制中心,河南 郑州 450008;3.河南科技大学动物科技学院,河南 洛阳 471003)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由PED 病毒(PEDV)引起的一种急性、高度接触性的肠道传染病。临床上常引起猪水样腹泻、呕吐和脱水等症状,各年龄阶段的猪均可感染,尤其对10日龄以内的仔猪危害最为严重。由于PED 经典疫苗株CV777 灭活疫苗和弱毒疫苗的广泛使用,使得PED 的流行得到一定的控制[1]。但是从2006年初开始,个别免疫过经典疫苗株的猪群开始出现免疫保护失败的情况。2010年以来,全国大部分猪场包括免疫过经典疫苗株的猪场开始大规模暴发由PEDV 变异强毒株引起的猪群腹泻疫病[2],其中以2日龄~10日龄的哺乳仔猪发病最为严重,发病率可达 100 %,病死率高达 80 %~100 %[3]。2013年Huang 等首次报道了美国PEDV 变异强毒株引起的猪群腹泻性疫病[4],之后该病迅速蔓延至 20 多个州,给美国养猪业造成了严重的经济损失。
PEDV 是冠状病毒亚科(Coronavirinae) α 冠状病毒属(Alpha coronavirus)的成员,分子量约为28 kb,为不分节段的单股正链RNA 病毒,有囊膜。该病毒基因组顺序为5'-Rep-S-ORF3-E-M-N-3'[5],其中N基因编码病毒的核蛋白,由441 个氨基酸组成,N蛋白在病毒转录复制和装配等多个生物活性过程中发挥着重要作用[6],同时该基因在PEDV 各亚型中具有较强的保守性[7]。因此,N 蛋白可以作为潜在的血清学诊断靶基因。
由于PED 的临床症状与猪传染性胃肠炎(Porcine transmissible gastroenteritis, TGE)、 猪 轮 状病毒病(Porcine rotavirus,PoRV)等很难区分,仅凭临床症状和病理剖检难以鉴别检测。目前国内检测PEDV 抗体普遍采用的是国外进口的间接ELISA 试剂盒,但其价格昂贵,无形中提高了PEDV 流行病学的检测以及临床检测的成本,难以真正的推广应用。本研究建立以原核表达的重组PEDV 变异强毒株 N 蛋白为包被抗原的间接ELISA 检测方法,为PEDV 的抗体检测提供一种实用的血清学检测方法。
1 材料与方法
1.1 病毒及血清 PEDV 变异强毒株(PEDV-HNCADC-2017)由河南省动物疫病预防控制中心实验室分离并保存(国家菌毒种保藏中心登记号:CCTCC NO:V201766);150 份 PEDV 阳性血清:PEDV 经典株(CV777)灭活疫苗免疫猪血清采自临床免疫猪,变异强毒株灭活疫苗免疫猪血清为本实验室制备,经中和试验和进口商品化间接ELISA 试剂盒检测结果均为PEDV 阳性;150 份PEDV 阴性血清采自临床未免疫过PEDV 疫苗的健康仔猪,经上述两种方法检测结果均为阴性,且血清中和抗体效价均≤1∶21.5;并从上述阴阳性血清中随机挑选两支血清分别定为阳性、阴性对照。TGE、猪圆环病毒2 型(Porcine circovirus type 2,PCV2)阳性血清为武汉科前生物股份有限公司间接ELISA 抗体检测试剂盒中的阳性对照血清;伪狂犬病毒(Pseudorabies virus,PRV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸障碍综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)阳性血清为美国爱德士(IDEXX)公司间接ELISA 抗体检测试剂盒中的阳性对照血清。500 份临床哺乳母猪血清采自河南省背景清晰的5 个规模化养猪场,有2 个猪场免疫了PEDV 经典株(CV777)灭活疫苗;1 个猪场未进行PEDV 疫苗免疫,但仔猪发生了疑似PEDV 变异强毒株引起的腹泻,通过实验室检测在病死仔猪组织中检测到了PEDV 变异强毒株核酸;另外1 个为PEDV 阴性猪场。
1.2 主要试剂 BL21 感受态细胞 DE3 (+)、His-Tagged Protein Purification Kit 购自康为世纪生物科技有限公司;pQE-30 购自优宝生物公司;核酸柱子提取试剂盒购自北京世纪元亨有限公司;BCA Protein Assay Kit (BCA 试剂盒)购自 TaKaRa 公司;pGEM-T Easy Vector 购自Promega 公司;内切酶购自 NEW ENGLAND 公司;羊抗猪 HRP-IgG 购自Proteintech 公司;TMB 单组份显色液购自Solarbio公司;western blot 试剂盒购自索莱宝公司。进口商品化PEDV 间接ELISA 检测试剂盒购自加拿大Bio-Vet 公司。
1.3 引物设计与合成 PEDV 作为一种基因组较大的RNA 病毒,容易发生核酸变异,导致新的变异株甚至基因型的出现,但分析近年来流行的PEDV强毒株以及本实验室保存的病毒株与经典株,各病毒株之间具有高度同源性,且N 蛋白在PEDV 各结构蛋白中具有较强保守性。因此,本实验参照Gen-Bank 中登录的PEDV N (AF353511)基因序列,设计一对扩增N 基因的特异性引物,P1:5'-TCAGGAT CCAATAACGCTGTACCCACTAAT-3'/P2:5'-TACGG TACCTTAATTTCCTGTATCGAAGATC-3',上下游引物中5' 端分别添加BamHⅠ和KpnⅠ酶切位点,基因扩增片段长度为1 221 bp,由英潍捷基(上海)贸易有限公司合成。
1.4 PEDV N 基因的扩增及表重组达载体的构建按照核酸提取试剂盒说明书提取PEDV 变异强毒株总RNA,以P2 为反转录引物将其反转录为cDNA后作为模板扩增N 基因片段,回收目的片段并连接入pGEM-T Easy 载体,双酶切、PCR 和测序鉴定阳性重组质粒,采用BamHⅠ和KpnⅠ对阳性重组质粒和pQE-30 表达载体双酶切后,将目的片段亚克隆入pQE-30 载体构建重组表达质粒pQE30-N,通过PCR 和测序鉴定阳性重组表达质粒。
1.5 重组N (rN)蛋白的表达、纯化及western blot分析 将上述构建正确的重组表达质粒pQE30-N 转化入BL21 DE3(+)感受态细胞中,选取阳性菌落培养至OD600nm为0.4~0.6,加入终浓度为0.2 mmol/L的IPTG,37 ℃诱导6 h。离心后收集菌体,PBS 重悬,超声破碎后,分别取上清和沉淀进行SDSPAGE 电泳确定目的蛋白的表达形式。按照说明书对包涵体变性、过柱纯化及复性,蔗糖浓缩后利用BCA 试剂盒测定纯化蛋白浓度。以灭活的PEDV 阳性猪血清(1∶200)为一抗,羊抗猪 HRP-IgG (1∶5 000)为二抗,对纯化的rN 蛋白进行western blot 鉴定,同时设空载体转化产物为阴性对照,以确定重组蛋白与PEDV 阳性血清的反应原性。
1.6 间接ELISA 方法条件的优化 采用矩阵法,分别对纯化的 rN 蛋白包被浓度(4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL), PEDV 阳性猪血清和阴性猪血清稀释倍数(1∶10、1∶20、1:50、1∶100、1∶200、1∶400),包被液[pH7.2 的 PBS 4 ℃过夜、pH9.6 的碳酸盐缓冲盐(CB) 4 ℃过夜]、封闭液(1 %牛血清白蛋白、5 %脱脂奶粉和5 %鱼明胶)、封闭条件(4℃,过夜和37℃,2 h)、羊抗猪HRP-IgG (1 ∶2 500、1∶5 000、1∶7 500、1∶10 000)、作用时间(30 min、45 min、60 min)、TMB 显色时间(5 min、10 min、15 min)等进行优化,确定该方法的最佳反应条件。
1.7 阴性样品临界值的确定 采用确定的最佳反应条件检测50 份PEDV 阴性猪血清(20 份是中和效价为1:21~1:21.5阴性样本,另30 份从阴性样品中随机选择),每个样品做3 个重复,计算阴性样品OD450nm的平均值()和标准方差(S),当 OD450nm值>+3S 时,在99.9 %的统计学水平上即可判定为阳性,反之为阴性。
1.8 特异性试验 利用本研究建立的间接ELISA方法分别对 TGEV、PCV2、PRV、CSFV、PRRSV阳性血清进行检测,每份阳性血清各做5 个重复取其平均值,并设PEDV 阳性和阴性血清对照,测定OD450nm值来判断该方法的特异性。
1.9 敏感性试验 取本实验保存的10 份PEDV 阳性猪血清(变异强毒株灭活疫苗免疫猪血清)作2 倍倍比稀释(1:2 ~1:512),利用本研究建立的间接ELISA 方法进行检测,同时对上述阳性血清进行PEDV 变异株中和试验[8],比较二者实验结果,判定该方法的敏感性。
1.10 重复性试验 采用同一批次包被的ELISA 反应板检测10 份猪血清样品(PEDV 阳性、阴性血清各5 份),每份样品重复检测3 次;同时用3 个不同批次包被的ELISA 反应板重复以上试验,根据检测结果计算上述批内和批间重复试验的变异系数,评估该方法的重复性。
1.11 临床样品检测 采用建立的ELISA 方法检测采自河南省5 个规模化养猪场的500 份临床血清,并与进口商品化PEDV 间接ELISA 抗体检测试剂盒检测结果相比较,计算二者的符合率,初步评价其在临床上的应用价值。
2 结 果
2.1 PEDV N 基因的扩增及重组表达载体的构建N 基因PCR 扩增结果显示获得约1 200 bp 的目的片段,构建的重组表达质粒pQE30-N 经PCR 鉴定后结果显示,获得约1 200 bp 的目的片段,与预期相符(图1)。经测序比对分析,获得的PCR 产物与GenBank 中PEDV N 基因同源性为99.5 %以上,表明重组表达质粒pQE30-N 构建正确。
2.2 rN 蛋白的表达、纯化及 western blot 分析SDS-PAGE 电泳显示,rN 蛋白主要以包涵体形式表达;其经纯化处理后,获得了分子量为50.4 ku、纯度>95 %的rN 蛋白;复性后经western blot 检测在约50.4 ku 处有特异性条带(图2),经BCA 蛋白浓度试剂盒测定,该rN 蛋白的浓度为1.081 mg/mL,表明该rN 蛋白具有较好的反应原性。
2.3 间接ELISA 方法优化结果 通过矩阵试验,对该ELISA 方法各反应条件优化的结果详见表1。
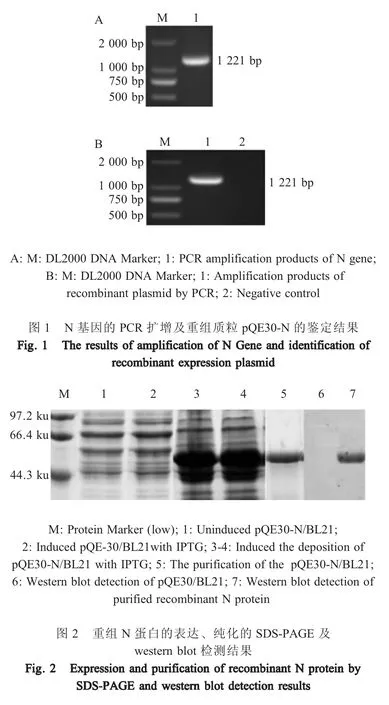

表1 间接ELISA 检测方法的反应条件优化结果最佳稀释度Optimized dilutions反应条件Reaction conditions rN 为包被抗原Coating with rN 2 μg/mL血清Serum 1:100包被条件Coating CB pH=9.6羊抗猪HRP-IgG Goat anti-pig HRP-IgG 1:5 000 4 ℃/16 h-18 h 37 ℃/1 h 4 ℃overnight封闭条件Blocking 1 %的牛血清白蛋白1%bovine serum albumin 37 ℃/2 h 37 ℃/30 min TMB 底物TMB substrate室温避光Room temperature and avoided light 10 min
2.4 阴性样品临界值的确定 采用确定的最佳条件检测50 份PEDV 阴性猪血清的OD450nm值,结果显示 OD450nm值均介于0.062~0.226 (图3),计算平均值为 0.121 68,标准差 S 为 0.050 617,+3S 值为 0.274。当OD450nm值>0.274 时,在 99.9 %的统计学水平上可判定该PEDV 血清样品为阳性,反之为阴性。
2.5 特异性试验结果 采用本研究建立的ELISA方法分别检测TGE、PCV2、PRV2、CSFV、PRRSV阳性猪血清,结果显示,除PEDV 阳性血清外其它病原阳性血清的OD450nm值均小于临界值(表2),表明本研究建立的间接ELISA 方法与上述病原无交叉反应性,具有较强的特异性。
2.6 敏感性试验结果 利用本研究建立的间接ELISA 方法和中和试验对10 份PEDV 阳性血清分别进行检测,结果显示10 份样品中有5 份用本研究建立的方法能够检测出的样品最高稀释倍数比中和试验仅低1 个稀释度,另外5 份与中和试验检测结果一致(表3),中和试验能够检测出的阳性血清的平均最高稀释度为1 ∶153.6,而本研究建立的间接ELISA 检测方法检测出阳性血清的平均最高稀释度为1∶104。表明,本研究建立的间接ELISA 检测方法敏感性较高,但略低于中和试验。

表3 敏感性试验血清编号Sera阳性血清的最高稀释倍数ELISA method can detect the highest dilution factor of positive serum阳性血清的最高稀释倍数Neutralization test can detect the highest dilution ratio of positive serum 1234567891 0 1:64 1:64 1:256 1:256 1:128 1:32 1:64 1:128 1:32 1:16 1:64 1:128 1:256 1:512 1:256 1:32 1:64 1:128 1:64 1:32
2.7 重复性试验结果 采用本研究建立的间接ELISA 方法对10 份背景清晰的血清进行重复性检测。结果显示,批内变异系数为2.54 %~3.25 %,批间变异系数为3.76 %~8.79 %,均小于10 % (表4),表明该方法具有较好的重复性。
表4 间接ELISA 重复性试验(n=10)样品序号Sample No.Intra batch CV%Inter batch CV%1234567891 0平均数X±SD 0.236±0.006 0.369±0.011 0.252±0.007 0.444±0.014 0.508±0.013 1.317±0.042 1.077±0.035 1.451±0.047 0.989±0.029 1.185±0.034变异系数CV (%)2.54 2.98 2.78 3.15 2.56 3.19 3.25 3.24 2.93 2.87平均数X±SD 0.329±0.015 0.452±0.027 0.429±0.019 0.638±0.024 0.672±0.055 0.891±0.067 0.694±0.061 0.976±0.064 1.193±0.065 0.702±0.057变异系数CV (%)4.56 5.98 4.43 3.76 8.18 7.52 8.79 6.56 5.45 8.12
2.8 临床样品检测结果 采用本研究建立的间接ELISA 方法与进口商品化间接ELISA 检测试剂盒同时检测500 份河南省5 个规模化养猪场的猪血清,该间接ELISA 检测结果为:阳性样品372 份,阴性样品128 份,阳性检出率为74.4 %;进口商品化试剂盒检测结果为:阳性样品370 份,阴性样品130份,阳性检出率为74 %;二者符合率为99.6 %。表明本实验建立的间接ELISA 方法与商品化试剂盒的符合率较高,可以用于临床样品的检测。
3 讨 论
国内外多位学者对2010年以来引起中国和2013年引起美国猪群发病的PEDV 变异强毒株分子遗传变异规律进行了研究,通过对其S 基因、M 基因、ORF3 基因遗传变异分析,结果显示,与经典株CV777 或韩国减毒疫苗株DR13 相比,PEDV 变异强毒株属于新的基因群,中国研究者将其命名为基因Ⅲ群[9-11],而经典株CV777 或DR13 疫苗株属于基因Ⅰ群。PEDV 基因变异正是造成经典疫苗免疫失败和仔猪死亡率高的主要原因[12]。另外,PED 与TGE 临床症状十分相似,很难区分,且其可以与轮状病毒、冠状病毒等发生混合感染,而临床上却缺少针对目前流行的PEDV 变异强毒株的有效疫苗和血清学检测方法,导致该病已成为危害世界养猪业最为严重的疫病之一。因此,建立检测PEDV 抗体的血清学检测方法对于评价疫苗免疫效果及感染状况很有必要。然而,目前市售的PEDV 间接ELISA抗体检测试剂盒价格昂贵,难以在基层推广。而本研究基于原核表达PEDV N 蛋白作为包被抗原,建立了检测PEDV 血清抗体的间接ELISA 方法,并进行了初步应用,为PEDV 临床血清抗体检测提供技术手段。
N 蛋白作为PEDV 主要的结构蛋白之一,在感染早期就能产生高水平抗体,且N 基因保守性较高,不易发生变异[13],因此本研究选择PEDV N 蛋白作为间接ELISA 的包被抗原。本研究以分离得到的PEDV 为模板,克隆并表达了PEDV N 蛋白,纯化后其纯度大于95 %,得到的重组蛋白浓度为1.081 mg/mL。经western blot 分析,重组蛋白与灭活的PEDV 疫苗免疫猪血清具有良好的反应原性,这为后续试验以及开展其它基于PEDV 重组蛋白的研究,如胶体金免疫层析试纸等奠定了基础。
本研究所建立的间接ELISA 方法可以特异性检测PEDV 阳性血清,与其它常见猪阳性血清无交叉反应,表明该方法特异性较强。病毒中和试验被公认为是抗体检测方法中灵敏且准确的一种,因此,评估本研究建立方法的敏感性时,利用中和试验和该方法平行检测,结果二者部分检测结果一致,部分阳性血清的检测结果仅比中和试验低一个稀释度。推测原因可能是由于中和抗体针对的是PEDV多种结构蛋白产生的,而本研究建立的方法仅是针对N 蛋白产生的抗体,而N 蛋白只是PEDV 结构蛋白中的一种[14]。但本研究建立的间接ELISA 方法仍具有较高敏感性。该ELISA 方法的批内和批间变异系数均小于10 %,重复性良好。同时,用建立的间接ELISA 方法对500 份临床猪血清进行检测,结果与进口商品化的PEDV 间接ELISA 抗体检测试剂盒的符合率为99.6 %,而这些血清既有来自经典疫苗株免疫场,也有来自当前野毒株感染场,这表明本研究建立的间接ELISA 方法可以用于临床样品的大批量检测,而且对目前流行的PEDV 变异强毒株以及经典株产生的抗体均能够检测到。
本研究建立了基于PEDV 变异强毒株N 蛋白为包被抗原的间接ELISA 检测方法,且该方法特异性强、敏感性高、稳定性好,可以为临床PEDV 疫苗免疫和野毒感染猪血清提供一种有效的检测方法和手段。

