甲型流感病毒NS1蛋白与宿主蛋白eIF3f相互作用促进病毒复制的研究
林朝辉,张振宇,徐 菱,任会玲,王晓钧
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/马传染病和慢病毒病研究创新团队,黑龙江 哈尔滨 150069)
甲型流感病毒(Influenza A virus,IAV)属于正黏病毒科流感病毒属,为具有囊膜、分节段的单股负链RNA 病毒[1]。其宿主范围广泛,包括野鸟、家禽、人、马、犬、蝙蝠等动物,能够引起人和动物严重的呼吸道传染病,对公共卫生安全造成持续性威胁[2]。
非结构蛋白NS1 (Nonstructural protein 1,NS1)由IAV 第8 节段编码,全长约219~237 个氨基酸,由N 端的RNA 结合区域(aa1~aa73)和C 端的效应区域(aa74~aa219/237)构成。NS1 蛋白主要存在于病毒感染的宿主细胞中,但仍以非常低的量存在于病毒中[3]。NS1 蛋白是一种多功能蛋白,在调节IAV 的毒力和致病力方面发挥着重要作用。一方面,NS1 蛋白与宿主因子eIF4GI 和PABP1 结合促进了病毒mRNA 的翻译,进而提高了病毒复制水平,直接增强病毒拮抗宿主细胞的抗病毒反应能力[4-5]。另一方面,NS1 蛋白与宿主RNA 结合阻碍了模式识别受体对RNA 的识别和下游信号通路激活,阻断了干扰素生成[6];同时,NS1 蛋白还可以通过与宿主因子CPSF30 结合抑制细胞pre-mRNA 的加工,进而抑制包括抗病毒蛋白在内的细胞蛋白合成,间接增强了流感病毒的致病力,促进病毒的高效复制和感染[7-8]。虽然这些研究结果表明流感病毒NS1 蛋白与多种宿主细胞因子相互作用而调节IAV 的复制和毒力,但流感病毒的生命活动高度依赖于宿主细胞,仍有很多宿主与病毒之间的相互作用尚不清楚,因此筛选与流感病毒NS1 相互作用的宿主因子,为进一步理解宿主因子在流感病毒感染与复制过程中所发挥的作用和制定更为有效的抗流感策略提供参考依据。
本研究以A/Sichuan/01/2009 H1N1 (H1N1 SC09)株的NS1 蛋白为“诱饵”蛋白,利用Flag pull-down联合质谱分析筛选到了与NS1 蛋白存在可能相互作用的宿主蛋白eIF3f,并采用双分子荧光互补分析技术(BiFC)进一步验证其相互作用,通过在HEK293T细胞中瞬时过表达eIF3f 蛋白后促进了H1N1 SC09病毒的复制,本研究为深入探究eIF3f 蛋白在流感病毒感染和复制中发挥的生物学功能奠定了基础。
1 材料与方法
1.1 主要实验材料 人胚胎肾细胞株HEK293T、pcDNA3.1-Flag-HA、 pcDNA3.1-V5、 pcDNA3.1-Venus、 pcDNA3.1-SC09-NS1-Flag-4HA、 pcDNA3.1-VN-HA-SAMHD1 质粒由本实验室保存;H1N1 SC09反向遗传系统由中国农业科学院哈尔滨兽医研究所陈化兰院士惠赠;H1N1 SC09 病毒由本实验室拯救并保存;KOD FX Neo PCR 酶购自TOYOBO 公司;无缝克隆连接酶购自Clone Smarter 公司;PolyJetTMin VitroDNA transfection reagent 购自 SignaGen 公司;TRIzol 试剂购自 Invitrogen 公司;PierceTMIP Lysis Buffer 和 PierceTMSilver Stain Kit 购自 Thermo scientific公司;PrimeScriptTMRT reagent Kit with gDNA Eraser 购自TaKaRa 公司;SurePAGE gel 购自南京金斯瑞生物科技有限公司;DIPA 染色液和免疫染色固定液购自Beyotime 公司;细胞高糖培养液DMEM、抗 Flag 磁珠、TPCK 胰蛋白酶、3×Flag peptide、 Triton X-100、 Tween-20、鼠抗β-actin单抗、鼠抗HA 标签单克隆抗体(MAb)均购自Sigma公司;Dylight 800-labeled 山羊抗鼠IgG (H+L)购自KPL 公司。
1.2 NS1 蛋白的Flag pull-down 试验 将HEK293T细胞接种在6 孔板中,待细胞密度达到80 %时,按照转染试剂盒说明,分别将1 μg/μL 的pcDNA3.1-SC09-NS1-Flag-4HA质粒和pcDNA3.1-Flag-HA质粒(用作阴性对照)转染HEK293T 细胞,每组设置3 个重复。转染24 h 后弃去培养液,分别在每孔中加入300 μL 细胞裂解液,置于4 ℃孵育10 min,细胞充分裂解后以12 000 r/min 离心10 min,吸取细胞上清与20 μL 预冷的、抗Flag 混悬磁珠混合,4 ℃孵育2 h,利用磁力架吸附磁珠,弃去上清液,用预冷的 PBS 清洗 4 次后,加入 120 μL 的 3×Flag peptide 洗脱液,4 ℃孵育 30 min 后,加入 30 μL 5×protein loading buffer,100 ℃煮沸5 min。将制备的蛋白样品分为两份,取一份上清经SDS-PAGE 分离后转印至硝酸纤维素膜上,以鼠抗HA 标签MAb (1∶5 000)为一抗,羊抗鼠 IgG 抗体(1∶10 000)为二抗,经 western blot 检测NS1 蛋白的表达。。
1.3 蛋白样品的银染分析及质谱分析 将1.2 中的另一份样品经12 % SDS-PAGE 分离后,参照银染试剂盒说明书染色处理。根据银染结果,比较实验组与对照组的条带,切取凝胶后由中国科学院生物物理研究所进行质谱鉴定分析。
1.4 重组质粒的构建与鉴定 根据以上实验结果,参照GenBank 中人源eIF3f 的基因序列(NM_003754.3),设计引物 h-eIF3f-F/h-eIF3f-R (表1)。利用 TRIzol 提取HEK293T 细胞的总RNA,以反转录获得的cDNA 为模板,以h-eIF3f-F/h-eIF3f-R 作为引物扩增人源eIF3f 基因片段,以 pcDNA3.1-V5 为模板,以pcDNA3.1-F/pcDNA3.1-V5-R 为引物扩增pcDNA3.1-V5 线性载体,利用同源重组法将eIF3f 基因片段克隆到pcDNA3.1-V5 线性载体中,构建重组质粒pcDNA3.1-eIF3f-V5。
以 pcDNA3.1-Venus 为模板,I-VN-F/I-VN-R 作为引物PCR 扩增Venus 基因(全长为239 个氨基酸)的 N 端区域 VN (aa1~aa173);以 pcDNA3.1-SC09-NS1-flag-4HA 为模板,V-NS1-F/V-NS1-R 作为引物,经PCR 将pcDNA3.1-SC09-NS1-flag-4HA 质粒扩增为线性载体;利用同源重组法将VN 片段克隆到该线性载体中构建重组质粒pcDNA3.1-VN-SC09-NS1-flag-4HA。
以 pcDNA3.1-Venus 为模板,I-VC-F/I-VC-R 作为引物PCR 扩增Venus 基因的C 端区域VC (aa174~aa239);以 pcDNA3.1-eIF3f-V5 为模板,V-eIF3f-F/V-eIF3f-R 作为引物,经 PCR 将 pcDNA3.1-eIF3f-V5 质粒扩增为线性载体,利用同源重组法将VC 片段克隆到该线性载体中构建重组质粒pcDNA3.1-VC-eIF3f-V5。
以上所得重组质粒均经PCR 和测序验证。

表1 引物序列Primer names h-eIF3f-F h-eIF3f-R pCDNA3.1-F pCDNA3.1-V5-R I-VN-F I-VN-R V-NS1-F V-NS1-R I-VC-F I-VC-R V-eIF3f-F V-eIF3f-R(5'-3')ATAGTTGTAGCCACCATGGCCACACCGGCGGTACC AGGGATAGGCTTACCCAGGTTTACAAGTTTTTCAT GGTGGCTACAACTATCAACTAAACT GGTAAGCCTATCCCTAACCCTCTCC ATAGTTGTAGCCACCATGGTGAGCAAGGGCG GGTGTTGGAGTCCATTCCGCCGCTTCCCTCGATGT ATGGACTCCAACACCATGTC GGTGGCTACAACTATCAACTAAACT ATAGTTGTAGCCACCATGGGCGGGGTGCAGCTCG CGCCGGTGTGGCCATTCCGCCGCTTCCCTTGTACA ATGGCCACACCGGCGGTAC GGTGGCTACAACTATCAACTAAACT
1.5 NS1 与eIF3f 蛋白相互作用的BiFC 检测 将HEK293T 细胞铺于共聚焦小皿中,待细胞密度达到50%时,将pcDNA3.1-VC-eIF3f-V5 分别与pcDNA3.1-VN-HA-SAMHD1 和 pcDNA3.1-VN-SC09-NS1-Flag-4HA 质粒共转染HEK293T 细胞,转染24 h 后将细胞用免疫染色固定液室温固定15 min,0.1 % TRIton X-100 室温通透15 min,最后经DIPA 染核10 min,利用激光共聚焦显微镜观察NS1 与eIF3f 蛋白相互作用情况。
1.6 过表达eIF3f 蛋白对H1N1 SC09 病毒复制的影响 待6 孔板中的HEK293T 细胞密度为60 %时,分别将 1 μg pcDNA3.1-eIF3f-V5 和 pcDNA3.1-V5 质粒转染HEK293T 细胞,24 h 后弃培养液,预热PBS清洗两遍,用含 0.5 μg/mL 的 TPCK 稀释液稀释H1N1SC09 病毒,按照MOI=1 的剂量感染细胞,48 h后收集细胞上清液,试验重复3 次后,利用血凝试验测定流感病毒的HA 效价。
2 结 果
2.1 Flag pull-down 蛋白样品的 western blot 分析将pcDNA3.1-SC09-NS1-Flag-4HA 质粒转染HEK293T细胞后与抗Flag 混悬磁珠混合,常规处理后获得Flag pull-down 样品,对该蛋白样品进行western blot鉴定。结果显示,转染该质粒的HEK293T 细胞在32 ku 出现特异性条带,而空载体对照未见该条带(图1),表明融合 Flag 标签的 NS1 蛋白与 - 抗 Flag磁珠结合良好,以保证其捕获与NS1 蛋白存在潜在相互作用的宿主蛋白。

2.2 Flag pull-down 蛋白样品的银染分析结果 对1.2 中所得到的样品经12 % SDS-PAGE 分离后银染,结果显示,转染pcDNA3.1-SC09-NS1-Flag-4HA 质粒的HEK293T 细胞样品中,在140 ku 处有1 条特异性条带,而转染空载体的HEK293T 细胞样品中无该条带(图2),表明H1N1 SC09 NS1 蛋白捕获到未知宿主蛋白。
2.3 蛋白样品的质谱分析结果 将2.2 获得的特异性条带经质谱数据分析结果显示,初步筛选获得4个可能与H1N1 SC09 NS1 蛋白相互作用的宿主细胞蛋白,分别为:eIF3f、ENO1、CCAR2 和 PSB2 蛋白(表2)。根据蛋白评分数据,选择评分最高的eIF3f 蛋白进行下一步互作验证和功能验证。
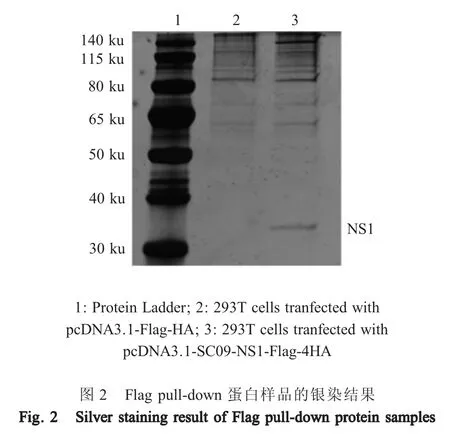
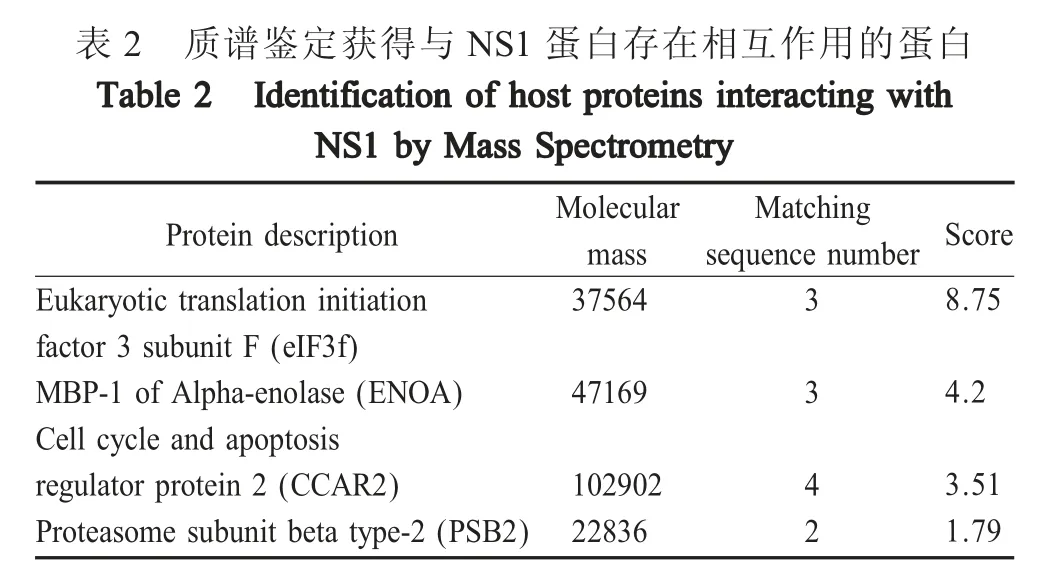
表2 质谱鉴定获得与NS1 蛋白存在相互作用的蛋白Protein description Score Eukaryotic translation initiation factor 3 subunit F (eIF3f)MBP-1 of Alpha-enolase (ENOA)Cell cycle and apoptosis regulator protein 2 (CCAR2)Proteasome subunit beta type-2 (PSB2)mass 37564 sequence number 8.75 471694.2 102902 22836 3 3 42 3.51 1.79
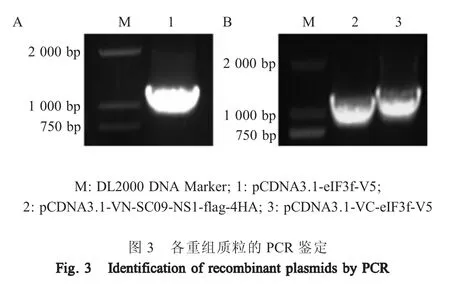
2.4 重组质粒的构建和鉴定结果 利用同源重组技术构建重组质粒pcDNA3.1-eIF3f-V5、pcDNA3.1-VN-SC09-NS1-flag-4HA、pcDNA3.1-VC-eIF3f-V5,经PCR 检测,结果显示分别获得了约为1 000 bp、1 300 bp、1 200 bp 的目的条带,分别与 eIF3f、VN-SC09-NS1、VC-eIF3f 各片段相符(图3)。同时,测序结果显示各目的基因序列和各自阅读均框均正确,进一步表明正确构建了以上各重组质粒。
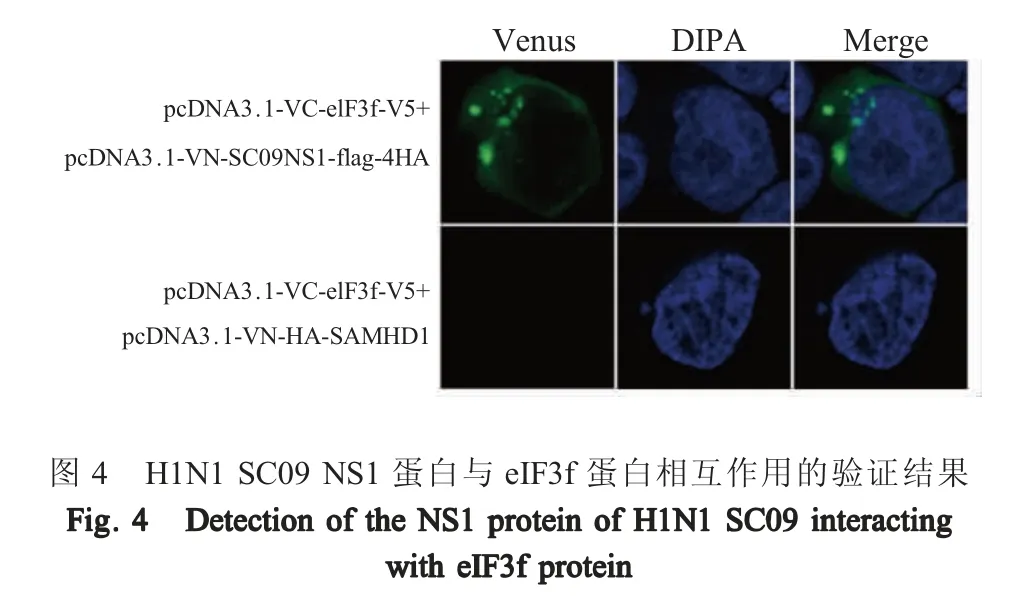
2.5 H1N1 SC09 NS1 蛋白与eIF3f 蛋白相互作用的验证 利用激光共聚焦显微镜观察H1N1 SC09 NS1 蛋白与eIF3f 蛋白的相互作用。结果显示,pcDNA3.1-VC-eIF3f-V5 与pcDNA3.1-VN-SC09-NS1-flag-4HA 共转染可见绿色荧光,而pcDNA3.1-VC-eIF3f-V5 和pcDNA3.1-VN-HA-SAMHD1 共转染细胞,无绿色荧光(图4),表明H1N1SC09 NS1 和 eIF3f 蛋白存在相互作用。
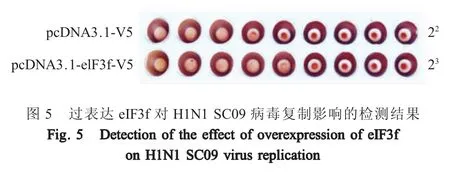
2.6 过表达eIF3f 蛋白对H1N1 SC09 病毒复制的影响 将 pcDNA3.1-V5 和 pcDNA3.1-eIF3f-V5 质粒分别转染HEK293T 细胞后,利用H1N1 SC09 病毒感染细胞,测定该流感病毒的HA 效价。结果显示,转染 pcDNA3.1-V5 的 293T 细胞经 H1N1 SC09 病毒感染后,其HA 效价为22,而过表达eIF3f 的293T细胞经H1N1 SC09 病毒感染后的HA 效价为23(图5),表明eIF3f 蛋白与流感病毒NS1 结合促进H1N1 SC09 流感病毒的复制。
3 讨 论
本研究通过Flag pull-down 联合质谱的方法,在HEK293T 细胞中筛选出与流感病毒NS1 蛋白存在直接或间接相互作用的宿主蛋白,经质谱数据分析鉴定出4 个与NS1 存在潜在相互作用的宿主蛋白,分别是 eIF3f、ENO1、CCAR2 和 PSB2 蛋白。
真核翻译起始因子3 (The eukaryotic initiation factor 3,eIF3) 是哺乳动物细胞内最复杂的起始因子之一,由eIF3a~eIF3m 等13 个亚基组成。eIF3 是启动真核细胞蛋白和病毒蛋白合成所必需的,并且在调控真核细胞周期和癌症发生过程中均具有重要作用[9]。eIF3f 为eIF3 的重要组成部分,具有参与翻译起始、pre-mRNA 剪接和转录等进程的功能[10]。已有研究表明eIF3f 蛋白在胃癌和小肠癌等癌细胞中有较低水平表达,过表达eIF3f 能够抑制细胞增殖和诱导黑色素瘤、胰腺癌细胞凋亡,表明eIF3f 蛋白参与调控细胞周期和癌症发生过程,是细胞生长和增殖的重要负调节因子[11]。此外,eIF3f 参与调控HIV-1 的复制,eIF3f 和N91-eIF3f 通过特异性靶向HIV-1 mRNA 的3' 长末端重复区域,导致细胞核和细胞质中病毒mRNA 的水平降低;并且在病毒mRNA 成熟过程中,eIF3f 可以特异性地干扰mRNA 的3'末端加工,限制HIV-1 的复制[12]。
为验证宿主eIF3f 蛋白与流感病毒NS1 蛋白的相互作用,本研究通过免疫共沉淀试验发现NS1 与eIF3f 蛋白存在微弱的相互作用(数据未给出),推测可能原因为NS1 蛋白与eIF3f 蛋白之间的作用时间短,解离速度快。而BiFC 技术可以通过可视化直观、快速地判断目标蛋白在活细胞中的定位和相互作用[13],BiFC 结果显示,流感病毒NS1 蛋白与宿主eIF3f 蛋白在HEK293T 细胞中结合,使各自携带的Venus 蛋白片段在空间上相互靠近互补,重新构建成完整的具有活性的Venus 蛋白分子,在激发光的激发下,产生Venus 蛋白的荧光,表明二者存在相互作用。在HEK293T 细胞内过表达eIF3f 可以提高H1N1 SC09 病毒的复制水平,但eIF3f 蛋白如何通过结合NS1 蛋白调控流感病毒复制的机制仍需进一步探究。
综上所述,本研究首次证实了宿主eIF3f 蛋白与NS1 蛋白的相互作用,并且eIF3f 蛋白对流感病毒的复制发挥正调控作用。该研究不仅揭示了宿主eIF3f 蛋白在调控流感病毒复制中的新功能,也为揭示流感病毒复制和感染机理提供实验依据。

