小麦核氧还蛋白基因 TaNRX1的序列特征及表达分析
袁晓波,常亚南,王苗苗,樊亚栋,王瀑童,吴玉杰,李梦园,张 莉,孟凡荣,李永春
(1.河南农业大学农学院,河南郑州 454002; 2.河南农业大学生命科学学院,河南郑州 454002)
硫氧还蛋白(Thioredoxin,Trx)是一类广泛存在于高等植物的低分子量氧化还原蛋白[1-2],大量研究发现,该类蛋白在维持细胞内氧化还原状态的平衡、调节蛋白空间结构及其活性等方面具有不可替代的作用,而且Trx蛋白参与了植物生长发育调控以及抵御干旱、高温等逆境胁迫的响应过程[3-4]。核氧还蛋白(nucleoredoxin,NRX)是硫氧还蛋白家族的重要成员,该类蛋白最早从小鼠中发现[5],关于植物中NRX的研究报道还较少。依据氨基酸序列特征,可将植物的NRX分为3个亚类。第Ⅰ类包含3个TRX-like结构域,其中第二个结构域不包含TRX活性位点;第Ⅱ类包含2个TRX-like结构域,且均含有TRX活跃位点WYP/AK/PC 和 W/R/HCL/A/V/RPC/G;第Ⅲ类NRX中含有2个TRX-like结构域,其中分别包括高度保守的WCRPC氧化还原活性位点和典型的Trx活性位点WCPPC/F/S[6]。目前,已从拟南芥中鉴定了2个NRX基因(AtNRX1和AtNRX2),分属于第Ⅰ和第Ⅲ亚类,其中AtNRX1基因突变后导致花粉活力降低[7],推测其在接收雌蕊信号并引导花粉管向胚珠生长的过程中发挥重要的调节功能[8]。从玉米中鉴定的ZmNRX蛋白包含3个TRX-like结构域,而且该基因在不同组织间存在显著的差异表达现象,推测其在玉米生长发育过程中发挥重要功能[9]。
在小麦中,已有研究表明核氧还蛋白基因TaNRX(KC890769)的第一内含子变异可能与小麦的抗旱性密切相关[10-11],基于该基因序列差异的分子标记可以用于小麦品种的抗旱性鉴定分析[12-13]。课题组前期研究中发现,一个小麦核氧还蛋白基因(CA605146)可能参与了籽粒发育调控过程[14]。在此基础上,本研究克隆了该核氧还蛋白的编码基因,并系统分析了其序列特征、染色体定位和时空表达模式,以期为进一步探讨该基因在小麦发育调控过程中的生物学功能提供了重要信息。
1 材料与方法
1.1 试验材料
植物材料为小麦品种中国春和矮抗58,于河南农业大学毛庄科学试验基地种植,分别取成熟的籽粒、开花期的穗下节、旗叶、节间和节用于基因的组织表达特性分析,同时分别取授粉后5、10、15、20、25和30 d的籽粒用于基因在种子发育过程中的表达特性分析。试验设3个生物学 重复。
1.2 RNA的提取、cDNA第一链的合成及DNA的提取
籽粒总RNA采用TransZol Plant试剂盒(全式金,北京)提取,其余组织材料总RNA采用RNAisoPlus试剂(Takara,日本)提取。利用琼脂糖凝胶电泳及OD260/280值来评估总RNA的完整性、纯度和浓度,然后采用反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara,日本)进行cDNA第一链的合成,基因组DNA采用CTAB法[15]提取。
1.3 基因克隆和序列分析
依据前期研究中发现的小麦NRX基因cDNA序列(GenBank登录号CA605146)进行小麦基因组(https://blast.ncbi.nlm.nih.gov/Blast.cgi)序列比对分析,初步对该基因的基因组结构和编码区等特性进行分析,并利用URGI小麦基因组数据库(https://urgi.versailles.inra.fr/blast/blast.php)进行染色体定位。在此基础上,利用Primer Premier 5.0设计基因克隆、部分同源基因鉴定和表达分析的引物(表1)。利用引物cF/R1通过高保真酶LATaq(Takara,日本)进行cDNA序列的克隆,扩增片段经回收、连接pMD19-T载体(Takara,日本)和转化大肠杆菌DH5α感受态细胞后,用A、B和D基因组特异引物sF-A、sF-B和sF-D分别与下游引物cR1配对进行重组克隆鉴定,并进行测序分析。基因组序列克隆时,采用花后15 d籽粒的基因组DNA为模板,利用引物cR2分别与特异引物cF2-A、cF2-B和cF2-D组合进行该基因A、B和D基因组上游的调控区的克隆。利用引物组合Intron-1R/cF1和Intron-23F/cR1分别扩增第一内含子和第二/三内含子区域序列。基因组上游调控区的元件分析通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)软件进行,蛋白的聚类通过MEGA 6.0软件进行分析,蛋白质高级结构分析通过SWISS MODEL(https://www.swissmodel.expasy.org/)进行。
1.4 基因表达分析
实时定量分析采用TransStart Top Green qPCR SuperMix试剂盒(全式金,北京)进行,PCR仪为Bio-Rad CFXConnectTM。反应体系20 μL,其中cDNA模板1μL,2×TransStart Tip Green qPCR Super Mix 10 μL,上下游引物(10 μmol·L-1)各0.4 μL,RNase-free水8.2 μL。表达分析通用引物为qF/R,以β-肌动蛋白基因Actin为内标基因,引物为actin-F/R。PCR程序为:94 ℃ 30 s;94 ℃5 s,60 ℃ 15 s,72 ℃ 10 s,40个循环;表达特性分析采用2-△△Ct法。
2 结果与分析
2.1 TaNRX1基因的克隆及序列分析
利用小麦cDNA序列进行NCBI blastx(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析,结果显示,该序列的第3个阅读框编码氨基酸序列与核氧还蛋白(AHL29285.1)的序列一致性为100%;进一步通过小麦基因组(http://plants.ensembl.org/Triticum_aestivum/Info/Index)序列比对分析发现,该核氧还蛋白基因位于第2染色体长臂,将其在A、B和D基因组对应的3个部分同源基因分别命名为TaNRX1-2AL、TaNRX1-2BL、TaNRX1-2DL(图1)。序列分析显示,该基因编码区包含3个内含子,且TaNRX1-2AL、TaNRX1-2BL和TaNRX1-2DL部分同源基因之间的内含子差异较大,和A基因组相比,TaNRX1-2BL和-2DL基因组和它的序列一致性分别为84%和90%;外显子区域序列一致性较高,三者之间的序列相似度约98%。

表1 本研究中使用的引物信息Table 1 Primer information used in the study

图1 TaNRX1的基因组结构特征
利用特异引物cF/R1进行cDNA扩增得到大小约为1 900 bp的条带(图2),利用引物Intron-1R和cF1克隆包含TaNRX1第一内含子序列的大小约为1 700 bp的片段,同时利用引物Intron-23F和cR1扩增包含第二、三内含子序列的片段,获得大小约为2 100 bp的条带(图2),利用引物cR2分别与A、B和D基因组特异引物(cF2-A、cF2-B和cF2-D)组合进行基因组DNA扩增,获得了该基因上游调控区的DNA片段(图2)。结果分析显示,TaNRX1-2AL的cDNA大小为1 936 bp,ORF大小为1 731 bp(GenBank:MK497247);TaNRX1-2BL的cDNA大小为 1 942 bp,ORF大小为1 743 bp(GenBank:MK497248);TaNRX1-2DL的cDNA大小为 1 931 bp,ORF大小为1 734 bp(GenBank:MK497249)。对该基因编码氨基酸序列分析显示,TaNRX1-2AL、-2BL和-2DL蛋白均包含3个TryX_like_TryX_NRX(cd03009)保守结构域,分别位于第22~153位氨基酸、第184~316位氨基酸和第347~476位氨基酸,其中,第1个和第3个保守结构域分别包含了WCPPC和WCGPC活性位点;另外,在TaNRX1的C端还检测到一个富集半胱氨酸和组氨酸的C1保守域,该区域可能和两个锌离子结合形成锌指结构。
对矮抗58和中国春两个品种间TaNRX1基因序列比对发现,该基因在cDNA、内含子及上游调控区,所检测的两个品种间序列一致性在99%以上。对该基因A、B和D基因组间的序列比对分析发现,TaNRX1基因上游调控区存在较大的序列差异(图3)。与A基因组相比,B基因组与之序列一致性仅有25%,D基因组为79%;不过,在转录起始位点上游340 bp的区域内,A、B、D基因组间序列一致性较高,均包含TATA signal(-27~-33 bp)、TGACG motif(-90~-94 bp)、CAAT signal(-180~-183 bp)和MYB结合位点(-320~-325 bp)。另外,B和D基因组还包含一个光响应元件;在上游调控序列340~1 300 bp的区域内,含有4~6个MeJA调控响应元件和 1~2个光响应元件(AE-box、G-box),在A和B基因组中还检测到 2~3个MYB结合位点和 1~2个ABA响应调控元件(ABRE)。
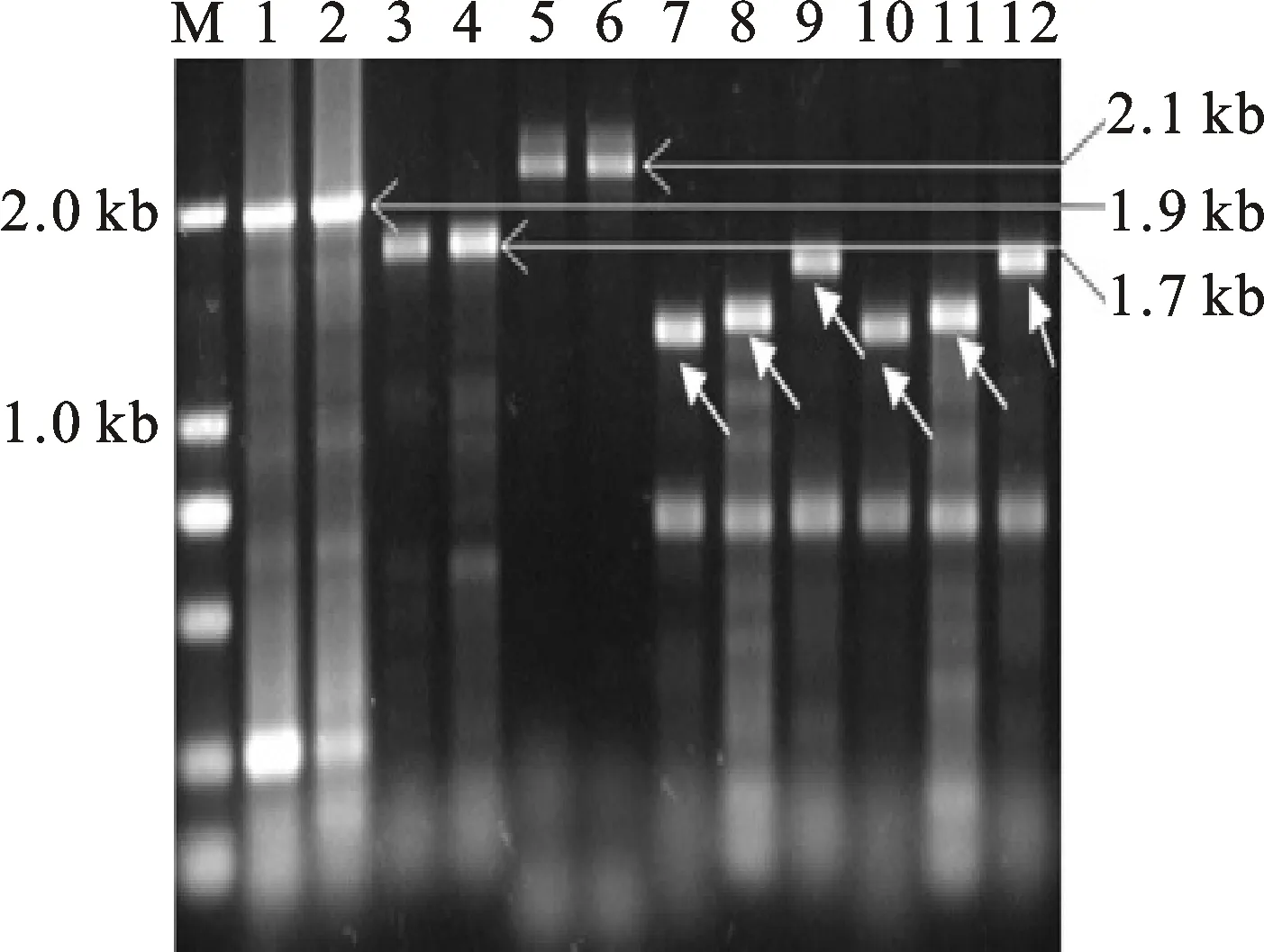
M:Marker DL2000;1:以中国春cDNA为模板的扩增产物;2:以矮抗58 cDNA为模板的扩增产物;3~4:分别以中国春和矮抗58 DNA为模板克隆第一内含子序列;5~6:分别以中国春和矮抗58 DNA为模板克隆第二、三内含子序列;7~9:分别为中国春 A、B、D基因组中TaNRX1基因上游调控区的扩增;10~12:分别为矮抗58 A、B、D基因组中TaNRX1基因上游调控区的扩增;白色箭头标注为目的片段。
M:Marker DL2000;1: PCR product using cDNA of Chinese Spring as template; 2:PCR product using cDNA of Aikang 58 as template;3-4:Cloning the first intron from Chinese Spring and Aikang 58,respectively; 5-6:Cloning the 2nd and 3rd intron regions from Chinese Spring and Aikang 58,respectively; 7-9:Cloning the upstream sequence ofTaNRX1gene in A,B and D genome of Chinese Spring,respectively;10-12:Cloning the upstream sequence ofTaNRX1gene in A,B and D genome of Aikang 58,respectively; White arrows indicate objective fragments.
图2TaNRX1基因DNA片段克隆
Fig.2 DNA amplification ofTaNRX1
2.2 TaNRX1蛋白特性分析
对TaNRX1的序列特性分析显示,TaNRX1-2AL、-2BL和-2DL分别编码576、580和577个氨基酸,推测分子量分别为63.71 kDa、63.81 kDa和63.69 kDa,等电点分别为4.82、4.78和4.84。氨基酸序列比对发现,3个部分同源基因编码的蛋白序列高度一致(>97.76%),在第1个TryX_like_TryX_NRX保守域内, TaNRX1-2BL和TaNRX1-2AL相比存在6个氨基酸的差异,TaNRX1-2DL存在5个氨基酸差异;在第2个保守域内,和TaNRX1-2AL相比,B和D分别有2个和1个氨基酸差异,在第3个保守域内,分别存在5个和1个位点差异。依据拟南芥核氧还蛋白NRX1(O80763.1)的序列,通过NCBI数据库比对分析获得了植物中NRX的蛋白序列,并利用软件MEGA 6.0对所获得蛋白进行聚类分析(图4)。结果显示,在分析的3类核氧还蛋白(I~Ⅲ)中,第I类包含的成员最多,包括拟南芥的NRX1(O80763.1)、玉米的NRX1(NP_001105407.2)、高粱的NRX1-1(XP_002467709.1)、水稻的NRX1-1(XP_015630417.1)和NRX1-2(XP_015630416.1)。小麦的TaNRX1-2AL和NRX蛋白(AHL29285.1)氨基酸序列存在9个位点的差异,一致性为97.59%,这可能与小麦不同品种间的差异有关;TaNRX1-2DL与粗山羊草的NRX 1-2(XP_020183276.1)仅存在1个氨基酸差异。
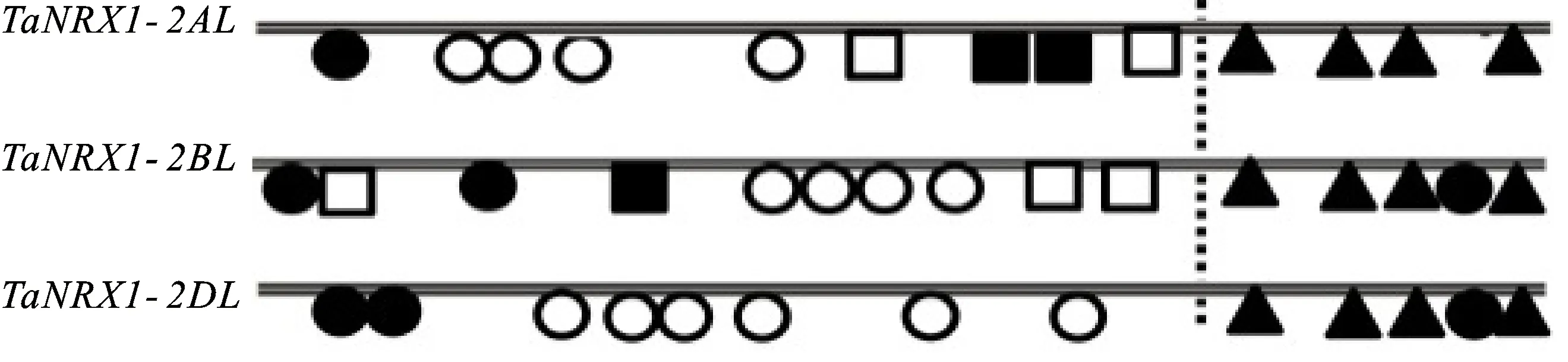
○代表“MeJA响应元件”;●代表“光响应元件”;□代表“MYB结合元件”;■代表“ABA响应元件”;▲代表“顺式调控元件”。
○: MeJA response elements;●:Light response elements; □:MYB binding elements;■:ABA response elements; ▲Cis regulatory elements.
图3TaNRX1基因上游调控元件分析
Fig.3Upstream regulatory elements ofTaNRX1gene
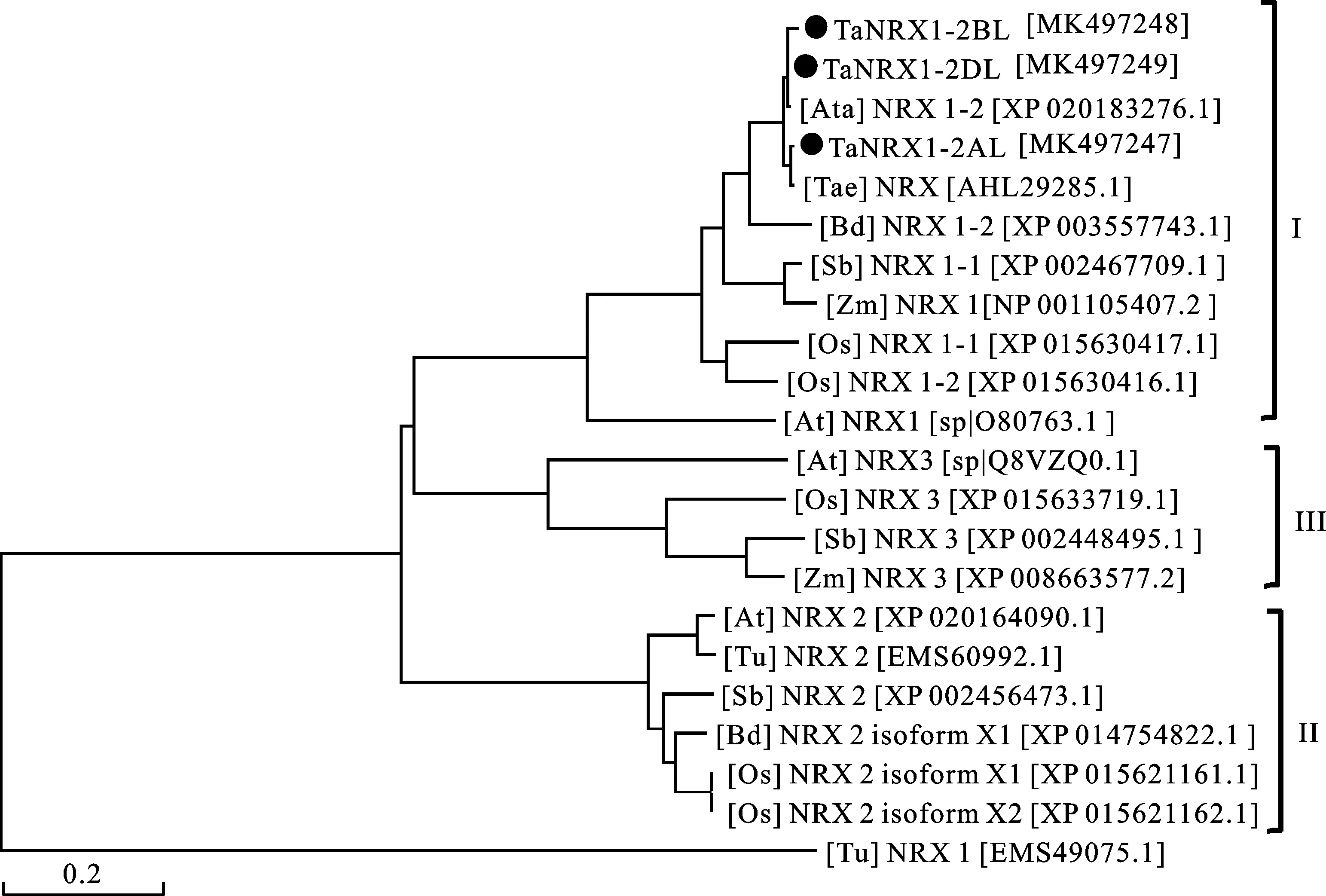
I:植物NRX家族第I亚类;II:植物NRX家族第II亚类;III:植物NRX家族第III亚类;[Ata]:粗山羊草;[Tae]:普通小麦;[Bd]:二穗短柄草;[Sb]:高梁;[Zm]:玉米;[Os]:水稻;[At]:拟南芥;[Tu]:乌拉尔图小麦。
I:Plant NRX subfamily I; II:Plant NRX subfamily II; III:Plant NRX subfamily III; [Ata]:Aegilopstauschiisubsp.Tauschii;[Tae]:Triticumaestivum;[Bd]:Brachypodiumdistachyon; [Sb]:Sorghumbicolor;[Zm]:Zeamays;[Os]:OryzasativaJaponicagroup;[At]:Arabidopsisthaliana;[Tu]:Triticumurartu.
图4 TaNRX1蛋白的聚类分析
Fig.4 Phylogenetic analysis of TaNRX1 proteins
蛋白二级结构分析显示, TaNRX1包含30%~31.21%的α-螺旋、18.62%~19.97%的β-折叠和48.53%~48.97%的无规则卷曲;三级结构分析显示, TaNRX1可以折叠形成一个C型的特定空间结构,包括4个结构单元(I~IV),每个单元均有反向平行的β-折叠和外围包被的α-螺旋构成。
2.3 籽粒发育进程中 TaNRX1的表达模式
利用qRT-PCR技术分析了籽粒发育过程中TaNRX1的表达模式,结果(图5)表明,在中国春和矮抗58中该基因的表达模式存在一定差异。在中国春中,TaNRX1在籽粒发育过程中呈逐渐下调趋势;而在矮抗58中该基因虽然整体上随籽粒的发育进程而下调表达,但在授粉后15 d和 25 d时出现两次表达量回升,这可能与矮抗58小麦品种在籽粒发育过程中具有较强的抗逆特性有关[16]。
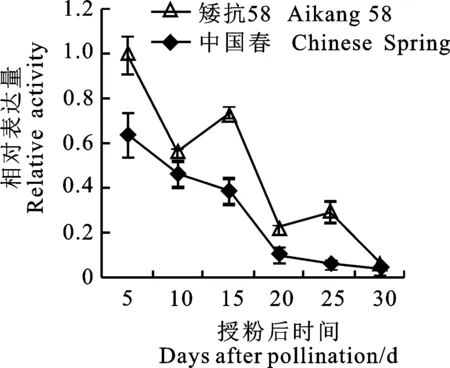
图5 小麦 TaNRX1在籽粒发育过程中的表达特性
2.4 TaNRX1基因的组织表达特性
通过检测不同组织中TaNRX1的表达特性(图6)发现,中国春中该基因在穗下节组织中的表达水平最高(为籽粒中的92倍),在节间和节等组织中次之(为籽粒中的42倍以上);在矮抗58中TaNRX1的组织表达模式与中国春相似,不过在所检测组织中(除节间外)该基因的表达量均低于中国春。TaNRX1在不同组织间的差异表达预示着该基因在小麦发育调控过程中发挥重要功能,在节间中两个品种间表达量的差异可能与品种的株高特性有关。
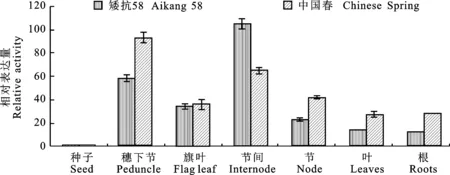
图6 TaNRX1在不同组织中的表达特性
3 讨 论
硫氧还蛋白是一类广泛存在于植物中的氧化还原调控蛋白,在调节细胞体内功能蛋白的氧化还原状态、蛋白的空间结构及活性等方面具有重要的生物学功能[17]。硫氧还蛋白超家族成员较多,依据其在细胞中的分布特点可分为位于叶绿体内的Trx-m、Trx-f、Trx-y、Trx-x、Trx-z、位于线粒体内的Trx-o、位于细胞质内的Trx-h以及位于细胞质和细胞核内的核氧还蛋白NRX[18]等。植物中核氧还蛋白可分为3个亚类,小麦的TaNRX1属于第I亚类,且在2AL、2BL和2DL位点存在3个成员;氨基酸序列特性分析显示, TaNRX1-2AL、TaNRX1-2BL和TaNRX1-2DL均包含3个TryX_like_TryX_NRX结构域,推测TaNRX1的3个成员间可能存在功能冗余;对TaNRX1蛋白C端氨基酸序列分析显示,该区域为典型的C1保守域,可与两个锌离子结合形成锌指结构。
小麦籽粒发育进程直接决定了其产量和品质[19],而硫氧还蛋白可能参与了籽粒发育的调控过程[20]。本研究发现,中国春和矮抗58小麦籽粒发育过程中TaNRX1逐渐下调表达,其表达水平与籽粒发育进程负相关;从TaNRX1的组织表达特性来看,该基因在快速生长的节间和节组织中表达水平最高,在生长缓慢的根和叶组织中表达水平次之,而在发育停滞的成熟种子中表达水平极低。由此推测,小麦TaNRX1基因在细胞分裂及发育调控过程中发挥重要功能。另外,序列分析表明TaNRX1的3个部分同源基因间在cDNA区域序列高度相似(98%),均可编码包含3个TryX_like_TryX_NRX保守结构的典型核氧还蛋白,推测小麦TaNRX1的3个部分同源基因间存在功能冗余;不过,在上游调控区(特别是上游340~1 300 bp的区域内)3个部分同源基因间存在较大差异,其中转录调控元件的类型、数量和位置均存在一定差异,预示着该基因3个部分同源基因间具有不同的转录调控模式。关于该基因3个部分同源基因间的时空表达模式差异及调控机制有待于进一步研究。

