硫对Ⅰ型玉米金属硫蛋白(Zea mays Metallothionein1)结合金属的影响研究
杜晓宇,孔晶晶,孙玥,段炼
(太原理工大学 化学化工学院,山西 太原 030024)
0 引言
金属硫蛋白(Metallothioneine,简称MT)是一类存在于生物体的由基因编码的、富含半胱氨酸的低分子量(<10 kDa)金属结合蛋白,广泛存在于动物界、植物界、真核微生物以及一些原核生物中[1-3],其对于体内必需金属离子(如Zn2+和Cu+等)的转运存储和代谢以及一些非必需金属离子(如Cd2+、Hg2+和Pb2+等)的解毒都起着重要的作用[4-5]。随着环境污染问题日益加剧,被污染的土壤和水体中很可能富集了大量有毒重金属离子,而其不能通过化学或生物方法处理被降解,进而可能在食物链中不断积累,对人类健康造成严重的威胁。MT作为一种重金属结合蛋白,可通过其上半胱氨酸残基中的巯基与具有d10构型的金属离子,如Zn2+,Cd2+和Hg2+等,以金属巯基螯合簇的形式稳定配位,形成无毒或低毒络合物从而降低重金属毒害[6-7]。近年来,MT因其高效的重金属解毒功能及安全性被广泛应用于医疗、农业、环保等领域。
除金属硫蛋白外,植物和某些微生物中研究的比较早的另一种金属结合蛋白为植物螯合肽(phytochelatins,简称PCs),其对于重金属离子的解毒也起着重要的作用[6,8]。Murasugi等[9-10]从S.pombe中分离出两种形式的Cd2+-PC复合物,一种是不含硫的低分子量复合物,另一种是含硫的高分子量复合物。在体外Na2S存在下用Cd2+滴定低分子量复合物,发现复合物的Cd2+和S2-结合能力增强,形成Cd2+/S2-比例更高的复合物。研究证明S2-的掺入与酵母中PCs的Cd2+结合能力增强有关,提高了系统解毒的有效性,且结合能力取决于反应体系中硫化物的浓度[11]。此外,S2-还可以提高镉γ谷氨酰肽复合物的热力学和pH稳定性[12]。在各种重组表达的融合蛋白,如哺乳动物MT1和MT4[13-14]以及QuercussuberMT2[15-16]中也可检测到硫离子。基于MT与PCs能够螯合大量金属离子的相似性质,一些研究者对硫化物是否也能增强金属硫蛋白的金属离子结合能力进行了研究。如mouse MT4的α和β域两个结构域,在无S2-时分别结合4个和3个二价金属离子;当提供S2-时结合能力增加到4.6个Cd2+和3.9个Cd2+[13]。重组表达的植物QuercussuberMT2配位约5个二价金属离子;在S2-存在下,结合的CdⅡ数量增加,使该植物MT2的CdⅡ结合能力提高多达40%[15-17]。
玉米是重要的粮食作物和饲料作物,也是全世界总产量最高的农作物。目前在我国玉米的播种面积仅次于水稻和小麦,在粮食作物中居第三位。我们在前期的研究工作[18]中首次通过基因工程的方法在体外重组表达得到了Ⅰ型玉米金属硫蛋白(ZeamaysMetallothionein1,ZmMT1),且对其金属离子结合性质进行了研究,结果表明玉米金属硫蛋白的apo-ZmMT1形式最多可以结合6个Zn2+、6个Cd2+、10个以及更多的Pb2+。对于硫离子的加入是否会影响高等植物特别是农作物体内存在的金属硫蛋白的重金属结合能力目前没有明确结论。本文在前期研究工作基础上探究ZmMT1在Na2S存在条件下,在植物体外是否可以增强ZmMT1的金属离子结合能力,同时探究了S2-浓度和组分加入顺序对ZmMT1的金属离子结合性质的影响。
1 材料和方法
1.1 主要化学试剂
三(羟甲基)氨基甲基盐酸盐(Tris-HCl,100 mmol/L,pH 8.0);二硫苏糖醇(DTT);5,5′-二硫代双(2-硝基苯甲酸)(5,5-dithiobis-(2-nitrobenzoic acid),DTNB,5 mmol/L);Cd标准溶液(1 mL溶液含1 mg Cd)购于天津傲然精细化工研究所;Zn(NO3)2·6H2O(0.01 mol/L);Na2S(0.01 mol/L);所有生化试剂均为Solarbio公司产品,其他化学品均为分析纯。所有溶液均使用去离子水制备。如有必要,溶液用氮气饱和。
1.2 主要实验仪器
SW-CJ-1FD(标准型)单人垂直净化工作台;FE20 METTLER TOLEDO pH计;UV-1800型紫外分光光度计(日本岛津公司);DZ-C-1全温振荡器;Milipore超滤管(3 kDa);Eppendorf移液枪;氮气钢瓶。
1.3 紫外可见光(UV/Vis)光谱测量
紫外可见吸收光谱在紫外可见分光光度计(岛津UV-1800)上进行UV吸收测量,扫描速度为600 nm·min-1,扫描波长范围为200~400 nm,用Origin 8.0进行实验数据的曲线拟合并最终用摩尔吸光系数(L·mol-1·cm-1)表示。所有的光谱都在室温下记录。
1.4 原核表达载体构建及蛋白表达纯化
我们之前的报道[18]详细介绍了原核表达载体pGEX-6P-1-ZmMT1的构建及其使用含有ZmMT1基因的大肠杆菌BL21(DE3)菌液进行玉米金属硫蛋白的表达与纯化过程。概括来说,将含有目的基因的BL21菌液置于含有氨苄青霉素的新鲜LB液体培养基中扩大培养,180 r/min,37℃下振荡培养。待OD600约为0.6~0.8时,加入1 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)继续诱导表达蛋白,37℃震荡培养3~3.5 h,4 ℃,8 000 r/min离心收菌。将收集的菌体重悬于70~80 mL PBS(pH 7.3)缓冲溶液中,并在冰浴环境中通过超声破碎菌体细胞,之后离心收集上清进行纯化。将菌体上清置于用PBS平衡的GST亲和层析柱,摇床上冰浴结合后挂柱弃去杂蛋白。在存在200 mmol/L二硫苏糖醇(DTT)的情况下,GST-ZmMT1融合蛋白用PPase蛋白酶在4℃下过夜酶切。将洗脱的粗品ZmMT1转移至3 kDa截留分子量超滤离心管中超滤浓缩纯化。蛋白纯化结果见已发表的工作[18]。
1.5 金属离子滴定
1.5.1 硫离子存在条件下ZmMT1与金属离子的结合性质探究
将表达纯化得到的ZmMT1纯品,分别在不存在S2-以及[S2-]∶[apo-ZmMT1]=10∶1情况下用Zn2+和Cd2+滴定蛋白溶液(10 μmol/L,pH 8.0 Tris-HCl缓冲溶液)。每次滴定,将1 mL蛋白溶液转移到1 cm的比色皿中。S2-以Na2S溶液的形式加入,并将S2-和蛋白溶液的混合物于37℃恒温培养箱温育30 min后,以上述同样步骤进行金属离子滴定。所有实验滴定过程都在氮气流下进行。
1.5.2 不同硫离子浓度对ZmMT1与金属离子结合特性探究
为了探究植物ZmMT1是否具有根据金属离子浓度和细胞供应硫化物来调节结合重金属的能力,在体外存在0、5、10、15、20、25和30倍apo-ZmMT1量S2-的情况下用Cd2+滴定蛋白溶液(15 μmol/L,pH 8.0 Tris-HCl缓冲溶液),分析不同S2-浓度对ZmMT1与金属离子结合性质的影响。具体为将1 mL蛋白溶液与不同摩尔比S2-于37 ℃温育30 min后,在室温氮气氛围中进行Cd2+滴定,通过紫外光谱观察LMCT谱带的变化。
1.5.3 不同滴加顺序对ZmMT1与金属离子结合性质探究
为了初步探究含硫的CdⅡ-巯基簇形成的机理,改变apo-ZmMT1(11 μmol/L)、Cd2+(不同摩尔比)和S2-(0.01 mol/L)溶液的加入顺序。所有滴定过程都进行UV光谱分析,具体步骤如下所述,实验使用如上所述的同一比色皿。
“apo-ZmMT1+10 S2-+x Cd2+”:将11 μmol/L apo-ZmMT1与浓度为0.01 mol/L的S2-温育30 min,在氮气流中用Cd2+不断滴定含S2-的apo-ZmMT1溶液,于室温下培养2 min直到观察到稳定的紫外吸收光谱,记录实验数据。
“apo-ZmMT1+x Cd2++10 S2-”:将11 μmol/L apo-ZmMT1与所需的等量的Cd2+混合,温育10 min,然后加入S2-。在氮气流中于室温下培养2 min,在紫外分光光度计上扫谱,记录实验数据。
“x Cd2++10 S2-+apo-ZmMT1”:取不同量的Cd2+与浓度为0.01 mol/L的S2-温育10 min,然后加入11 μmol/L apo-ZmMT1。在氮气氛围下于室温培养2 min,在紫外分光光度计上扫谱,记录实验数据。
2 实验结果和讨论
2.1 硫离子存在条件下ZmMT1与金属离子的结合性质探究
2.1.1 ZnⅡ-和ZnⅡ/S-型ZmMT1
当在[S2-]∶[apo-ZmMT1]=10∶1情况下用Zn2+滴定ZmMT1时,形成ZnⅡ/S-ZmMT1复合物,配体-金属电荷转移(LMCT)带在265 nm处产生吸收峰(图1A);无S2-时滴定形成ZnⅡ-ZmMT1复合物(图1B),LMCT带在约230 nm处产生轻微肩峰,肩峰的本质主要归因于巯基配体向金属的电荷转移过渡到Zn2+的4s轨道,从而产生共价性,其对金属巯基复合物相互作用贡献约50%,其余约50%来自离子相互作用[19]。对比存在S2-时的滴定光谱发生了LMCT带的红移变化,这种现象与用Na2S滴定含ZnⅡ和半胱氨酸比例为1∶2的溶液,且在260至280 nm之间出现新的吸收峰结果相类似[20]。以265 nm处的摩尔吸光系数相对于添加的Zn2+绘图(图1A,插图),观察到在添加至Zn2+量为apo-ZmMT1量8倍左右,吸收光谱基本保持恒定;而在没有S2-情况下的滴定,仅结合了约6倍apo-ZmMT1量Zn2+(图1B,插图),这表明apo-ZmMT1对Zn2+的结合能力在硫化物存在下增强。
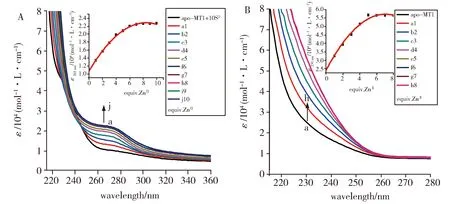
Fig.1 A: [S2-]∶[apo-ZmMT1]=10∶1, UV spectra of 10 μmol/Lapo-ZmMT1 were titrated with Zn2+ in a buffer containing 100 mmol/L Tris-HCl, pH 8.0,The inset shows the change of molar absorption coefficient of the LMCT band at 265 nm as the amount of Zn2+ ions added;B: UV spectra of the analogous titration with Awhen there is no S2-ions,In the inset the molar absorption coefficientat 230 nm is plotted against the added Zn2+ ions图1 A:[S2-]∶[apo-ZmMT1]=10∶1时,在100 mmol/L Tris-HCl,pH=8.0的缓冲溶液中用Zn2+滴定10 μmol/L ZmMT1的UV光谱图,插图显示了在265 nm处随着Zn2+的量增加LMCT带的摩尔吸收系数的变化;B:无S2-时和A同样滴定的UV光谱图,插图以230 nm处光谱的摩尔吸收系数相对于添加的Zn2+离子绘图
2.1.2 CdⅡ-和CdⅡ/S-型ZmMT1
为了进一步研究硫离子对ZmMT1结合重金属离子的影响,我们在S2-存在条件下用Cd2+进行滴定。当在[S2-]∶[apo-ZmMT1]=10∶1情况下Cd2+滴定ZmMT1时,形成CdⅡ/S-ZmMT1复合物,LMCT带在275 nm附近的吸收增加(图2A),且在加入约10倍apo-ZmMT1量的Cd2+之后,吸收强度逐渐恒定(图2A,插图)。而CdⅡ-ZmMT1型,即不存在S2-时LMCT带在约255 nm处形成明显的酰胺带肩峰(图2B),该能带的形成主要由于S→Cd2+的跃迁进入Cd2+的5s轨道;同时涉及配体到配体电荷转移(LLCT)跃迁,即从巯基中的硫到反键pπ(pπ*)轨道[5]。随着Cd2+量的增加,255 nm附近的吸收增加并且在添加到Cd2+量为apo-ZmMT1量6倍左右吸收光谱基本保持恒定(图2B,插图)。相比没有S2-时的滴定,ZmMT1对Cd2+的结合能力在S2-存在下明显增强,而且CdⅡ/S-ZmMT1复合物的特征吸收带相对于CdⅡ-ZmMT1复合物的特征吸收带显示出明显的红移。
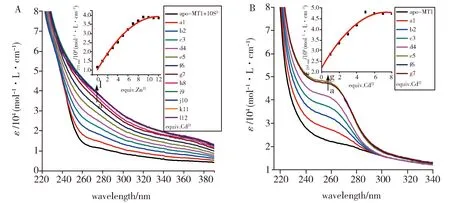
Fig.2 A: [S2-]∶[apo-ZmMT1]=10∶1, UV spectra of 10 μmol/L apo-ZmMT1were titrated with Cd2+ in a buffer containing 100 mmol/L Tris-HCl, pH 8.0,The inset shows the change in the molar absorption coefficient of thered shifted LMCT band at 275 nm plotted against the Cd2+ ions;B: UV spectra of the analogous titration with A when there is no S2- ions,In the inset the molar absorption coefficient at 255 nm is plotted against increased Cd2+图2 A: [S2-]∶[apo-ZmMT1]=10∶1时,在100 mmol/L Tris-HCl,pH=8.0的缓冲溶液中用Cd2+滴定10 μmol/L apo-ZmMT1的UV光谱图,插图显示275 nm处红移LMCT带的摩尔吸收系数相对于Cd2+的变化曲线;B:无S2-时和A同样滴定的UV光谱图。插图以255 nm处的摩尔吸收系数对增加的Cd2+作图
LMCT带的红移变化是MT中金属巯基复合物形成的特征,通过形成金属巯基螯合簇结构扩大金属离子结合能力,其中簇状结构中的一部分末端半胱氨酸硫醇配体向桥连配体转变[21]。当簇的尺寸增加时,对于巯基封端CdS颗粒也观察到类似的带向更高波长移动[22]。如上述实验所揭示的,在硫离子存在下的滴定显示不同金属的特征LMCT带向更高波长方向移动,说明硫离子结合到金属巯基簇中进一步扩大了金属离子结合能力。其他一些研究中,比如在CdⅡS-cicMT2的形成过程中[23],以及在S.pombe的含硫PC复合物中[24],也观察到类似的吸收带红移变化,表明硫化物结合到镉(Ⅱ)巯基簇中。
2.2 不同硫离子浓度对ZmMT1与金属离子结合特性探究
为了评估ZmMT1上的最大Cd2+结合能力,我们用较高波长,即275 nm下的摩尔吸光系数对添加到溶液中的Cd2+作图,以避免S2-对蛋白质270 nm以下总体吸收的影响。如图3A,在没有S2-的情况下形成CdⅡ-ZmMT1物质,吸收强度最低,随着S2-浓度的增加,特征吸收峰的强度在不断增加,结合的Cd2+量也不断增加(图3A,插图)。原因可能由于蛋白结构在不断扩展以适应不断增大的金属巯基簇结构,而没有整体蛋白质大小的变化,或者说其流体动力学半径没有变化[25]。随着溶液中S2-初始浓度的增加,结合的Cd2+的量呈线性增加趋势(图3B),促进了Cd2+在蛋白上的结合;但是S2-浓度不宜过高,否则会形成蛋白质二聚体、三聚体或更高的聚集体以及CdS聚体,影响蛋白结合能力,对于ZmMT1最高应控制在30倍MT量之内。也就是说适当增加S2-浓度可以增大ZmMT1的金属离子结合能力。
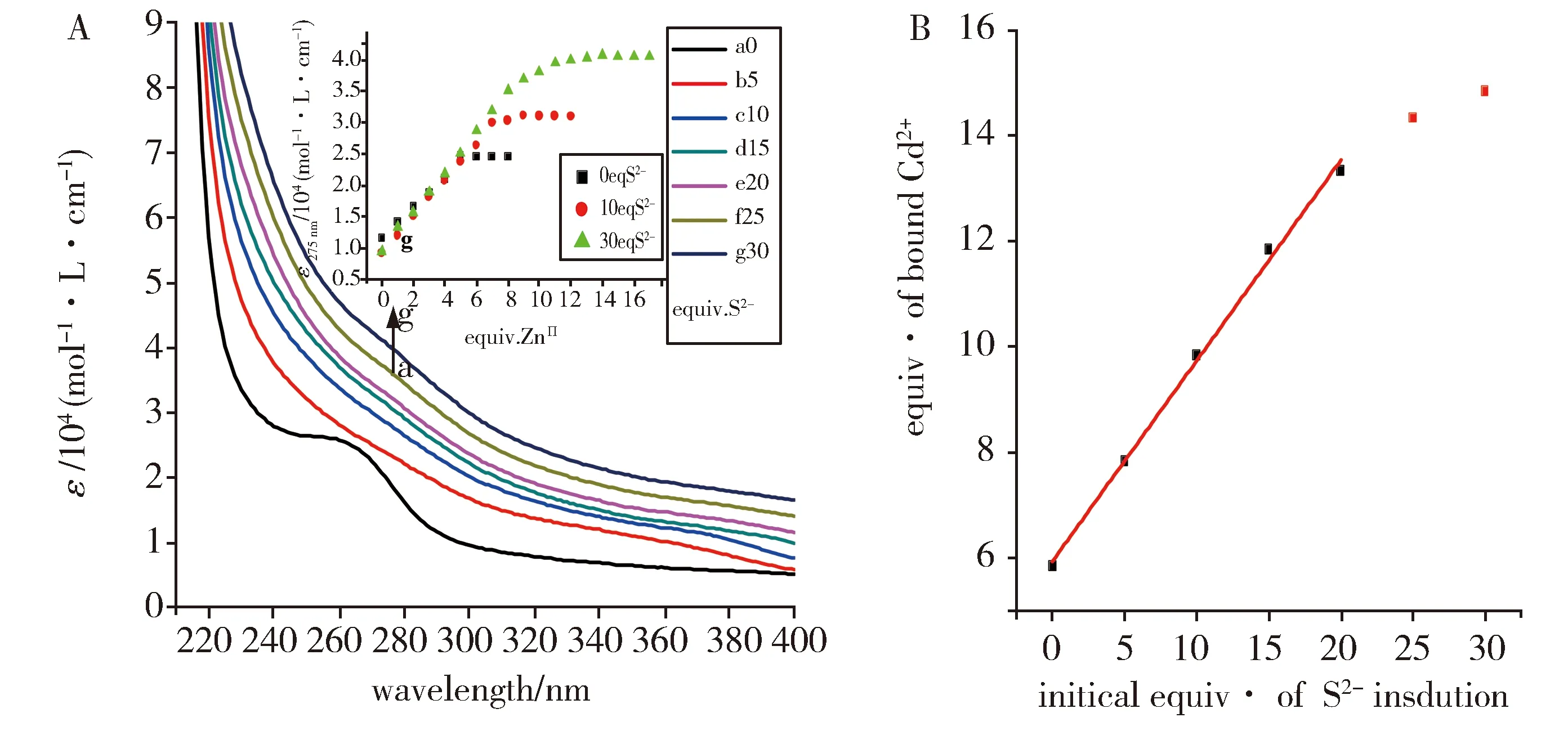
A: UV spectra of Cd2+ ions saturated ZmMT1 solution containing different concentrations of S2-.The inset shows the molar absorption coefficient curve at 275 nm of the titration of ZmMT1solution containing different sulfide concentrations with Cd2+ ions;B: Number of saturated Cd2+ bound by ZmMT1 under different S2- ion concentrations conditionsFig.3 Effect of S2-concentrations on apo-ZmMT1 bound Cd2+ propertiesA:Cd2+饱和的含不同浓度S2-蛋白溶液的紫外光谱图,插图为Cd2+滴定含不同S2-浓度的蛋白溶液在275 nm处的摩尔吸收系数变化曲线;B:不同S2-浓度条件下蛋白结合的饱和Cd2+个数随硫离子S2-浓度变化曲线,图3 S2-浓度对蛋白结合Cd2+性质的影响
2.3 不同滴加顺序对ZmMT1结合Cd2+性质影响研究
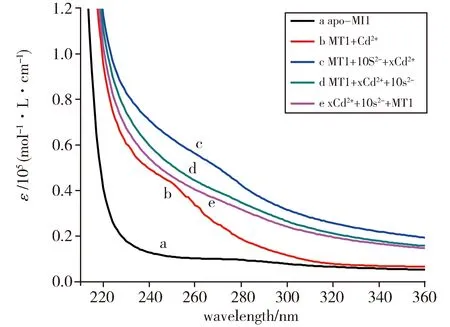
Fig.4 Final UV spectra of 11 μmol/L apo-ZmMT1titrated in a buffer containing 100 mmol/L Tris-HCl,pH 8.0, the order of addition of Cd2+ and S2- ions was changed图4 在含有100 mmol/L Tris-HCl,pH=8.0的缓冲液中滴定11 μmol/L apo-ZmMT1的终点的UV光谱图,Cd2+和S2-组分添加的顺序改变
为了评估如上所述的组分加入过程对于S2-掺入效率以及随之对结合Cd2+的能力的影响,我们改变了各个组分的添加顺序,滴定光谱结果如图4所示。由图可观察到,含硫的CdⅡ-巯基簇的形成导致275 nm附近和更高波长处的吸收带的变化。“ZmMT1+10 S2-+x Cd2+”这种组分添加顺序的光谱的摩尔吸光系数最大(图4线c),而“ZmMT1+x Cd2++10 S2-”(图4线d)和“x Cd2++10 S2-+ZmMT1”(图4线e)两种添加顺序的光谱的摩尔吸光系数明显减小,位于不含硫离子(图4线b)和含硫离子物质(图4线c)的光谱之间。“ZmMT1+x Cd2++10 S2-”和“x Cd2++10 S2-+ZmMT1”两种组分添加顺序的紫外滴定光谱表明ZmMT1结合Cd2+的能力没有明显增强。这个实验结果和Huber等[25]得出的结果相同,即该两种组分添加顺序的变化都不能成功地使S2-掺入到簇中,只有当apo-MT1在加入Cd2+之前首先与S2-一起温育,S2-才能最大程度掺入到金属巯基螯合簇中。这种现象可能是由于Cd2+与S2-先形成类似中性的1∶1 CdS复合物,这个复合物可以被蛋白质结合,而之后聚集的更高摩尔质量的阴离子复合物不被结合[25]。此现象和低温水溶液中形成矿物ZnS的过程的现象类似,即先形成具有1∶1(ZnS)化学计量的中性配合物,随着硫化物继续添加和水配体结合生成更大的阴离子络合物,如Zn4S64-四聚体[26]。因此,MT必须能够与先形成的Cd/S复合物竞争Cd2+,才能使S2-成功地掺入到簇中从而增大Cd2+结合能力。综上可以推测出只要溶液中存在Cd2+,S2-就会先和Cd2+结合,而不能成功地和蛋白溶液结合。用蛋白质的Cys-S配体替换水或其他不亲硫配体是一个增大硫离子掺入MT可行的机制。
3 结论
本文我们通过实验证明,在存在硫离子的情况下一定程度上能增强植物MT如ZmMT1的金属离子结合能力;且随着硫离子浓度的增加,ZmMT1的金属离子结合能力逐渐增强,但硫离子浓度应控制在一定范围内(≤30∶1),否则会形成蛋白质聚集体,影响结合能力。此外通过探究不同物质添加顺序对ZmMT1结合金属性质的影响表明,CdⅡ/S-巯基簇形成遵循一定的路径,也就是说蛋白溶液在用Cd2+滴定之前先与S2-温育才可以使S2-成功的掺入到金属巯基螯合簇中同时增强MT的金属离子结合能力;而改变滴加顺序时,由于Cd2+对S2-的络合能力更强,则使得S2-不能很好地掺入到金属巯基簇中,削弱了S2-对蛋白金属结合能力增强的特性。对有机体来说,适量掺入S2-不失为一种增强有机体金属结合能力的经济有效的方式,为金属硫蛋白更有效地清除重金属离子提供有用的借鉴及理论支撑。然而,硫化物掺入植物MTs中是否会产生某些生理相关反应仍然需要进一步探索。

