疏风止痉方对耐药性癫痫大鼠脑组织NF-κB p65表达的影响及脑脊液卡马西平浓度影响*
戎 萍,闫 融,马茗晗,张喜莲,马 融
(天津中医药大学第一附属医院儿科,天津 300193)
近年来,国内外研究发现,炎症反应不仅是癫痫诱导的结果,还是引起癫痫发生、发展的最重要机制[1],且炎性因子可提高P糖蛋白(P-gp)多药耐药的表达,从而阻断抗癫痫西药进入脑内,不能发挥抗痫作用。中药复方疏风止痉方是由导师马融教授根据“疏风解表、开通经络”的治疗原则,由银翘散化裁而来。银翘散本为治疗风热外感的有效方剂,具有疏风解表、清热解毒的作用[2],西医学认为具有抗炎的作用[3],且有研究表明以疏风为主的银翘散可降低炎症信号通路NF-κB相关蛋白的表达[4],并可调节NF-κB炎症信号通路上下游细胞因子的水平[5-6],降低P-gp的表达,从而提高脑脊液中卡马西平的浓度,来达到逆转耐药性癫痫的目的。本实验拟从研究疏风止痉方对耐药性癫痫大鼠海马NF-κB、P-gp的表达及脑脊液中卡马西平浓度的影响,观察疏风止痉方是否可以提高脑内抗痫药物的浓度,为临床中药复方添加治疗耐药性癫痫提供实验依据。
1 实验材料
1.1 实验动物 健康SD大鼠100只,体质量(80±5)g,由北京维通利华实验动物技术有限公司提供。
1.2 实验药品及试剂 氯化锂(批号为115K1308,100 g/瓶,美国Sigma公司);阿托品(批号为国药准字 H12020382,0.5 mg/mL×10 支/盒,天津金耀药业有限公司);盐酸匹罗卡品(批号为S31556,100 mg/瓶,美国Sigma公司);地西泮注射液(批号为国药准字0804032,每2 mL含10 mg,天津金耀氨基酸有限公司);卡马西平(批号为国药准字H11022279,200 mg/片,北京诺华制药公司);丙戊酸钠口服液(批号为国药准字 H20041435,300 mL,12 g/瓶,赛诺菲制药有限公司);吡咯烷二硫代氨基甲酸盐(PDTC,批号为 S30342,25 g/瓶,美国 Sigma公司);疏风止痉方饮片(由天津中医药大学第一附属医院提供)。
2 实验方法
2.1 点燃癫痫大鼠模型 100只大鼠随机选取10只作为正常对照组。其余90只采用氯化锂-匹罗卡品点燃癫痫发作。采用Racine6级评价标准:0级:无反应;Ⅰ级:耳、面部肌肉抽搐;Ⅱ级:肌阵挛,但无直立位;Ⅲ级:肌阵挛,伴直立位;Ⅳ级:全身强直阵挛发作;Ⅴ级:全身强直阵挛发作,并失去体位控制。痫性发作达到Ⅳ级及以上,解除痫性发作后存活状态良好的大鼠为合格癫痫模型大鼠。在点燃过程中大鼠死亡8只,未达到级别9只,剩余73只进行耐药癫痫模型的建立。
2.2 建立耐药性癫痫大鼠模型 将存活良好的癫痫模型大鼠先经过14 d丙戊酸钠预处理,筛选出每周发作次数大于10次的大鼠,作为耐丙戊酸钠癫痫大鼠。再将耐丙戊酸钠癫痫大鼠经过14 d卡马西平预处理,筛选出每周发作次数大于10次的癫痫大鼠,将耐丙戊酸钠及卡马西平癫痫大鼠作为耐药性癫痫大鼠模型。在建立耐药癫痫模型过程中,有11只大鼠因解痉无效死亡,12只每周发作次数少于10次,成功筛选的耐药癫痫模型50只。
2.3 分组及给药 将未造模的正常大鼠与筛选出的50只耐药癫痫模型大鼠分为6组:1)正常对照组:生理盐水按10 mL/kg/次,灌胃,每天2次。2)耐药模型组:卡马西平按15 mg/kg/次,灌胃,每天2次。3)阳性对照组:先后予NF-κB特异性抑制吡咯烷二硫代氨基甲酸盐(PDTC)75 mg/kg/次、卡马西平15 mg/kg/次,灌胃,两种药物间隔30 min,每天2次。4)疏风止痉方低剂量组:先后予低剂量疏风止痉方按生药含量2 g/mL配置成溶液10 mL/kg/次、卡马西平15 mg/kg/次,灌胃,两种药物间隔30 min,每天2次。5)疏风止痉方中剂量组:先后予中剂量疏风止痉方按生药含量4 g/mL配置成溶液10 mL/kg/次、卡马西平15 mg/kg/次,灌胃,两种药物间隔30 min,每天2次。6)疏风止痉方高剂量组:先后予高剂量疏风止痉方按生药含量6 g/mL配置成溶液10 mL/kg/次、卡马西平15 mg/kg/次,灌胃,两种药物间隔30 min,每天2次。各组灌胃均持续28 d。
2.4 监测各组大鼠发作情况 采用影像监控系统对所有实验大鼠全程监控并观察各组大鼠反复自发性发作(SRS)的情况。
2.5 免疫组化法检测海马NF-κBp65及脑组织P-gp分布 取各组大鼠脑组织甲醛固定、石蜡包埋,切片后进行脱蜡、入水清洗,依次滴加第一抗体、第二抗体后二氨基联苯胺(DAB)显色、苏木素染色封片。
2.6 蛋白免疫印迹法检测海马NF-κBp65及脑组织P-gp蛋白表达 提取各组大鼠组织目标蛋白样品,进行凝胶、电泳、转模、封闭、一抗孵育、二抗孵育后进行检测。
2.7 高效液相发检测脑脊液卡马西平浓度 大鼠头部剃毛清洁,固定于脑立体定位仪:68002,颅骨处于水平位,头部开小口,暴露颅骨表面。左侧海马定位坐标处,用STRONG90+102颅骨钻钻颅打孔,插入探针导管。以人工脑脊液Ⅰ冲洗1小时后收集样品,立即转存入-80℃冰箱保存。分别以水-甲醇-乙腈=45:45:10为溶剂,配制浓度为0.250、1.000、3.000、5.000、7.500、10.000 μg/mL 的溶液绘制标准曲线,用以日本岛津高效液相色谱仪按色谱条件对各实验组大鼠脑脊液卡马西平进行测定。
2.8 统计方法 使用SPSS 21.0统计软件进行数据分析,计量资料以均值±标准差()表示,符合正态分布和方差齐性的数据组间比较采用单因素方差分析,偏态分布和方差不齐的数据组间比较采用秩和检验。P<0.05为差异具有统计学意义。
3 实验结果
3.1 各组大鼠痫性自主发作情况 除正常对照组以外,其他各组大鼠均有癫痫发作;与耐药模型组比较,阳性对照组发作次数虽然有所减少,但两组之间无统计学差异,而与疏风止痉方各剂量组均有统计学差异(P<0.05);随着中药剂量的增加,发作次数呈递减趋势,且各组之间均有统计学差异(P<0.05)。见表1。
表1 疏风止痉方对耐药性癫痫大鼠SRS的影响()Tab.1 Effect of Shufeng Zhijing Prescription on SRS in rats with drug resistant epilepsy()

表1 疏风止痉方对耐药性癫痫大鼠SRS的影响()Tab.1 Effect of Shufeng Zhijing Prescription on SRS in rats with drug resistant epilepsy()
注:与正常对照组比较,*P<0.05;与耐药模型组比较,□P<0.05;与阳性对照组比较,△P<0.05;与疏风止痉方低剂量组比较,#P<0.05;与疏风止痉方中剂量组比较,▲P<0.05。
组别 动物数 SRS发作次数正常对照组 10 0耐药模型组 10 17.3±2.75*阳性对照组 10 15.4±2.67*疏风止痉方低剂量组 10 12.2±2.25*□△疏风止痉方中剂量组 10 9.2±2.53*□△#疏风止痉方高剂量组 10 6.4±2.41*□△#▲
3.2 免疫组化法检测海马NF-κBp65及脑组织P-gp分布 免疫组化评分以5个视野内阳性细胞数即IHS为评分标准:A为阳性细胞数分级,其中,0%=0、1~10%=1、11~50%=2、51~80%=3、81~100%=4;B为阳性细胞显色强度分级,其中,无着色为0,淡黄色为 1,棕黄色为 2,棕褐色为 3;则 IHS=A×B,将染色结果分为 4级:0~2为阴性表达(-);IHS≥3为阳性表达:3~4为弱阳性(+),6~8为阳性(++),9~12为强阳性(+++)。
3.2.1 NF-κBp65的分布表达 各组NF-κB阳性细胞的表达分为4级(阴性-、弱阳性+、阳性++、强阳性+++),均未出现强阳性;各组间比较存在显著性差异(P<0.05),组间两两比较,耐药模型组(2例+、4例++)及疏风止痉方低剂量组(1例-、1例+、4例++)与正常对照组(4例-,2例+)比较有统计学差异(P<0.05);疏风止痉方高剂量组阳性表达例数(1例-、3例+、2例++)低于疏风止痉方低剂量组,但无统计学差异(P>0.05)。见图 1。

图1 各组NF-κB阳性表达情况Fig.1 NF-κB positive expression in each group
3.2.2 P-gp分布表达 各组P-gp分布表达分为4 级(阴性-、弱阳性+、阳性++、强阳性+++),正常对照组(3例-、3例+)与疏风止痉方高剂量组(1例-、2 例+、3 例++)无统计学差异(P>0.05);疏风止痉方高剂量组表达水平低于耐药模型组、疏风止痉方低剂量组、疏风止痉方中剂量组(均为2例+、4例++),无统计学差异(P>0.05)。见图 2。

图2 各组P-gp的表达情况Tig.2 Expression of P-gp in each group
3.3 Western blot法检测海马NF-κBp65及脑组织P-gp蛋白表达
3.3.1 海马NF-κBp65蛋白表达 与耐药模型组相比,阳性对照组NF-κB p65蛋白表达稍低,但无统计学差异(P>0.05);中药各剂量组蛋白表达均低于耐药模型组及阳性对照组,且有统计学差异(P<0.05),随着中药剂量的增加,NF-κB p65 蛋白表达量呈递减趋势,且疏风止痉方高剂量组、疏风止痉方中剂量组与疏风止痉方低剂量组均有统计学差异(P<0.05)。见图 3、表 2。
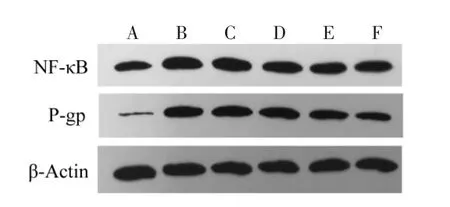
图3 各组NF-κBp65、P-gp蛋白定量灰度图Tig.3 Quantitative grayscale map of NF-κBp65 and P-gp proteins in each group
表2 各组NF-κB p65及P-gp蛋白表达()Tab.2 Expression of NF-κB p65 and P-gp proteins in each group()
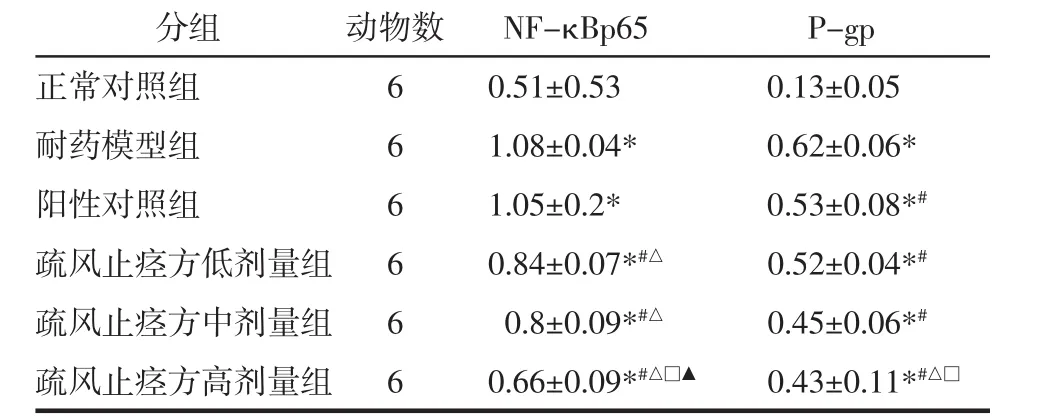
表2 各组NF-κB p65及P-gp蛋白表达()Tab.2 Expression of NF-κB p65 and P-gp proteins in each group()
注:与正常对照组比较,*P<0.05;与耐药模型组比较,#P<0.05;与阳性对照组比较,△P<0.05;与疏风止痉方低剂量组比较,□P<0.05;与疏风止痉方中剂量组比较,▲P<0.05。
分组 动物数 NF-κBp65 P-gp正常对照组 6 0.51±0.53 0.13±0.05耐药模型组 6 1.08±0.04* 0.62±0.06*阳性对照组 6 1.05±0.2* 0.53±0.08*#疏风止痉方低剂量组 6 0.84±0.07*#△ 0.52±0.04*#疏风止痉方中剂量组 6 0.8±0.09*#△ 0.45±0.06*#疏风止痉方高剂量组 6 0.66±0.09*#△□▲ 0.43±0.11*#△□
3.3.2 脑组织P-gp蛋白表达 与耐药组比较,其他各组P-gp蛋白表达均有所下降,且有显著性差异(P<0.05);与对照组比较,疏风止痉方各剂量组蛋白表达量均有所下降,但只与疏风止痉方高剂量组有显著性差异(P<0.05);疏风止痉方各剂量组随着中药剂量增加蛋白表达量呈递减趋势,且疏风止痉方高剂量组与疏风止痉方低剂量组有显著差异(P<0.05)。见图 3、表 2。
3.4 高效液相法检测脑脊液卡马西平浓度 除正常对照组,与耐药模型组比较,各组脑脊液卡马西平浓度均升高,但只与阳性对照组有统计学差异(P<0.01);与阳性对照组比较,疏风止痉方各剂量组脑脊液卡马西平浓度均降低,与疏风止痉方低剂量组、疏风止痉方中剂量组比较有统计学差异(P<0.05);疏风止痉方各剂量组随着中药剂量的增加,脑脊液中卡马西平浓度呈递增趋势,疏风止痉方中剂量组比疏风止痉方低剂量组平均升高15.38%,疏风止痉方高剂量组比疏风止痉方中剂量组平均升高20%,3 组之间无统计学差异(P>0.05),见表 3。
表3 各实验组大鼠脑脊液中卡马西平浓度()Tab.3 Level of carbamazepine in cerebrospinal fluid of each group() μg/mL

表3 各实验组大鼠脑脊液中卡马西平浓度()Tab.3 Level of carbamazepine in cerebrospinal fluid of each group() μg/mL
分组 动物数 浓度耐药模型组 4 0.64±0.13阳性对照组 4 1.06±0.20疏风止痉方低剂量组 4 0.65±0.15疏风止痉方中剂量组 4 0.75±0.24疏风止痉方高剂量组 4 0.90±0.23
4 讨论
癫痫是儿科常见神经系统疾病之一。经过正规中医、中西医结合治疗有70%~80%的癫痫可得到有效控制,但仍有30%左右成为耐药性癲痫[7]。癫痫患者治疗不够及时使病程拖延长久是引起癫痫耐药的危险因素[8-9],并且有研究[10-11]报道,癫痫患者首次治疗前发作频繁也是造成癫痫耐药的重要因素。临床研究发现耐药性癫痫的特征表现是,如果患者对一种抗癫痫药物耐受,往往也对其他抗癫痫药物不敏感,即使这些药物的作用机制、分子结构不同[12]。耐药性癫痫的形成严重影响患儿认知功能,降低生活质量。近年来,有大量研究发现癫痫动物模型和癫痫患者脑组织中及外周血中均有显著的炎性反应现象,白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、环氧化酶-2(COX-2)等以细胞因子为主的炎性介质显著异常表达[13-14]。而炎性细胞因子和神经系统兴奋活性递质可激活NF-κB,通过促进相关基因表达可进一步促使炎性细胞因子合成与释放。长时期TNF-α的刺激可使多药耐药P糖蛋白的表达和转运功能被激活[15]。近年来研究报道证实大部分AEDs是P-gp的底物[16],在病理情况下,过度表达的P-gp与抗癫痫药物结合,将药物从细胞内泵入血液中,使药物无法发挥药效,从而产生耐药机制。
疏风止痉方由马融教授根据银翘散化裁而来。中医认为,难治性癫痫病程日久,痰、热、瘀等病理因素长期伏留,现代医学研究发现癫痫反复发作引发炎症反应。由银翘散化裁而来的疏风止痉方主要由:金银花、连翘、荆芥穗、淡豆豉、桔梗、牛蒡子、淡竹叶、薄荷、芦根、甘草、金果榄、全蝎组成。银翘散原方具有疏风解表、开通经络的功效,不但使邪有出路,还能助药直达病所,此外方中加入金果榄清热利咽,并以全蝎加强通络止痉之功。全方共奏疏风止痉、清热通络之功效。正如《幼幼集成》云:“凡小儿诸般痫证,先服消风丸七服。此非治痫之药,用以疏散外感,开通经络,庶后药得以流通故而。”现代药理研究显示,金银花、连翘的有效成分有较强的抗炎作用,且金银花可以显著抑制NF-κB的激活及从细胞质到细胞核的易位并抑制NF-κB的DNA结合活性[17-18]。全蝎抗癫痫的机制可能是全蝎醇提物可以减少大鼠海马胶质纤维酸性蛋白mRNA的表达[19]。
前期临床研究观察发现由银翘散化裁而来的疏风止痉方可有效控制难治性癫痫的发作[20-22]。本实验研究结果显示:1)疏风止痉方联合卡马西平可有效控制癫痫发作次数,且表明随着疏风止痉方剂量的增加,发作次数显著减少(有统计学意义)。这提示在临床中治疗耐药性癫痫时可在一定范围内增加中药复方的剂量来控制癫痫的发作。2)疏风止痉方联合卡马西平治疗耐药性癫痫大鼠随着中药剂量的增加,脑脊液中卡马西平浓度呈递增趋势(无统计学意义),疏风止痉方中剂量组比中低组平均升高15.38%,疏风止痉方高剂量组比疏风止痉方中剂量组平均升高20%。综上所述,中药复方联合抗痫药物可提高脑内抗痫药物浓度,减少癫痫发作次数。

