18F-FDG PET/CT中不同部位SUVmax对预测初治转移鼻咽癌预后的价值
张雪芳,智生芳,郑巧兰,吴国谦,梁栩维,尹岫茅,张纯
1.东莞市人民医院放疗科,广东东莞 523059;2.东莞市人民医院核医学科,广东东莞 523059;3.中山大学附属第三医院期刊中心,广东广州 510630;4.东莞市人民医院耳鼻喉科,广东东莞 523059 *通讯作者 张雪芳 xuefang00000@163.com
鼻咽癌具有较强的侵袭性和较高的转移率,初诊鼻咽癌中6%~15%发生远处转移[1],骨、肺、肝等是常见的转移部位[2]。初诊转移鼻咽癌的生物学行为异质性较大,文献报道中位生存期为6个月,也有长期生存病例报道[3]。准确评估患者的预后有利于选择最佳治疗方案。脱氧葡萄糖正电子发射断层显像(18F fluorodeoxyglucose positron emission tomography-computed tomography,18F-FDG/PET)在恶性肿瘤预后评估中具有重要价值。本研究拟分析原发灶、颈部淋巴结和转移灶等不同部位的最大标准化摄取值(maximum standardized uptake value,SUVmax)对初诊转移鼻咽癌患者的预后评估价值。
1 资料与方法
1.1 研究对象 回顾性分析2009年8月—2018年1月在东莞市人民医院经鼻咽活检、全身PET/CT及其他检查确诊为远处转移的159例初诊鼻咽癌患者的临床资料,并进行随访。纳入标准:①鼻咽活检病理确诊为鼻咽癌;②无同时合并或既往患有原发于其他部位的恶性肿瘤;③PET/CT检查前未行抗肿瘤治疗;④无伴活动性肺结核或其他感染病灶。
1.2 PET/CT检查 采用西门子Biograph TruePoint 64 PET/CT。显像剂采用18F-FDG(北京原子高科广州分公司),放化纯度>95%。患者检查前禁食6 h以上,血糖控制至正常水平,注射18F-FDG 3.70~5.55 MBq/kg。饮入5%~10%甘露醇500~1000 ml,静卧45~60 min,排尿后再饮300 ml,进行数据采集。显像包括CT扫描和PET发射扫描,全身扫描范围从头部到股骨上段。CT扫描条件:管电压120 kV,并根据扫描部位厚度及密度进行管电流实时动态自动调节。发射扫描每床位2 min。利用CT扫描数据对PET图像进行衰减校正,采用TrueX法重建图像,层厚3 mm,获得横轴面、矢状面及冠状面PET图像、CT图像及PET/CT融合图像。
由2位副主任及以上职称的核医学专业医师对每例 PET/CT图像进行观察,测量数据取平均值,诊断不一致时经讨论确定。利用 CT图像选取病灶放射性浓聚最高的层面勾画感兴趣区(ROI),系统自动测量病灶SUVmax并进行半定量分析(图1)。
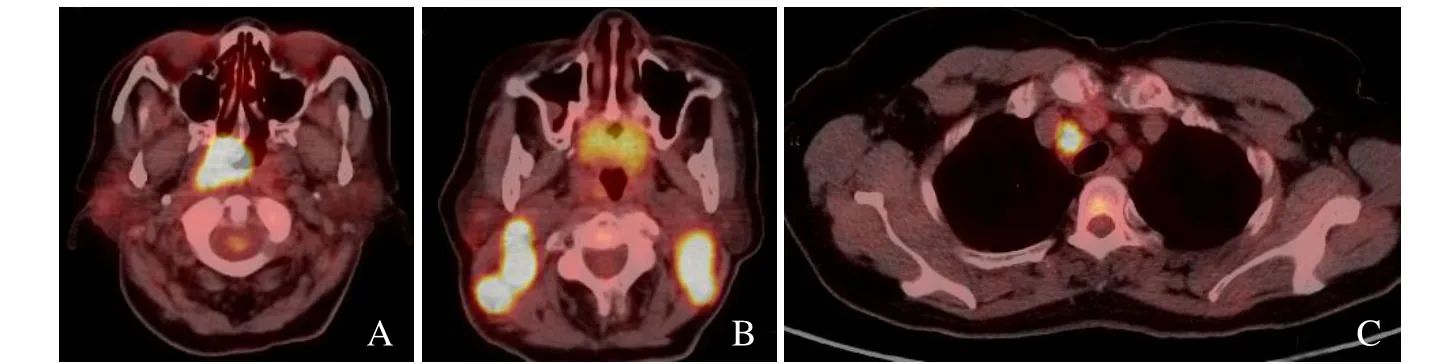
图1 女,68岁,经鼻咽活检、鼻咽颈部MRI、全身PET/CT提示鼻咽未分化非角化性癌,T3N3M1。治疗前全身PET/CT图像示鼻咽部SUVmax 17.8(A)、颈部SUVmax 13.1(B)、纵隔淋巴结SUVmax 13.1(C)
1.3 随访 末次随访时间为2019年3月15日,采用电话及门诊随访。
1.4 统计学方法 计量资料以中位数(四分位间距)[M(P25,P75)]表示,计数资料以例数(%)表示。采用 R3.5.1软件行 Kaplan-Meier单因素分析。将P<0.05的影响因素纳入 Cox回归分析。总生存期(overall survival,OS)定义为获得病理诊断至任何原因死亡时间。P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料 本组患者年龄 44~62岁,中位年龄53岁。性别、TNM分期、转移部位、治疗等见表1。18F-FDG PET/CT鼻咽部最大标准化摄取值(nasopharyngeal maximum standardized uptake value,NP-SUVmax)7.00~15.00,中位数11.75;颈部淋巴结最大标准化摄取值(neck maximum standardized uptake value,NK-SUVmax)7.00~16.00,中位数 11.72;转移灶中最大标准化摄取值(metastasis site maximum standardized uptake value,M-SUVmax)5.00~11.25,中位数5.33。
本组患者随访时间3~84个月,中位时间17.95个月。159例患者中,114例(71.69%)死亡,生存期6~29个月,中位生存期14个月。6个月、1年生存率、2年生存率分别为72.70%、53.00%、27.80%。
2.2 单因素分析结果 不同转移部位(P=0.02)、化疗周期(P<0.001)、放疗剂量(P=0.007)及M-SUVmax(P=0.006)差异均有统计学意义(表1)。
2.3 多因素分析结果 单纯骨转移、化疗>4周期以及低M-SUVmax是影响患者OS的独立危险因素(表2)。
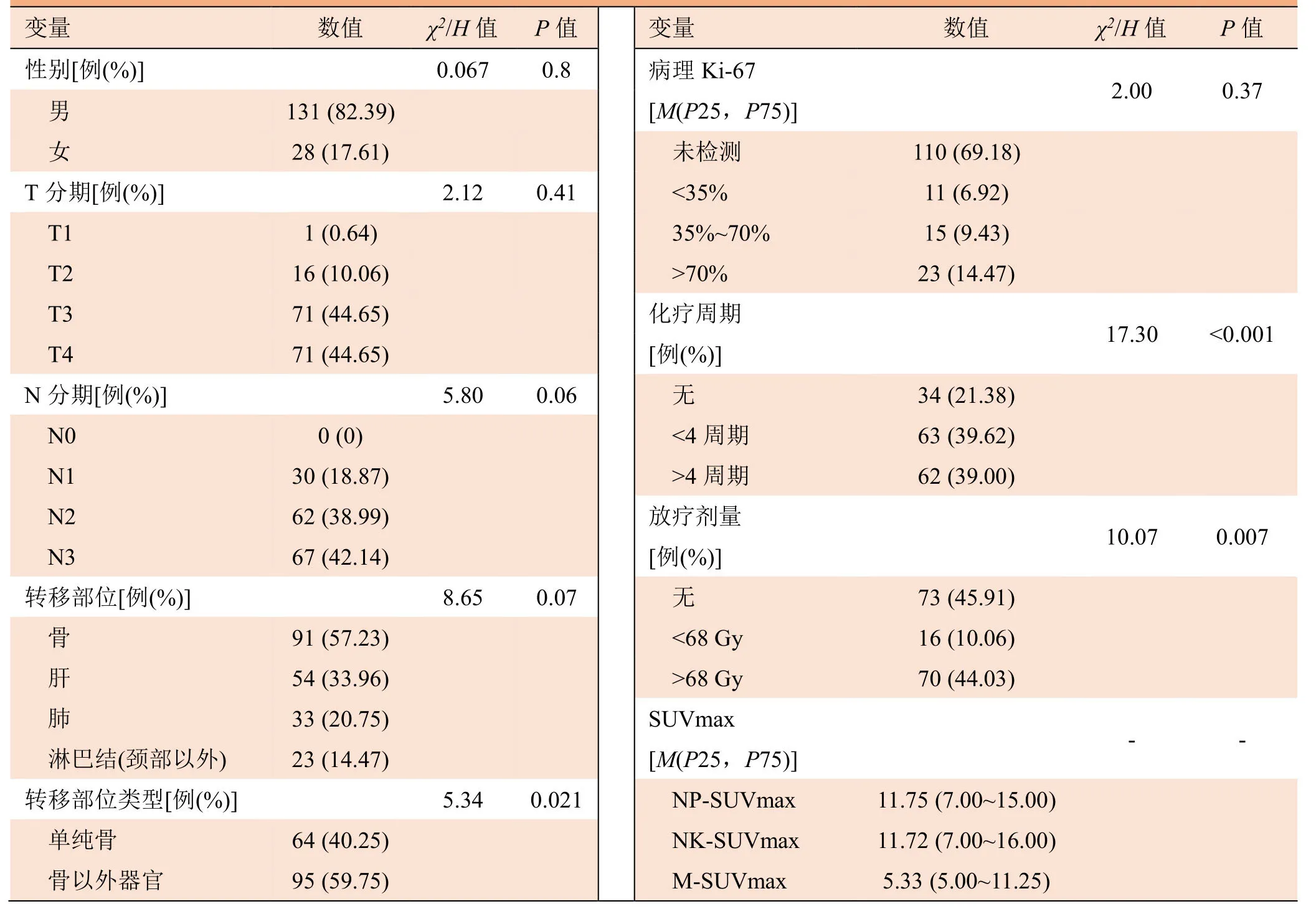
表1 159例初诊远处转移患者的临床资料及治疗方案的单因素分析
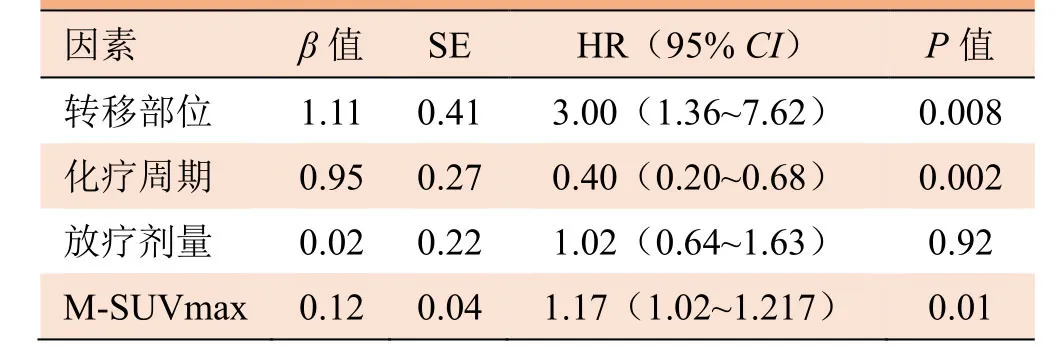
表2 159例初诊远处转移的鼻咽癌患者OS多因素分析
3 讨论
18F-FDG PET/CT不仅显示肿瘤的解剖形态学特征,还可以提供肿瘤的代谢水平,在预测淋巴瘤[4]、转移性肠癌[5]、转移性肾癌[6]等的预后中具有重要价值。该方法在预测头颈部恶性肿瘤预后中同样具有重要意义。郑冬等[7-8]研究发现,SUVmax与舌癌的淋巴结转移、预后等存在一定的关系。Min等[9]研究发现,治疗前头颈部恶性肿瘤的原发灶与转移淋巴结的SUVmax及肿瘤代谢体积(metabolic tumor volume,MTV)病灶总糖酵解可预测 2年无局部复发生存率(locoregional recurrence-free survival,LRFS)、无疾病进展生存率(disease-free survival,DFS)、无远处转移失败生存率。
18F-FDG PET/CT不同部位的代谢参数与无转移鼻咽癌预后的关系尚未明确。Lin等[10]的 Meta分析结果显示,治疗前鼻咽部和颈部淋巴结较高的SUVmax是DFS、OS的高危因素。Huang等[11]的研究则表明鼻咽的SUVmax、MTV和TLG是事件进展生存期和OS的不良预后因素;而颈部的相关参数并非OS的危险因素。Cho等[12]报道鼻咽癌颈部淋巴结的SUVmax是无远处转移生存率(distance metastasis free survival,DMFS)的重要预测因子,而鼻咽的SUVmax并不能预测DMFS。Yang等[13]证实最高SUV是预测非转移患者调强放疗后出现远处转移的独立因素。Xiao等[14]报道原发灶的SUVmax是预测调强放疗联合同步放疗后的鼻咽癌患者远处转移的有力指标,其联合肿瘤分期能准确预测患者治疗后的效果。Hung等[15]研究发现,鼻咽及颈部淋巴结SUVmax均为DMFS的独立影响因素,但对局部控制率和区域控制率并无明显影响。
既往研究报道初诊远处转移鼻咽癌预后差,多给予姑息治疗,但研究中均有长期生存的病例[3]。2018年我国专家制订了关于转移鼻咽癌的诊断治疗规范,但如何判断转移鼻咽癌患者的预后进而进行个体化治疗仍需要深入探索。既往研究回顾性分析远处转移鼻咽癌患者,发现1年、2年及3年OS分别为82.2%、51.3%、34.1%,KPS评分<80分、肝转移、LDH>245 IU/L及疗程<4周期是OS的不良预后因素[16-17]。治疗模式、化疗的反应、化疗周期也与OS相关。Hu等[18]研究发现,血LDH及转移部位的数量是影响预后的危险因素。
18F-FDG PET/CT在转移性鼻咽癌中应用广泛。Tang等[19]研究发现,FDG PET/CT较传统的分期更能发现转移鼻咽癌,尤其是 N2-3及 EBV DNA≥4000 copies/ml局部晚期及有较高转移风险的患者。Xu等[20]的 Meta分析发现,18F-FDG PET/CT诊断初始转移鼻咽癌的敏感性和特异性分别为85.7%、98.1%,而传统的随诊发现初始转移鼻咽癌的敏感性和特异性分别为 38.0%、97.6%。18F-FDG PET/CT在转移鼻咽癌中具有较好的应用前景,其参数与OS的关系鲜有报道。
本研究中 159例初诊转移鼻咽癌患者的中位生存期为17.95个月,2年OS较文献报道稍低[16-17],推测这一差异与研究中 21.38%的患者未进行化疗、45.91%的患者未进行放疗有关。因此,积极的放化疗可明显提高转移患者的OS。本研究多因素分析发现,仅转移灶SUVmax是OS不良的预后因素(Hr=1.13,P=0.005)。既往研究报道无远处转移的鼻咽癌或头颈恶性肿瘤,颈部淋巴结SUVmax与治疗后转移的发生相关,原发部位的肿瘤SUVmax与远处转移率并不相关[21-22]。因此,从代谢活跃程度、形态学、部位、数量等方面对初诊转移鼻咽癌转移灶的深入研究可能为本病的诊断和治疗提供更广阔的视野。
总之,转移部位、化疗周期、转移灶的SUVmax是 OS的独立预后因素。对于单纯骨转移、转移灶SUVmax较低的患者更应给予积极的治疗,尤其多程化疗有利于延长生存期。由于本研究为回顾性分析,治疗方案存在较大的差异,可导致各种偏倚,故有待进一步探索18F-FDG PET/CT预测初诊转移鼻咽癌患者预后的价值。

