靶向荧光二氧化硅纳米粒子检测模型循环肿瘤细胞的实验研究
房慧颖,蒋伟,何晓静,曾晓华
1.重庆大学附属肿瘤医院/重庆市肿瘤研究所乳腺科,重庆 400030;2.重庆医科大学附属第二医院放射科,重庆 400010;*通讯作者 蒋伟 305115593@qq.com
循环肿瘤细胞(circulating tumor cell,CTC)指存在于外周血中的各类肿瘤细胞的统称。CTC是目前公认的肿瘤转移的先导标志,可作为肿瘤分期的重要判定标准[1]和病情是否改善的标志[2]。然而,CTC在肿瘤患者外周血中的数量非常稀少,特别是在早期阶段,该范围可以是 109个血细胞中仅含 1~100个CTC[3],故CTC研究的关键在于能否在复杂环境中高效、迅速、准确地富集和检测CTC[4]。
纳米材料由于其独特的功能以及较少的副作用而广泛用于各种生物医学领域,如生物分析、疾病诊断和治疗等[5-6]。其中荧光染料掺杂的纳米材料比单一染料分子拥有更高荧光的特性及易于靶向修饰的特点,越来越多地运用于 CTC的检测及富集。本研究拟选用乳腺癌MCF-7细胞作为模型CTC,表面的上皮细胞黏附分子(EpCAM)作为靶点;使用由于抗体修饰而具有胶体稳定性的带负电荷的聚乙二醇化的高亮荧光二氧化硅纳米粒子(nanoparticles,NPs)作为生物传感器,用于特异性靶向EpCAM标记物,为实时监测循环肿瘤细胞、评估治疗效果,实现实时个体治疗奠定理论基础[7]。
1 材料与方法
1.1 主要试剂与仪器癌症治疗的发展前景是迫切需要微创生物标志物,以促进早期发现曲拉通(TX-100)、正己醇和环己烷购自美国 Alfa Aesar公司。原硅酸四乙酯(TEOS)、3-氨丙基三甲氧基硅烷(APTES),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)和2-N-吗啉代乙磺酸(MES)购自美国Sigma公司。丙酮、无水乙醇(99.5%)和氨水溶液(25%~28%)购自中国阿拉丁公司。Cy5.5-NHS购自美国 Lumiprobe公司。细胞计数试剂盒-8(CCK-8)、胎牛血清(FBS)、青霉素-链霉素、磷酸盐缓冲液(PBS)及胰蛋白酶购自武汉博士德生物技术有限公司。anti-EpCAM(兔单克隆抗体)抗体、羊抗兔IgG和羊抗兔IgG H&L(FITC)由英国Abcam公司提供。去离子水由美国Millipore公司的Milli-Q系统提供。所有化学试剂均为试剂级,并且未经进一步处理即可使用。
透射电子显微镜(荷兰Philips公司),激光粒径仪(英国Malvern Instruments公司),傅里叶变换红外光谱仪(FTIR,美国Thermo Fisher Scientific公司),紫外/可见光光谱仪及荧光光谱仪(日本Shimadzu公司);激光共聚焦显微镜(CLSM,日本Nikon公司)、流式细胞仪(美国BD Biosciences公司)。
1.2 实验步骤
1.2.1 掺杂 Cy5.5的二氧化硅(Cy5.5@SiO2)的制备采用反相微乳液法合成荧光二氧化硅(Cy5.5@SiO2)[8]。首先将1 mg Cy5.5-NHS溶解于1 ml DMSO中,再加入10 μl APTES,避光摇晃12 h,即得Cy5.5-APTES备用。将1.77 ml TX-100、7.5 ml环己烷、1.8 ml正己醇加入烧杯中,在室温下搅拌20 min,然后将400 μl水、100 μl TEOS 和 150 μl Cy5.5-APTES 溶液加入混合物中,在室温下避光搅拌30 min,加入100 μl氨水溶液(25%~28%),磁力搅拌24 h,加入丙酮进行破乳,将混合物离心并用丙酮及无水乙醇各分别洗涤3次,再加入30 ml无水乙醇(60℃,12 h)中搅拌除去表面活性剂,并且离心样品以获得荧光NPs。将合成的荧光NPs冻干备用。
1.2.2 PEG 修饰的荧光二氧化硅的制备(Cy5.5@SiO2-PEG-COOH) 避光常温下,将上述制备的荧光二氧化硅NPs重悬于30 ml无水乙醇溶液,超声分散30 min,再加入硅烷PEG羧基(Saline-PEGCOOH)30 mg,磁力搅拌12 h,离心并分别用无水乙醇及双蒸水各超声洗涤2次,即得PEG修饰的荧光二氧化硅NPs(Cy5.5@SiO2-PEG-COOH)。
1.2.3 靶向修饰的荧光二氧化硅的制备(Cy5.5@SiO2-PEG-Ab) 避光常温下,将Cy5.5@SiO2-PEG-COOH NPs重悬于2 ml MES缓冲液中(pH 5.0),超声分散30 min后再加入NHS 20 mg、EDC 10 mg,摇晃 1 h,离心后得羧基活化的Cy5.5@SiO2-PEG-COOH NPs;将活化的NPs重悬于2 ml MES溶液(pH 8.0)中,超声分散30 min,加入30 μl抗EpCAM抗体(Ab),4℃摇晃过夜,离心并PBS超声洗涤3次,即得PEG修饰的靶向荧光二氧化硅NPs(Cy5.5@SiO2-PEG-Ab)。
1.3 合成的NPs基本理化性质检测
1.3.1 NPs粒径、分布等检测 采用透射电子显微镜、动态光散射技术(DLS)观察制备的荧光NPs的粒径大小、形态、分布情况。
1.3.2 PEG修饰及Cy5.5掺杂的检测 采用FTIR检测 PEG是否成功连接于荧光二氧化硅表面;采用紫外光谱、荧光光谱技术检测确定Cy5.5是否成功掺杂于二氧化硅及掺杂Cy5.5后荧光NPs的荧光性质。
1.3.3 NPs与anti-EpCAM抗体共价偶联的检测 将20 μl FITC标记的羊抗兔IgG H&L加入2 ml含有10 mg Cy5.5@SiO2-PEG-Ab的PBS溶液中,避光4℃搅拌1 h,将NPs离心并用去离子水洗涤3次以除去未结合的FITC。以相同的方式获得封闭组;除在加入FITC标记的羊抗兔IgG H&L之前加入羊抗兔IgG抗体以阻断Anti-EpCAM单抗。采用CLSM观察二氧化硅纳米表面Anti-EpCAM抗体连接情况。
1.4 Cy5.5@SiO2-PEG-Ab的细胞毒性检测 细胞培养:人乳腺癌细胞系(MCF-7)(由重庆医科大学提供)在37℃、5% CO2下,在含有10% FBS和1%青霉素-链霉素的1640培养基中孵育。对于所有实验,使用胰蛋白酶溶液在细胞指数生长期收集细胞,然后在铺板前将其重悬于新鲜培养基中。
将乳腺癌MCF-7细胞接种于96孔板中(1×105个细胞/孔),常规培养24 h,待细胞贴壁后加入不同浓度的Cy5.5@SiO2-PEG-Ab(PBS作对照)(终浓度:50、100、200、400),孵育24 h后,加入CCK8 10 μl,继续孵育1.5 h,于450 nm波长处测OD值。
1.5 Cy5.5@SiO2-PEG-Ab NPs检测模型循环肿瘤细胞 CLSM检测:将乳腺癌MCF-7细胞在37℃、5%CO2下孵育24 h后,除去上清液,避光下将靶向NPs Cy5.5@SiO2-PEG-Ab及非靶向 NPs Cy5.5@SiO2-PEG-COOH(0.5 ml,5.0 mg/ml)各自加入相应共聚焦培养皿,温育1 h,用PBS洗涤细胞3次,除去多余的荧光NPs;再用4%多聚甲醛溶液固定细胞10 min,用冰PBS洗涤3次,最后用4',6-二脒基-2-苯基吲哚(DAPI)染细胞核3 min。通过CLSM观察细胞靶向情况。
流式细胞术检测:将乳腺癌 MCF-7细胞接种于6孔板中(2×105个细胞/孔),除细胞不进行DAPI染色外,其余操作步骤与上述方法相同。用胰蛋白酶消化细胞,用 PBS洗涤 3次并重悬于 PBS中。通过FACScan流式细胞仪测量每组的平均荧光强度(MFI),以未处理的细胞作为空白对照。
1.6 统计学方法 使用SPSS 22.0软件,计量资料以±s表示,组间比较采用配对样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 荧光二氧化硅纳米颗粒基本理化性质 透射电子显微镜显示合成的 Cy5.5@SiO2和 Cy5.5@SiO2-PEG-Ab NPs呈球形,具有相对均一的尺寸分布(图1A、B);通过DLS测量的Cy5.5@SiO2和Cy5.5@SiO2-PEG-Ab NPs平均粒度分别为(107.01±5.75)nm 和(128.52±4.10)nm(图2A、B),平均zeta电位分别为(-38.37±4.21)mV 和(-27.51±3.81)mV(表1)。
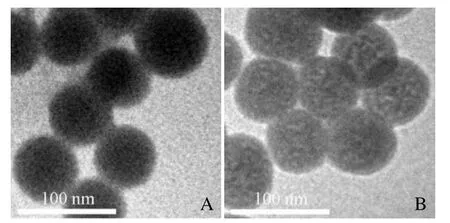
图1 透射电子显微镜显示合成的 Cy5.5@SiO2(A)和Cy5.5@SiO2-PEG-Ab(B)NPs呈球形,具有相对均一的尺寸分布
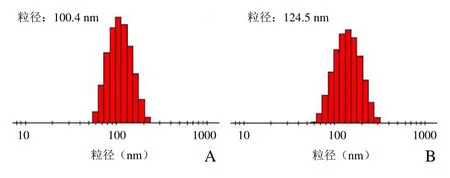
图2 Cy5.5@SiO2(A)及Cy5.5@SiO2-PEG-Ab(B)粒径分布
表1 制备的各种NPs的粒径及电位(±s,n=3)
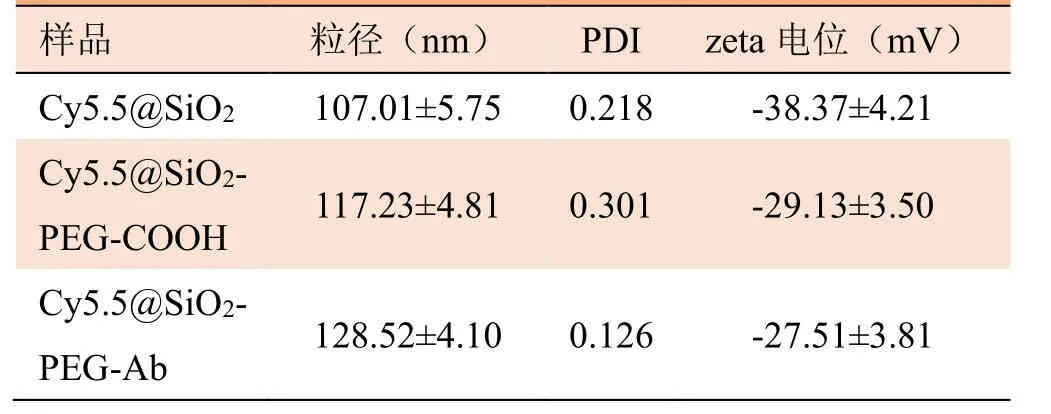
表1 制备的各种NPs的粒径及电位(±s,n=3)
注:NPs为纳米粒子
样品 粒径(nm)PDI zeta电位(mV)Cy5.5@SiO2 107.01±5.75 0.218 -38.37±4.21 Cy5.5@SiO2-PEG-COOH 117.23±4.810.301-29.13±3.50 Cy5.5@SiO2-PEG-Ab 128.52±4.10 0.126 -27.51±3.81
如图3所示,Cy5.5@SiO2及Cy5.5@SiO2-PEGCOOH的FTIR光谱在1100 cm-1处显示出对应于Si-O-Si振动的峰值,798 cm-1和470 cm-1左右为SiO2的特征峰,表明上述两种NPs均为SiO2结构;1710 cm-1处的峰值对应于羧基的C=O伸缩振动峰;2910 cm-1处的峰对应于PEG中的CH烷基拉伸峰[9],表明PEGCOOH基团成功引入Cy5.5@SiO2NPs的表面。
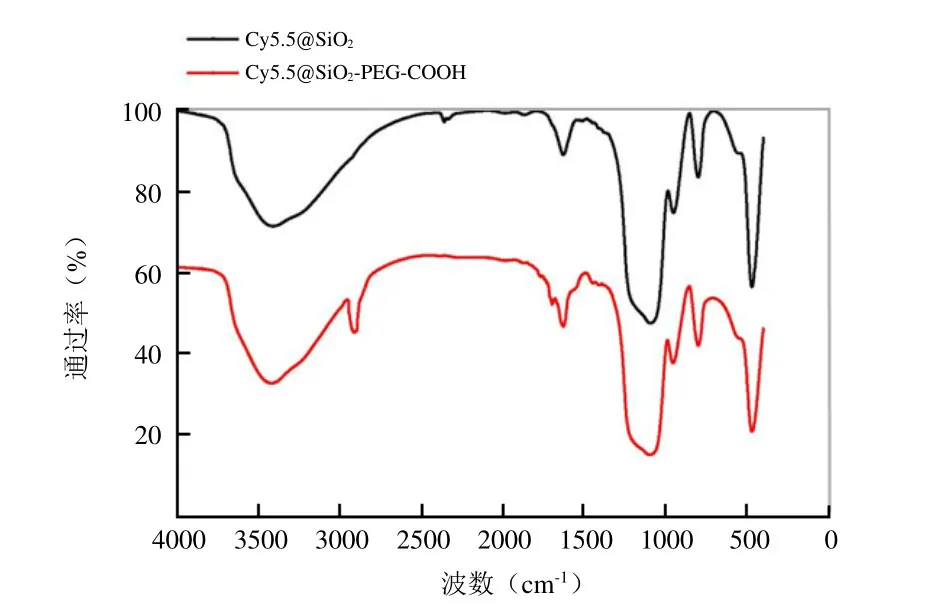
图3 Cy5.5@SiO2及Cy5.5@SiO2-PEG-COOH NPs的FTIR图
纯Cy5.5染料及Cy5.5@SiO2-PEG-Ab的紫外吸收光谱图所示,两条曲线均在677 nm左右处出现吸收峰(图4A);同时其荧光曲线显示其发射峰保持不变(图4B)。
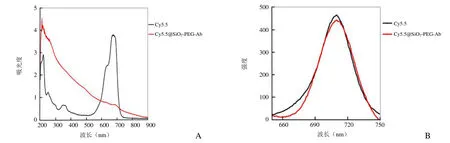
图4 Cy5.5及Cy5.5@SiO2-PEG-Ab紫外/可见光光谱(A)及荧光光谱(B)
通过CLSM证实Cy5.5@SiO2-PEG-COOH NPs与anti-EpCAM的缀合情况。由于FITC标记的山羊抗兔抗体的特异性结合,Cy5.5@SiO2-PEG-Ab NPs显示出强烈的红色及绿色荧光,而封闭组由于Anti-EpCAM抗体被山羊抗兔 IgG抗体阻断而未检测到明显绿色荧光(图5)。
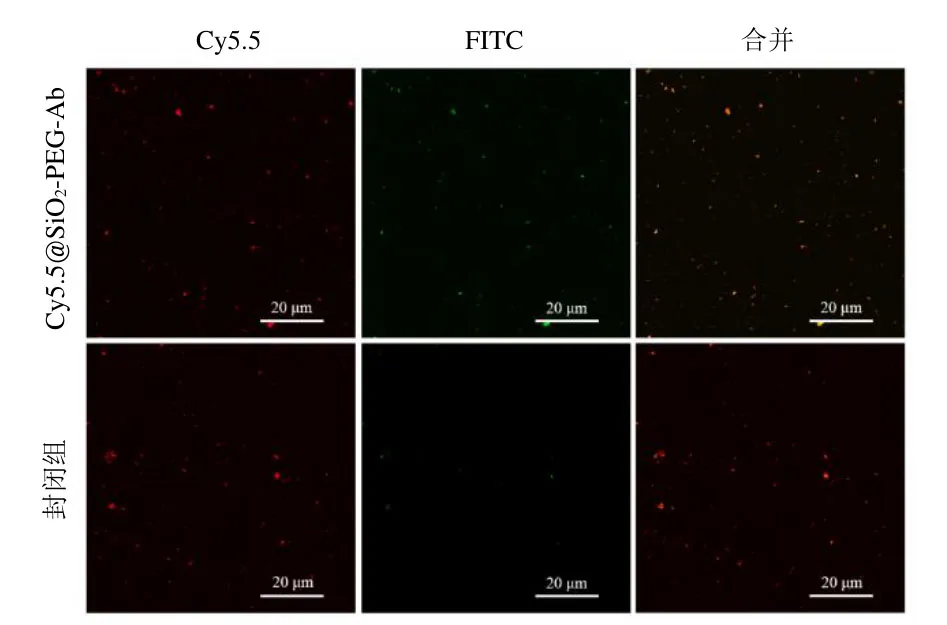
图5 激光共聚焦显微镜观察靶向纳米粒与Anti-EpCAM抗体的连接情况
2.2 细胞毒性实验 乳腺癌MCF-7细胞与不同浓度的各种NPs共孵育24 h后,其存活率均大于90%,表明细胞增殖在测试浓度范围内未受明显影响(图6)。
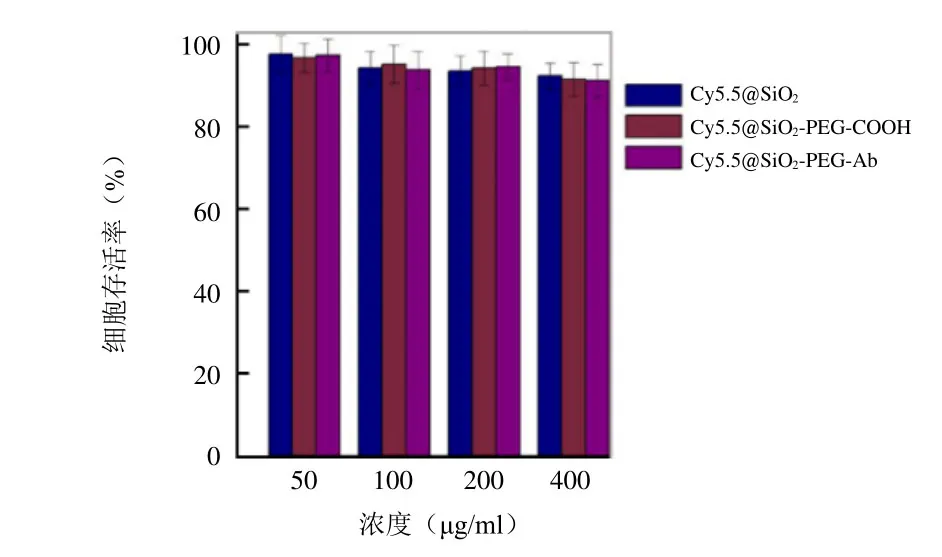
图6 制备的NPs不同浓度下与MCF-7细胞共孵育24 h后的细胞存活率
2.3 模型循环肿瘤细胞检测 CLSM 观察 NPs与MCF-7细胞的成像情况见图7。靶向组及非靶向组MCF-7细胞核均标记为蓝色;Cy5.5@SiO2-PEG-Ab与MCF-7细胞结合观察到高亮的红色荧光信号,而在非靶向组 MCF-7细胞上仅单个细胞膜显示少量红色荧光,这可能是由于静电吸附或缺乏足够的漂洗未完全去除多余的 NPs所致,结果表明 Cy5.5@SiO2-PEGAb与细胞结合是由于受体介导的免疫反应所致。因此,Cy5.5@SiO2-PEG-Ab NPs在细胞靶向中显示出高度特异性。
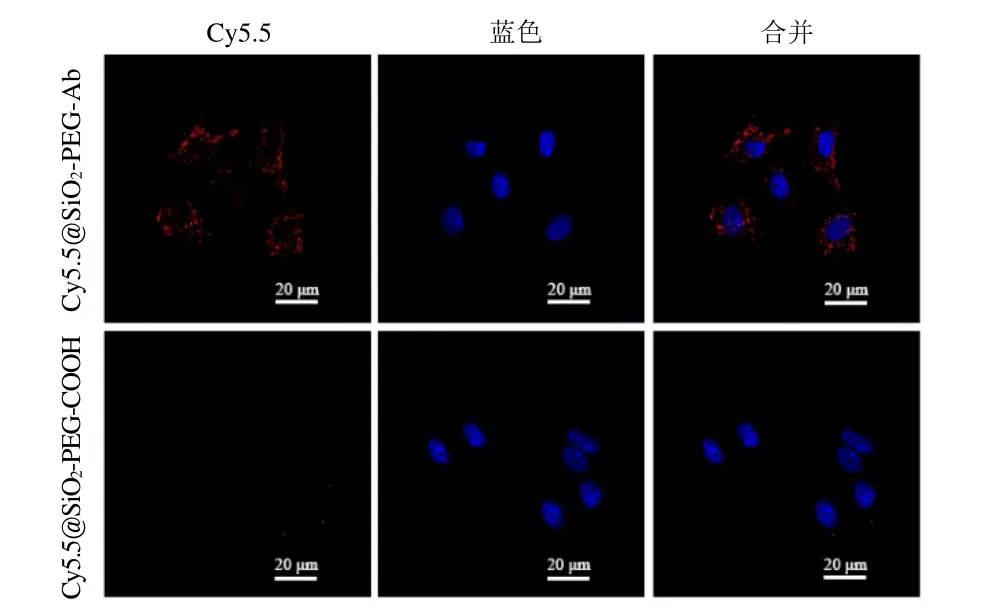
图7 CLSM观察NPs靶向MCF-7细胞的能力。蓝色标记细胞核,红色为Cy5.5@SiO2-PEG-Ab NPs
流式细胞术分析结果显示,Cy5.5@SiO2-PEG-Ab及Cy5.5@SiO2-PEG-COOH与MCF-7细胞结合率分别为99.76%、8.80%(图8),由于Cy5.5@SiO2-PEGCOOH NPs无靶向修饰,其非特异性结合非常低。
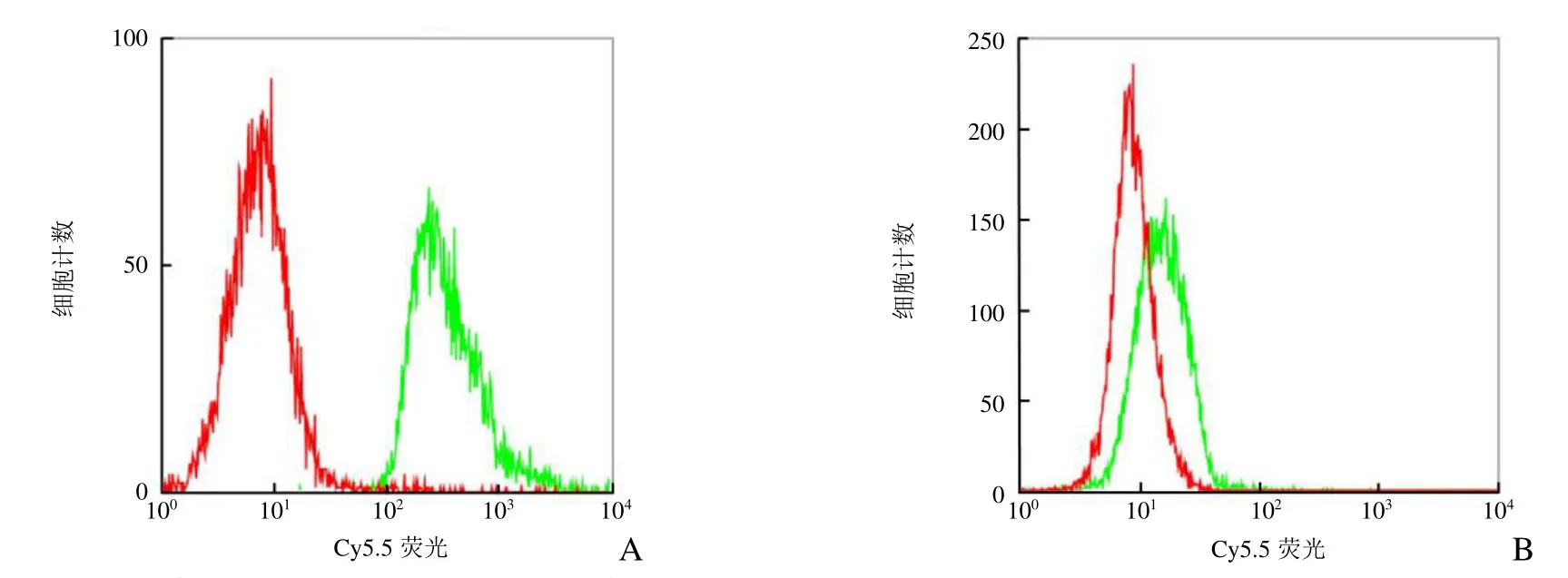
图8 流式细胞术观察NPs靶向MCF-7细胞的能力。A为Cy5.5@SiO2-PEG-Ab NPs与MCF-7细胞结合率,B为Cy5.5@SiO2-PEG-COOH NPs与MCF-7细胞结合率
3 讨论
癌症治疗的发展前景是迫切需要微创生物标志物,以促进早期发现及对治疗是否获益的预测,以实现高度可靠的实时精确治疗[10]。但是在临床工作中连续活检通常是不切实际的,而CTC可以从微创抽血或“液体活组织检查”中连续获得,能及时反映原发肿瘤的转移情况、辅助判断病情的进展[11]。目前CTC检测常见的方法有流式细胞分选、免疫磁性分离、稀有细胞自动检测系统等。而基于NPs检测技术捕获和分离CTC的方法近年备受重视。荧光染料掺杂入生物相容的NPs中不仅可以防止染料发生光漂白,而且与单一有机染料分子相比,荧光NPs具有更亮的荧光能力,可以显著提高检测极限及灵敏度[12-13];并且可与适用于商业染料的实验室仪器的典型光谱响应完美匹配。在常用NPs中,二氧化硅NPs由于它们的可调尺寸、易分离、生物相容性、合适的表面结构以及易修饰与靶向配体结合[14-15]等特点而得到广泛关注,这种特性使其成为检测和富集CTC的理想纳米材料。另外,区分 CTC和血细胞的一种方法是其表面标记物不同。由于实体肿瘤大多起源于上皮细胞,CTC表面高表达EpCAM特异抗原(由314个氨基酸组成的Ⅰ型跨膜糖蛋白),而在血细胞表面不表达,因此是理想的靶点。
本研究采用反相微乳液法成功制备出Cy5.5掺杂的二氧化硅荧光 NPs,进一步对荧光 NPs表面进行PEG及抗EpCAM抗体修饰;NPs表面改性后,所得的NPs形态未发生明显变化,表明将抗EpCAM抗体连接到Cy5.5@SiO2不会改变母体材料的结构。此外,Cy5.5@SiO2-PEG-Ab的马尔文粒径比Cy5.5@SiO2的粒径更大(P=0.006),其可能原因是由于PEG和抗体附着于NPs表面所致[16]。使用NPs进行靶细胞成像的难点之一是要防止NPs和细胞间的高度非特异性相互作用。本研究中制备的NPs带负电荷,这对于防止非特异性结合并允许特异性抗体-抗原相互作用非常重要。为了减少这种非特异性结合,除通过制备带负电荷的NPs,其表面进行PEG修饰也非常重要;由于减少了引起内吞作用的调理素和蛋白质在NPs表面聚集,PEG已被用于增加NPs的体内循环时间[13,17]。紫外/可见光光谱及荧光光谱显示纯Cy5.5@SiO2-PEG-Ab与 Cy5.5的吸收峰及荧光发射峰未见明显变化,提示Cy5.5染料分子成功掺杂到二氧化硅NPs中,并且保留了其原有的荧光性质,这可能主要是由于二氧化硅对光学性质具有透明性,即二氧化硅不会影响原有的光学性能[18]。CLSM 及流式细胞检测结果表明Cy5.5@SiO2-PEG-Ab NPs对模型循环肿瘤细胞MCF-7细胞具有高度特异性,与Tiernan等[19]使用NIR-664掺杂的二氧化硅NPs来靶向结肠直肠癌细胞的结果一致。此外,非靶向组细胞的荧光亮度非常低,这有利于区分阳性和阴性群体,并且几乎不会出现错误识别。这种低度非特异性结合归因于许多因素,特别是zeta电位、NPs的聚乙二醇化等因素[13],这些特性为进一步研究提供了保证。
本研究成功制备了PEG修饰的Cy5.5掺杂的二氧化硅NPs,并用来标记EpCAM表面标记物阳性的模型CTC。CLSM检测及流式细胞术的结果显示,明亮的NPs能特异性地与模型CTC细胞结合。由于荧光纳米材料所具备的靶向性及明亮特性,这使得它们成为检测 CTC细胞群或具有低标记物表达的细胞的理想材料。本研究的不足之处是并未在富含蛋白质的真实血液样本中检测制备的NPs是否仍具有CTC靶向能力,这将在后续研究中进一步探讨。

