缺氧对HCT116肠癌细胞成纤维细胞生长因子21的调节作用
张学松 张谢 宋毓飞 林虹 吴玲剑
[摘要] 目的 觀察缺氧模拟物二氯化钴(CoCl2)对人源HCT116肠癌细胞成纤维细胞生长因子21(FGF21)表达的影响。 方法 分别用0、50、100和200 μmol/L的CoCl2处理HCT116细胞24 h,同时用200 μmol/L的CoCl2处理HCT116细胞12、48 h,RT-PCR 法和Western blot法分别检测细胞中的FGF21 mRNA和蛋白的表达水平;分别用缺氧诱导因子抑制剂2ME2和YC-1,同时加入CoCl2处理HCT116肠癌细胞24 h,RT-PCR法检测细胞中的FGF21 mRNA;用抗氧化剂NAC和CoCl2同时处理HCT116肠癌细胞24 h,RT-PCR法和Western blot法分别检测细胞中的FGF21 mRNA和蛋白的表达量。 结果 随CoCl2浓度增加和作用时间延长,HCT116细胞FGF21 mRNA 相对表达量逐渐降低(P<0.05)。Western blot结果显示,与对照组相比,CoCl2组FGF21 蛋白表达水平显著下降(P<0.05)。缺氧诱导因子抑制剂处理后,HCT116细胞FGF21 mRNA相对表达量依然降低(P<0.05)。抗氧化剂处理后,HCT116细胞FGF21 mRNA 和蛋白相对表达量未出现明显降低(P>0.05)。 结论 CoCl2对HCT116肠癌细胞FGF21 的表达有抑制作用,该作用与缺氧诱导因子无关,而与氧化应激有关。
[关键词] 缺氧;成纤维细胞生长因子21;HCT116肠癌细胞;二氯化钴
[中图分类号] R735.3 [文献标识码] A [文章编号] 1673-9701(2019)25-0014-04
Regulation of hypoxia on fibroblast growth factor 21 in HCT116 intestinal cancer cells
ZHANG Xuesong1 ZHANG Xie2 SONG Yufei1 LIN Hong3 WU Lingjian4
1.Department of Gastroenterology,Ningbo Medical Center Lihuili Hospital,Ningbo 315040,China; 2.Department of Pharmacy,Ningbo Medical Center Lihuili Hospital,Ningbo 315040,China; 3.College of Laboratory Medicine,College of Life Sciences,Wenzhou Medical University,Wenzhou 325000,China; 4.Department of Dermatology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China
[Abstract] Objective To observe the effect of hypoxia mimicking cobalt dichloride(CoCl2) on the expression of fibroblast growth factor 21(FGF21) in human HCT116 intestinal cancer cells. Methods HCT116 cells were treated with 0, 50, 100 and 200 μmol/L CoCl2 for 24 h, and HCT116 cells were treated with 200 μmol/L CoCl2 for 12 and 48 h. RT-PCR and Western blot were used to detect the expression of FGF21 mRNA and protein in the cells. HCT116 intestinal cancer cells were treated with hypoxia-inducible factor inhibitors 2ME2 and YC-1, respectively, added into CoCl2 for 24 h. RT-PCR was used to detect FGF21 mRNA in cells. HCT116 intestinal cancer cells were treated with antioxidants NAC and CoCl2 for 24 h, and the expression of FGF21 mRNA and protein was detected by RT-PCR and Western blot. Results With the increase of CoCl2 concentration and prolonged action time, the relative expression of FGF21 mRNA in HCT116 cells decreased gradually(P<0.05). Western blot results showed that the expression of FGF21 protein in CoCl2 group was significantly lower than that in the control group(P<0.05). After treatment with hypoxia-inducible factor inhibitor, the relative expression of FGF21 mRNA in HCT116 cells was still decreased(P<0.05). After antioxidant treatment, the relative expression of FGF21 mRNA and protein in HCT116 cells did not decrease significantly(P>0.05). Conclusion CoCl2 can inhibit the expression of FGF21 in HCT116 intestinal cancer cells, which is not related to hypoxia-inducible factors but related to oxidative stress.
[Key words] Hypoxia; Fibroblast growth factor 21; HCT116 intestinal cancer cells; Cobalt dichloride
肿瘤细胞生长过程中缺氧及糖脂代谢紊乱是重要的病理生理过程,缺氧诱导因子-1(HIF-1)对肿瘤细胞的能量代谢起重要的调控作用,但目前人们对缺氧导致肿瘤代谢紊乱的分子机制尚不完全清楚[1,2]。成纤维细胞生长因子-21(FGF21)是一种潜在的代谢调节因子,参与机体物质代谢,维持机体内脂糖代谢的平衡[3,4]。FGF21的主要功能体现在降低血糖和改善血脂方面[5],但迄今为止,关于FGF21与肿瘤关系的研究报道甚少。本研究采用化学缺氧剂二氯化钴(CoCl2)进行诱导,观察缺氧对HCT116肠癌细胞FGF21表达的影响,为开发新型抗肿瘤药物提供新靶点和理论基础。
1 材料与方法
1.1 实验材料
人源HCT116肠癌细胞(上海中科院细胞库);CoCl2,2ME2,YC-1,NAC(美国Sigma公司);胎牛血清(FBS),Trizol,Mc Coy's 5A培养基(美国Invitrogen公司),FGF21抗体(美国santa cruz公司,货号:sc-81946)、GAPDH抗体(美国santa cruz公司,货号:sc-47724)、兔抗鼠二抗(美国santa cruz公司,货号:sc-2039)。
1.2 主要仪器
显微镜(ECLPSE 80i型,日本Nikon公司);高速冷冻离心机(micro21R型,美国Thermo Fisher公司);超纯水(Direct-Q3 型,美国Millipore公司);PCR仪(T100型,美国Bio-Rad公司);凝胶成像仪器(ChemiDocTM XRS+,美国Bio-Rad公司)。
1.3 细胞培养
HCT116 肠癌细胞用含10% FBS的 Mc Coy's 5A的培养基培养,在37℃,5% CO2培养箱中培养至对数生长期。每48~72小时更换1次新鲜培养液,72~96 h传代1次。
1.4 CoCl2对HCT116细胞的处理
3×105细胞/3 mL接种于100 mm 培养皿中,培养12 h,待细胞贴壁后,0.1%血清培养基饥饿12 h后,分别用0、50、100和200 μmol/L 的CoCl2处理HCT116 细胞24 h后收取蛋白和RNA;用200 μmol/L 的CoCl2分别处理HCT116 细胞0、12和24 h,提取细胞总蛋白和RNA用于后续实验。
1.5 缺氧诱导因子抑制剂对HCT116细胞的处理
将HCT116细胞分为4 组,2ME2+CoCl2、YC-1+ CoCl2组分别以缺氧诱导因子抑制剂2ME2(100 μmol/L)或YC-1(50 μmol /L)与CoCl2(200 μmol/L)同时处理HCT116细胞24 h,对照组不处理,CoCl2组直接加200 μmol/L的CoCl2处理24 h后提取细胞总蛋白和RNA用于后续实验。
1.6 抗氧化剂对HCT116细胞的处理
将HCT116细胞分为3 组,NAC+CoCl2组以ROS抑制剂NAC(3 μmol/L)与CoCl2(200 μmol/L)同时处理HCT116细胞24 h,对照组不处理,CoCl2组直接加200 μmol/L 的CoCl2处理24 h后提取细胞总蛋白和RNA,用于后续实验。
1.7 RT-PCR 法检测FGF21 mRNA的表达
Trizol 法提取细胞中的RNA,取1 μg 的RNA 进行逆转成cDNA 后进行扩增,以β-actin 为内参照基因,上游引物为5′-GAGACCTTCAACACCCC-3′,下游引物为5′- ATAGCTCTTCTCCAGGGAGG -3′。mFGF21上游引物为5′-ACCTGGAGATCAGGGAGGAT-3′,下游引物为5′-GCACAGGAACCTGGATGTCT-3′。
1.8 Western bolt法检测FGF21蛋白的表达
按蛋白裂解液说明书抽提蛋白,BCA法测定总蛋白浓度,蛋白变性后行SDS-PAGE电泳,湿转法到PVDF膜上,加入3% BSA封闭液,室温下孵育2 h,加入FGF21一抗(1:500),4℃封闭过夜,弃一抗,Tris-HCl缓冲盐溶液+吐温(TBST)洗3遍。加入1:5000的二抗,室温孵育2 h后,弃二抗,TBST洗3遍,增强化学荧光发光法显影,曝光。
1.9 统计学方法
应用GraphPad 5.0统计软件。计量资料用(x±s)表示,组间比较采用两独立样本t检验,多组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
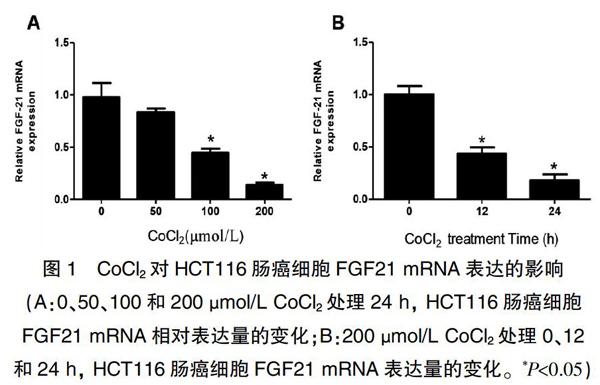
2.1 缺氧对HCT116肠癌细胞FGF21 mRNA表达的影响
0、50、100和200 μmol/L CoCl2作用于HCT116细胞24 h 后,FGF21 mRNA表达量分别为(0.99±0.24)μmol/L,(0.83±0.06)μmol/L,(0.45±0.07)μmol/L,(0.14±0.04)μmol/L,呈浓度梯度式下降,当CoCl2浓度增加到100 μmol/L以后,差异有统计学意义(P<0.05),見图1A;200 μmol/L CoCl2作用于HCT116细胞0、12和24 h后,FGF21 mRNA相对表达量为(1.01±0.07)μmol/L,(0.44±0.16)μmol/L,(0.09±0.02)μmol/L,呈时间梯度式下降(P<0.05),见图1B。故后续细胞采用200 μmol/L的CoCl2和24 h作为缺氧处理条件。
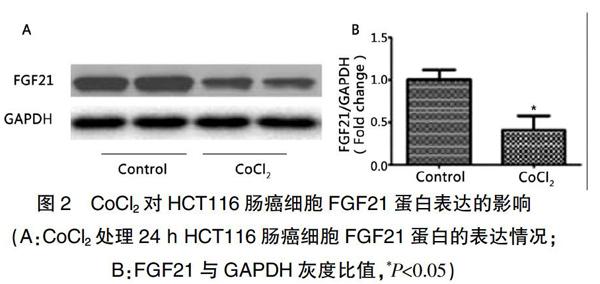
2.2 缺氧对HCT116肠癌细胞FGF21蛋白表达的影响
Western blot结果显示,与对照组(灰度值为1.04±0.17)相比,CoCl2处理组FGF-21 蛋白表达水平显著下降(灰度值为0.54±0.15,P<0.05),表明化学缺氧可以显著降低HCT116肠癌细胞内FGF-21蛋白含量。
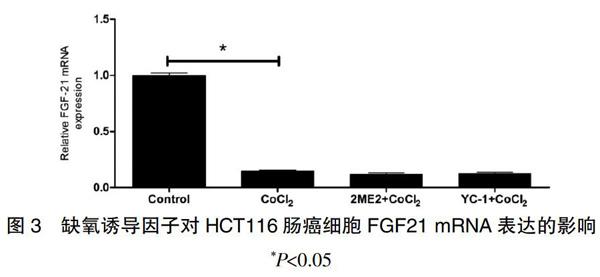
2.3 缺氧诱导因子对HCT116肠癌细胞FGF21 mRNA表达的影响
用两种不同的缺氧诱导因子抑制剂2ME2和YC-1处理HCT116肠癌细胞,同时加入CoCl2处理 24 h。对照组、CoCl2组、2ME2+CoCl2组、YC-1CoCl2组FGF-21 mRNA相对表达量分别为(1.00±0.05)μmol/L,(0.14±0.01)μmol/L,(0.12±0.03)μmol/L,(0.12±0.03)μmol/L。但是这两种抑制剂并没有缓解CoCl2对FGF-21 mRNA表达的抑制作用,差异无统计学意义(P>0.05)(图3)。说明CoCl2对HCT116肠癌细胞中FGF-21表达的抑制作用并不依赖于缺氧诱导因子。
图3 缺氧诱导因子对HCT116肠癌细胞FGF21 mRNA表达的影响 *P<0.05
2.4 氧化应激对HCT116肠癌细胞FGF21表达的影响
为了研究CoCl2对HCT116肠癌细胞FGF-21的调节作用是否与氧化应激有关,抗氧化剂NAC与CoCl2同时处理HCT116肠癌细胞24 h。对照组、CoCl2组、NAC+CoCl2组mRNA相对表达量分别为(1.01±0.14)μmol/L,(0.45±0.09)μmol/L,(0.72±0.07)μmol/L。对照组、CoCl2组、NAC+CoCl2组灰度值分别为(1.00±0.02),(0.41±0.03),(0.58±0.04)。如图4A、B所示,CoCl2对HCT116细胞FGF-21mRNA和蛋白表达的下调作用被NAC抑制,说明CoCl2对HCT116细胞FGF-21的调节作用依赖于氧化应激。
图4 NAC对HCT116肠癌细胞FGF21表达的影响
(A:NAC与CoCl2同时处理24 h HCT116肠癌细胞FGF21 mRNA的表达情况;B:NAC与CoCl2同时处理24 h HCT116肠癌细胞FGF21蛋白的表达情况;C:FGF21与GAPDH灰度比值,*P<0.05)
3 讨论
肿瘤最主要的特征是肿瘤细胞的生长失控,不断增多的细胞导致耗氧量增加,从而形成肿瘤内缺氧微环境,这在机体实体瘤中的表现尤其明显[6,7]。缺氧可通过多种机制促进肿瘤的发生发展,包括诱发酸性内环境、触发肿瘤微血管形成、诱导上皮间质转化、重塑细胞外基质、促进肿瘤免疫逃避和肿瘤适应、维持肿瘤干细胞的存在及抑制衰老[8-10]。HIF-1是在缺氧条件下存在于哺乳动物和人体内的一种转录因子,它最先在缺氧诱导的细胞核抽提物中发现[11]。作为转录因子,HIF-1可调控多种与肿瘤相关的基因,这些基因表达的蛋白有利于肿瘤在缺氧条件下的能量代谢和氧气输送[11-13]。目前研究显示肿瘤细胞生长过程中缺氧及糖脂代谢紊乱是重要的病理生理过程,但人们对缺氧导致肿瘤代谢紊乱的分子机制尚不完全清楚。
FGF21是FGFs的一个新成员,与以前发现的FGFs不同,它与糖脂代谢有着密切的关系,具有内分泌调节功能[14,15]。在肥胖啮齿类动物中,FGF21能够减轻其体重,增加胰岛素敏感性以及调节脂蛋白水平[15]。本文前期研究发现CoCl2诱发急性化学缺氧可加重非酒精脂肪肝小鼠的肝脏损伤,并上调FGF21的表达[16],但FGF21与肿瘤相关性研究甚少。本研究还发现脂肪肉瘤组织中FGF21蛋白较瘤旁组织中表达率明显降低,随访结果显示,FGF21蛋白高表达组患者较低表达组预后更好,不易发生复发[17]。在肝脏组织中,肝细胞特异性FGF21的过表达可以延缓化学物质诱导的肝癌形成,而不影响正常肝脏发育及损伤后的代偿性反应[17]。过表达的FGF21可能是通过激活肝细胞上的FGF受体(FGFR4)来延缓二乙基亚硝胺诱导肝癌的进程[19]。在肿瘤细胞中,缺氧对FGF21的调控似乎与细胞类型有关。在鼠黑色素瘤细胞中,缺氧可以诱导FGF21的表达;但在肠道的肿瘤细胞中,缺氧却可以抑制FGF21的主要轉录因子PPAR-α的表达[20]。化学缺氧对Caco-2细胞中FGF21的影响不依赖于HIF-α,而是依赖于氧化应激介导的机制[21]。这些研究均表明,缺氧导致肿瘤细胞的代谢紊乱可能与FGF21有关。本研究也发现缺氧降低HCT116肠癌细胞FGF21 mRNA和蛋白的表达量,且FGF21的调控作用与缺氧诱导因子无关,依赖于氧化应激反应。接下来将进一步研究FGF21对肿瘤细胞代谢的调控作用,阐明FGF21的生物学功能,为肿瘤防治和新药开发提供新的靶点和理论基础。
[参考文献]
[1] Ban HS,Kim BK,Lee H,et al. The novel hypoxia-inducible factor-1α inhibitor IDF-11774 regulates cancer metabolism,thereby suppressing tumor growth[J]. Cell Death Dis,2017,8(6):e2843.
[2] Hu L,Cui R,Liu H,et al. Emodin and rhein decrease levels of hypoxia-inducible factor-1α in human pancreatic cancer cells and attenuate cancer cachexia in athymic mice carrying these cells[J]. Oncotarget,2017,8(50):88008-88020.
[3] BonDurant LD,Potthoff MJ. Fibroblast growth factor 21: A versatile regulator of metabolic homeostasis[J]. Annu Rev Nutr,2018,38:173-196.
[4] Xie T,Leung PS. Fibroblast growth factor 21: A regulator of metabolic disease and health span[J]. Am J Physiol Endocrinol Metab,2017,313(3):E292-E302.
[5] Huang Z,Xu A,Cheung BMY. The potential role of fibroblast growth factor 21 in lipid metabolism and hypertension[J]. Curr Hypertens Rep,2017,19(4):28.
[6] Petrova V,Annicchiarico-Petruzzelli M,Melino G,et al. The hypoxic tumour microenvironment[J]. Oncogenesis,2018,7(1):10.
[7] Parks SK,Cormerais Y,Pouysségur J. Hypoxia and cellular metabolism in tumour pathophysiology[J]. J Physiol,2017,595(8):2439-2450.
[8] Fulda S,Debatin KM. HIF-1-regulated glucose metabolism: A key to apoptosis resistance?[J]. Cell Cycle,2007,6(7):790-792.
[9] Berchner-Pfannschmidt U,Frede S,Wotzlaw C,et al. Imaging of the hypoxia-inducible factor pathway:Insights into oxygen sensing[J]. Eur Respir J,2008,32(1):210-217.
[10] Zhou D,Shao L,Spitz DR. Reactive oxygen species in normal and tumor stem cells[J]. Adv Cancer Res,2014, 122:1-67.
[11] Pezzuto A,Carico E. Role of HIF-1 in cancer progression: Novel insights. A review[J]. Curr Mol Med,2018,18(6):343-351.
[12] Soni S,Padwad YS. HIF-1 in cancer therapy:Two decade long story of a transcription factor[J]. Acta Oncol,2017,56(4):503-515.
[13] López-Lázaro M. Role of oxygen in cancer:Looking beyond hypoxia[J]. Anticancer Agents Med Chem,2009,9(5):517-525.
[14] Kliewer SA,Mangelsdorf DJ. A dozen years of discovery: Insights into the physiology and pharmacology of FGF21[J].Cell Metab,2019,29(2):246-253.
[15] BonDurant LD,Potthoff MJ. Fibroblast growth factor 21: A versatile regulator of metabolic homeostasis[J]. Annu Rev Nutr,2018,38:173-196.
[16] 張学松,张谢,叶桦,等.CoCl2诱发急性化学缺氧对非酒精性脂肪肝小鼠的影响[J]. 浙江医学,2018,40(4):325-328.
[17] Lou Y,Ma Y,Li H,et al. High expression of fibroblast growth factor-21 in liposarcoma patients indicated better prognosis and less recurrence[J]. Biochem Biophys Res Commun,2018,503(2):1130-1133.
[18] Liu HX,Hu Y,French SW,et al. Forced expression of fibroblast growth factor 21 reverses the sustained impairment of liver regeneration in hPPARα(PAC) mice due to dysregulated bile acid synthesis[J]. Oncotarget,2015,6(12):9686-9700.
[19] Huang X,Yu C,Jin C,et al. Forced expression of hepatocyte-specific fibroblast growth factor 21 delays initiation of chemically induced hepatocarcinogenesis[J]. Mol Carcinog,2006,45(12):934-942.
[20] Izumiya Y,Bina HA,Ouchi N,et al. FGF21 is an Akt-regulated myokine[J]. FEBS Lett,2008,582(27):3805-3810
[21] Liu Y,Wang C,Wang Y,et al. Cobalt chloride decreases fibroblast growth factor-21 expression dependent on oxidative stress but not hypoxia-inducible factor in Caco-2 cells[J]. Toxicol Appl Pharmacol,2012,264(2):212-221.
(收稿日期:2019-03-04)

