Ba2+在KDP(100)表面吸附的密度泛函理论研究
刘 峣,武玉琳,屈云鹏,郭文英,梁丽萍
(1 山东大学 材料液固结构演变与加工教育部重点实验室,济南 250061;2 临沂市科学技术合作与应用研究院,山东 临沂 276000)
磷酸二氢钾(KH2PO4,KDP)晶体是一种综合性能优异的非线性光学材料,其非线性光学系数d36多年来一直被作为晶体非线性性质的参比标准。由于KDP晶体具有透过波段宽(近紫外~近红外)、电光系数和非线性光学系数大、损伤阈值高(大于15J/cm2,1ns)、晶体生长尺寸大(直径500~600mm)等特点[1-4],在激光变频、电光调制以及光快速开关等领域一直有着不可替代的地位,是大功率激光系统的首选材料[5]。
为了提高KDP晶体的生长质量和光学性能,人们对KDP晶体做了广泛而深入的研究。然而,在KDP晶体生长过程中,试剂原料和母液不可避免地会混入各种杂质,严重影响着晶体的生长习性和光学稳定性。KDP晶体中的杂质主要包括3种:无机杂质、有机物以及金属离子等[6-8]。其中,具有较强氢键结合能力的无机杂质,如磷酸盐等,容易吸附在晶体的(101)面上,阻碍晶体的生长[9]。细菌、微生物以及各种有机添加剂等,对晶体的激光损伤阈值也有着较大的影响[10]。金属离子是KDP晶体中最常见的杂质,即使是非常微量的金属杂质,也会对KDP晶体的生长过程和光学性质产生明显的影响。研究表明,金属离子容易吸附在KDP晶体的(100)表面,抑制柱面的生长,使晶体变得细长[11-13]。另外,金属颗粒的存在会增加KDP晶体中的光散射,使激光在紫外波段透过率降低,最终造成晶体的激光损伤阈值明显降低[14]。
Ba2+是KDP原材料中常见的一种杂质离子。实验发现,Ba2+同其他金属离子类似,易吸附在KDP晶体的(100)表面上,对晶体的生长有着明显的抑制作用[15]。随着生长溶液中Ba2+含量的增加,KDP晶体对紫外波段的光吸收会明显增加,同时,当Ba2+的质量分数达到一定程度时,晶体会产生开裂的现象[16]。由此可见,Ba2+对KDP晶体的影响不容忽视。虽然已经对此进行了一定的研究,但Ba2+在KDP表面的吸附机理尚不明确。本工作通过密度泛函理论(DFT)研究了Ba2+在KDP晶体(100)表面的吸附行为,对表面结构、吸附能量、电子转移情况等进行了详细分析,探讨了Ba2+与KDP晶体表面之间相互作用的本质。
1 计算方法
KDP晶体属于四方晶系,其理想外形由4个柱面和8个锥面,即4个(100)面和8个(101)面构成[17]。金属离子易吸附在KDP晶体的柱面上,因此选取(100)表面作为吸附基底。表面模型由包含96个原子的3层1×1(x,y方向)的面层组成,z方向与所切的表面相垂直。为了避免相邻表面之间的相互影响,在各表面之间设置3nm厚度的真空层。在结构优化过程中,Ba2+和KDP晶体(100)基底的所有原子充分地弛豫,以探索最稳定的吸附构型。
研究方法为基于密度泛函理论(density functional theory, DFT)[18]的第一性原理计算方法,所有的计算均运用Material Studio 8.0中的CASTEP(cambridge sequential total energy package, CASTEP)程序完成。采用广义梯度近似GGA(generalized gradient approximation,GGA)下的PBE(perdew-burke-ernzerhof,PBE)[19]泛函来描述交换关联作用,使用超软赝势(ultrasoft pseudopotential, USPP)[20]描述离子实与价电子的相互作用,设置H(1s1),O(2s2, 2p4),P(3s2, 3p3),K(3s2, 3p6, 4s1),Ba(5s2, 5p6, 6s2)为价态电子。通过总能量收敛性测试,几何优化及电子结构计算的平面波截止能设置为420eV。布里渊区的k点取样设置为2×2×l。模型的结构优化采用BFGS(broyden-fletcher-goldfarb-shanno, BFGS)算法,优化参数设置如下:原子间相互作用力的收敛标准为0.5eV/nm;能量收敛标准设置为2×10-5eV/atom;晶体内部应力的收敛标准为0.1GPa;原子最大位移收敛标准为0.0002nm。
2 结果与分析
2.1 吸附能与吸附构型
图1为Ba2+在KDP晶体(100)表面的初始吸附位置,图1中白色圆球为H原子,红色为O原子,淡紫色为P原子,深紫色为K原子。为便于观察所选择的吸附位置,图1仅显示了KDP(100)表面最顶层的磷酸根基团及钾原子,其余原子未全部显示,图中尺寸较大的原子代表靠近表面的原子,较小的原子代表离表面较远的原子。由于金属离子易与KDP晶体(100)表面裸露的磷酸根基团产生相互作用[21],因此本研究主要选取表面H,O原子周围的位点作为初始吸附位置,包括:H-O桥位(B, D, J),O-O桥位(F, L),O顶位(A, E, G),H顶位(C),具体位置如图1所示。通过对Ba2+在不同位置的吸附过程进行模拟,得到了不同的吸附构型与吸附能。计算吸附能所用的公式如下:
Eads=EBa/KDP(100)-EKDP(100)-EBa
(1)
式中:Eads为Ba2+在KDP(100)表面的吸附能;EBa/KDP(100)为Ba2+在KDP(100)表面吸附后整个体系的能量;EKDP(100)和EBa分别为清洁(100)表面和单个Ba2+的能量。利用吸附能作为Ba2+在KDP晶体(100)表面吸附能力强弱的判据,能量越低,意味着吸附体系越稳定。

图1 Ba2+在KDP(100)表面的初始吸附位置Fig.1 Initial adsorption positions of Ba2+ on the KDP (100) surface
表1为Ba2+在KDP晶体(100)表面不同位置的吸附能及对应的吸附构型。由表1中数据可见,吸附能处于-0.80~-1.14eV的范围内,数值均为负值,意味着Ba2+在KDP(100)表面的吸附为自发进行的放热反应。在结构优化的过程中,Ba2+的位置发生了不同程度的移动,最终形成了3种较为稳定的吸附构型,分别用Ⅰ,Ⅱ,Ⅲ表示。图2为3种吸附构型的俯视图,图2中灰色圆球代表Ba2+。从表1及图2(a)可以看出,对于吸附构型Ⅰ,初始位置分别为A, B, C,Ba2+在结构优化时逐渐移动到了O原子的上方。其中B位置的吸附相对更稳定,对应的吸附能大小为-0.83eV。对于吸附构型Ⅱ,初始位置为D, E, F, G, J的Ba2+,在吸附过程中逐渐移动到了O—O桥位附近(见图2(b))。其中,当Ba2+的初始位置为E和F时,吸附能均为-1.14eV,吸附能最低,意味着E和F位置的吸附是所有吸附中最稳定的。在吸附构型Ⅲ中,L位置的吸附能为-1.07 eV,吸附前后Ba2+的位置未发生明显的变化,稳定在两个O原子之间(见图2(c))。需要注意的是,吸附构型Ⅱ和构型Ⅲ中Ba2+最终位置均为O—O桥位,但不同之处在于构型Ⅱ中两个O原子来自同一个磷酸根基团,而Ⅲ中的O原子则由两个不同的磷酸根贡献,前者的吸附构型相对更稳定。

表1 Ba2+在KDP(100)表面不同位置的吸附能及对应的吸附构型Table 1 Adsorption energies and configurations of Ba2+ on the different sites of KDP (100) surface
在之前的工作中[21],发现金属离子与KDP晶体(100)表面的氧原子及最外层的氢原子H1(具体原子编号见图2(b))有一定的相互作用,因此在本工作中计算了Ba2+与表面H,O原子的距离。由图2中给出的距离(单位为nm)大小可知,在3种吸附构型中,Ba2+与其周围O原子的间距在0.254~0.274nm之间,与H1原子的距离在0.323~0.353nm之间。可以看出,虽然吸附位置不同,但3种构型中相应的原子间距较为接近,意味着此距离为Ba2+与KDP(100)表面相互作用的稳定距离。同时,为了确定Ba2+吸附对表面结构的影响,对比了吸附前后KDP晶体(100)表面化学键的长度变化。表2为Ba2+吸附前后KDP(100)表面的键长参数,由表中数据可见,与吸附之前相比,表面的P—O键、H—O键以及K—O键的长度都有不同程度的变化,大部分的化学键被拉长,同时也有部分化学键的长度有轻微的缩短现象。值得注意的是,在最稳定的吸附构型Ⅱ中,表面氢原子H2与氧原子O3之间的距离由吸附前的0.108nm变为0.144nm,变化非常明显。与其对应的氢键的形式和结构也发生了变化,由O1…H2-O3变为了O1-H2…O3(见图2(b))。在吸附构型Ⅲ中,靠近表面内部的一个氢键结构也发生了明显的变化,H—O以及H…O>键的长度由0.107,0.139nm分别变为0.116,0.126nm。化学键的变化意味着Ba2+吸附对表面结构产生了一定的影响,从而进一步影响着KDP晶体的生长过程。

表2 Ba2+吸附前后KDP(100)表面的键长参数Table 2 Bond length parameters of the KDP (100) surface before and after Ba2+ adsorption
2.2 吸附机理分析
为了探究Ba2+与KDP晶体(100)表面相互作用的本质,计算了差分电子密度。差分电子密度Δρ的计算公式如下:
Δρ=ρBa/KDP(100)-ρBa-ρKDP(100)
(2)
式中:ρBa/KDP(100),ρBa,ρKDP(100)分别代表吸附体系、孤立Ba2+和清洁KDP(100)表面的电子密度。图3为最稳定的吸附构型Ⅱ中Ba2+与KDP晶体(100)表面的差分电子密度,黄色和蓝色分别代表电子密度的增加和减少,等值面设置为±20e/nm3。可以看出,Ba2+在KDP(100)表面吸附之后,电子密度发生了明显的变化。在靠近O2和O3原子顶部的位置,以及Ba2+和H1原子之间的位置,电子密度明显增加。不同的是,Ba2+与O2,O3原子之间的电子密度变化主要集中在单个原子周围,表明它们之间可能存在少量电子的转移,Ba2+和O原子之间存在着离子键的作用。Ba2+和H1原子之间的位置出现了电子密度的增加,意味着它们之间可能存在一定的共价相互作用。
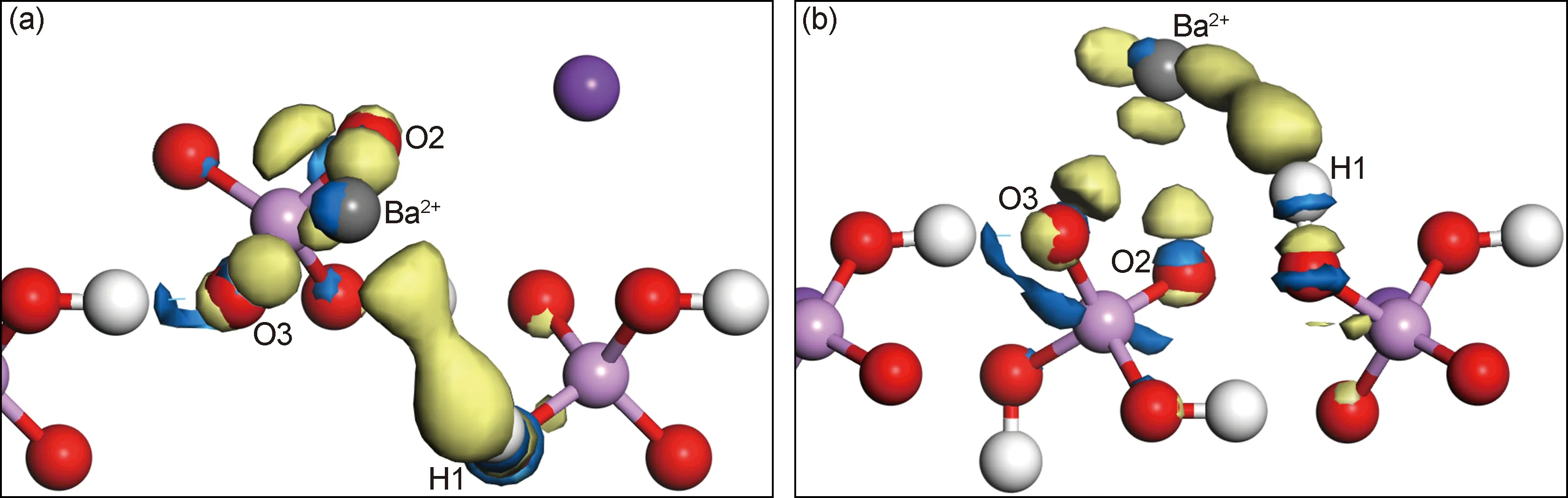
图3 Ba2+在KDP(100)表面最稳定吸附构型的差分电子密度 (a)沿z轴方向的俯视图;(b)侧视图Fig.3 Difference electron density for the most stable adsorption configuration of Ba2+ on the KDP (100) surface (a)top view along the z-direction;(b)side view
吸附前后电子密度的变化必然伴随着电荷转移,通过对Hirshfeld电荷转移情况进行分析,发现吸附之后Ba2+失去了0.19个电子,而O2,O3,H1分别得到了0.03,0.03,0.09个电子。也就是说,在吸附过程中Ba2+向KDP(100)表面转移了部分电子,而这些电子主要提供给了O2,O3,H1等原子。需要注意的是,H1原子从Ba2+处得到电子,同时图3中电子密度增加的区域偏向于H1原子,这意味着Ba2+和H1原子之间的共价相互作用具有一定的极性特征。
为了进一步确定Ba2+与KDP晶体(100)表面的相互作用机理,对化学键重叠布居数[22]进行了计算,吸附构型Ⅱ中Ba-O2和Ba-O3的重叠布居数均为负值(-0.38,-0.46),意味着离子键的形成。Ba-H1的重叠布居数为正值(0.14),代表它们之间存在较弱的共价作用。化学键重叠布居的计算结果与差分电子密度及Hirshfeld电荷转移的分析吻合一致。另外,对于吸附构型Ⅰ和吸附构型Ⅲ,它们与构型Ⅱ具有相似的Ba—O,Ba—H原子间距(见图2),可推测3种吸附构型中Ba2+与KDP(100)表面具有相同的作用机制,即Ba2+与O原子之间的结合方式同样为离子键,而Ba2+与H1之间则存在一定的共价作用。
3 结论
(1)Ba2+在KDP晶体(100)表面不同位置的吸附能均为负值,大小为-0.80~-1.14eV,意味着Ba2+可以自发吸附到KDP(100)表面上,从而进一步对KDP晶体的生长过程和光学性能产生影响。
(2)Ba2+在KDP晶体(100)表面共形成3种稳定的吸附构型,最佳吸附位置分别为O原子顶位、来自同一磷酸根基团的两个O原子间的桥位,以及来自不同磷酸根基团的两个O原子间的桥位,其中第二种吸附构型最稳定。在3种构型中,Ba2+与表面O原子均通过离子键结合,与表面最外层的H原子产生一定的共价相互作用。
(3)Ba2+对KDP晶体(100)表面结构有一定的影响,表面的P—O键、H—O键以及K—O键均有不同程度的伸长或缩短,同时表面的氢键结构和形式也发生了明显的变化。

