基于rDNA ITS1序列的甘肃省叶螨属Tetranychus和全爪螨属Panonychus种群的系统关系
白映禄,薛玉丽,常芸,尚素琴
(甘肃农业大学植物保护学院,甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
近年来随着甘肃省玉米、果树等农作物种植面积的增加,叶螨逐渐成为了阻碍甘肃省农业发展的主要因素之一[1].叶螨主要通过取食植物叶肉组织的细胞及细胞液,使植物的生理状态恶化,叶片掉落,甚至引起植株死亡,从而降低了农作物的产量[2].鉴于叶螨在甘肃省农作物上的发生与危害程度,对其种群系统关系的研究工作势在必行.
由于叶螨体型微小,物种间形态学特征相似,往往给种类鉴定造成困难.rDNA ITS1序列是位于18S与5.8S之间的内转录1区,进化速率较慢,有高度保守性,是研究近缘种、复合种及种内生物型间亲缘关系和系统发育的良好分子标记[3-4].目前基于ITS序列来研究害螨种群系统关系方面的研究已有报道.Ben-David和Navajas等[5-7]利用ITS2序列间的差异对植绥螨科(Phytoseiidae)和叶螨科(Tetranychidae)物种进行鉴定,甚至是相近物种、复杂物种和地理种群的鉴定;Navajas等[8]对来自地中海盆地的二斑叶螨种群核糖体ITS2序列变异进行了调查,评估了寄主植物的作用和遗传分化过程中的地理距离.然而利用ITS对甘肃省叶螨鉴定的报道并不多,只有少数的关于其遗传结构和系统发生的研究[9].因此,本试验依据中国经济昆虫志(二十三册,螨目)[3]所提出的叶螨形态特征对叶螨科2个属6个种27个种群进行了形态鉴定,对其rDNA ITS1序列进行了测序和研究,旨在利用rDNA ITS1对叶螨进行分子鉴定和系统发育分析,为叶螨的种类鉴定和系统关系提供相应的依据.
1 材料与方法
1.1 材料
供试虫源:供试叶螨属物种采集于甘肃省4个地区不同寄主,采集地和寄主植物见表1.将采集到的叶螨使用“叶碟法”饲养在室内,饲养条件为(25±1)℃,L∶D=16∶8 h.保存在无水乙醇中,用于后续试验.
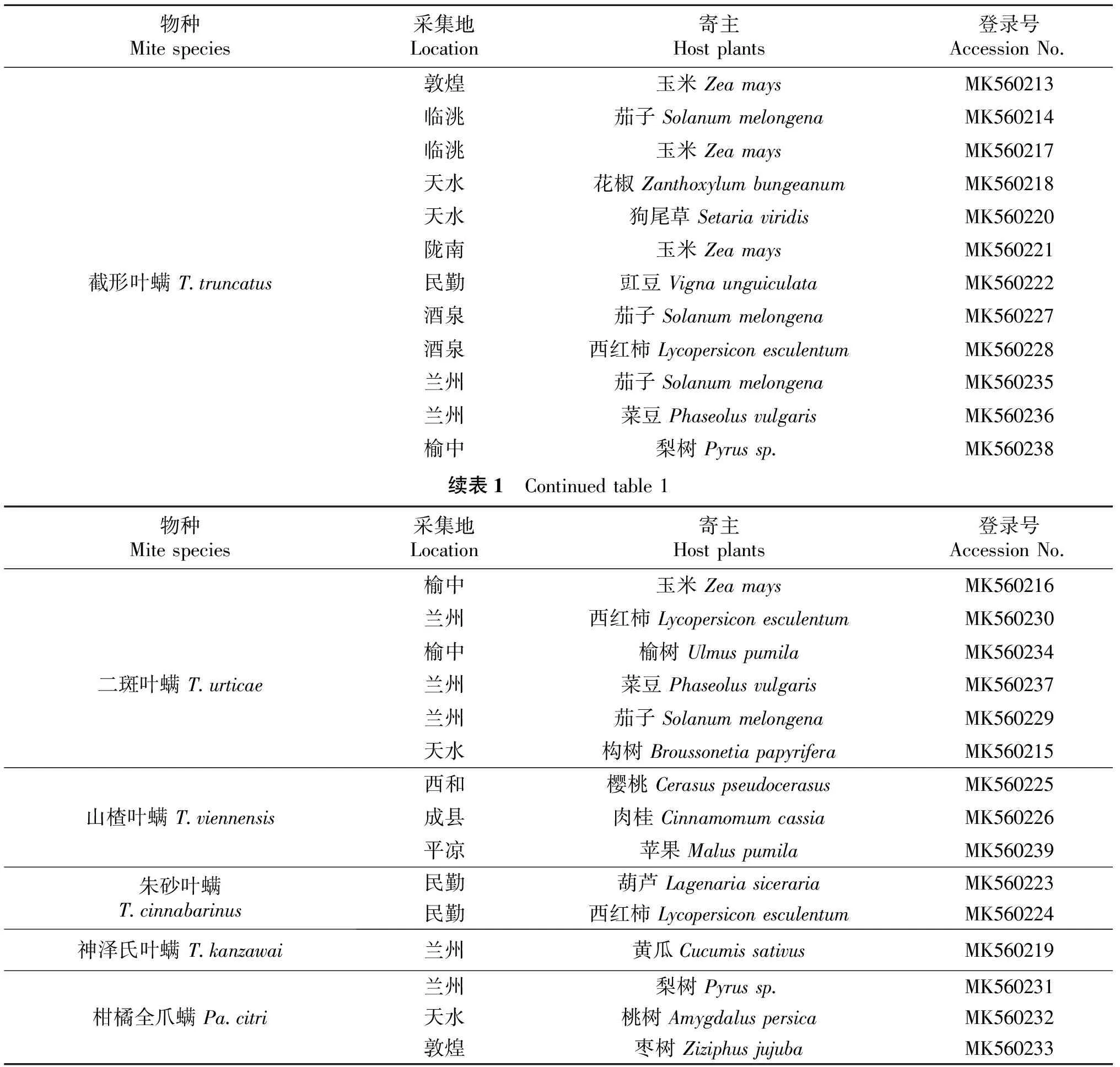
表1 甘肃叶螨采样信息
供试药剂:STE缓冲液(含100 mmol/L NaCl,10 mmol/L Tris-HCl和1 mmol/L EDTA,pH 8.0),蛋白酶K(10 mg/mL).
1.2 方法
1.2.1 叶螨总DNA提取 DNA的提取参考GOMI Koh等的方法[10].具体操作如下:向已编号的1.5 mL离心管内加入25 μL STE缓冲液,在体视显微镜下挑取成活且长势一致的单头雌成螨(保存于无水乙醇中的螨需在无菌水中清洗,历时5 s,重复3次)放入离心管内,立即研磨,研磨后将离心管置于冰上,向离心管内加入2 μL蛋白酶K(10 mg/mL),1 000 r/min离心10 s后,于37 ℃下孵育30 min,95 ℃初始变性5 min,于-20 ℃条件下保存.
1.2.2 叶螨ITS1序列PCR扩增和测序 使用一对特异性引物[11]从叶螨rDNA的5.8S和28S之间的转录间隔区1(ITS1)中扩增出一段长度为650 bp左右的片段.
上游引物为:5′-ATATGCTTAAATTCAGC GGG-3′;下游引物为:5′-GGGTCGATGAAGAA CGCAGC -3′.
PCR反应体系(50 μL):DNA模板2 μL,ddH2O 30.6 μL,10倍buffer 5 μL,MgCl2(25 mmol/L)5 μL, dNTPs(各种浓度均为10 mmol/L)4 μL,TaqDNA聚合酶(5 U/μm)0.4 μL,上下游引物(10 μmol/L)各1.5 μL.
PCR反应程序:94 ℃预变性4 min,92 ℃变性30 s,51 ℃退火30 s,72 ℃延伸1 min,共35个循环,72 ℃总延伸10 min,4 ℃保存.取每个PCR反应产物5~9 μL,用1.0%的琼脂糖凝胶电泳进行验证,后将PCR产物送去西安擎科泽西生物有限公司测序.
1.3 数据比对及分析
将测序所得的叶螨rDNA ITS1序列先提交到GenBank数据库中,然后利用“BLAST”工具(NCBI网站)进行序列分析、DNA序列检索,用GenDoc软件进行序列同源性比较,用BioEdit软件进行序列编辑,用(Clustal X)软件进行序列比对,DAMBE用于核苷酸序列的饱和度分析,比对结果输入MEGA 6.0软件,采用距离法计算各样品间的遗传距离,并基于Kimura-2 Parameter模型,用邻接法(Neighbor-Joining,NJ)构建系统发育树,通过自展1 000次检验获得系统树分支的置信度[12-13].
2 结果与分析
2.1 基于ITS1的序列差异及饱和度分析
本试验研究了来自叶螨科2属6种27个种群的rDNA ITS1长度为596~688 bp的片段.保守位点390个,变异位点300个,简约信息位点294个,碱基A、T、C、G的平均含量分别为32.5%、31.0%、18.6%、17.9%.A+T含量(63.5%)明显高于C+G含量(36.5%),有明显的A/T偏倚性.核苷酸多样性为0.128.共检测出9个单倍型,单倍型指数为0.775.各单倍型在各地区种群中的分布见表2.9个单倍型中,H1包含的个体最多,为主单倍型,共出现12次,占样本总数的44.4%,分布在5个地区.其次为H2,出现5次,占样本总数的18.5%,分布在2个地区.H4、H5、H7出现3次.其余单倍型各出现1次.
由表3可知,叶螨属内二斑叶螨和神泽氏叶螨核苷酸差异仅为0.010,柑橘全爪螨和山楂叶螨核苷酸差异为0.409.由此可看出属间遗传距离远大于种间遗传距离.叶螨属内平均遗传距离为0.124.
将rDNA ITS1序列中所有位点的转换(S)、颠换(V)同Tamura-Nei(TN93)距离进行比较来验证叶螨ITS1序列中是否存在突变饱和现象.rDNA ITS1序列全部位点的转换和颠换与相应的序列差异的散点图(图1)显示,转换颠换没有发生突变饱和,所得序列可以用于后续的系统发育分析.

表2 各单倍型在群体中的分布
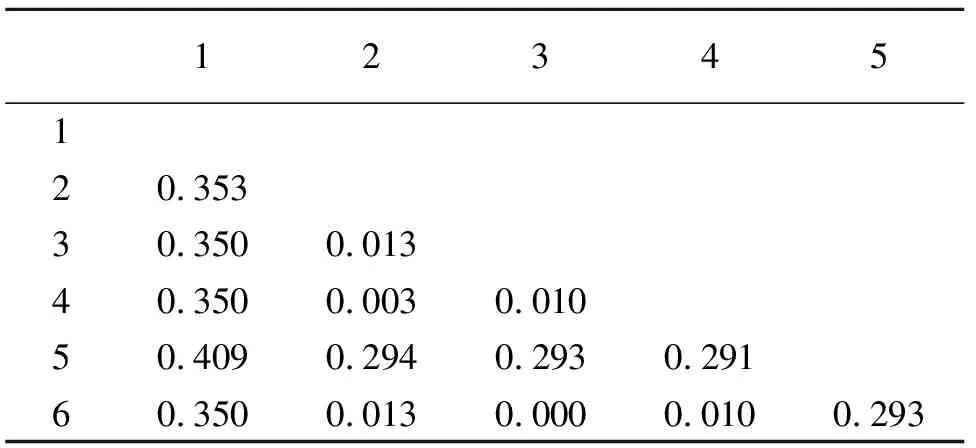
表3 叶螨ITS1序列的种间遗传距离
1:柑橘全爪螨;2:朱砂叶螨;3.截形叶螨;4:二斑叶螨;5:山楂叶螨;6:神泽氏叶螨.
1:Pa.citri;2:T.cinnabarinus;3:T.truncatus;4:T.urticae;5:T.viennensis;6:T.kanzawai.
2.2 基于ITS1构建系统发育树
本研究所得到的27个叶螨的ITS1序列已提交到GenBank(登录号MK560213-MK560239).引用GenBank中登录号为GQ141938和GQ141944序列作为外群,采用邻接法(NJ)构建甘肃叶螨不同种群的系统发育树,并对各分支的置信度自展法进行1 000次检验.如图2所示,土耳其斯坦叶螨(GQ141938)和酢浆草岩螨(GQ141944)作为外群,最先被分离出来.两个叶螨的种群都以较高的置信度成一个进化分支,柑橘全爪螨独立聚为一支分支.不同物种之间的界限清晰.朱砂叶螨T.cinnabarinus和二斑叶螨T.urticae种群聚合在一起,但神泽氏叶螨T.kanzawai的分类归属并未得到很好地解决.
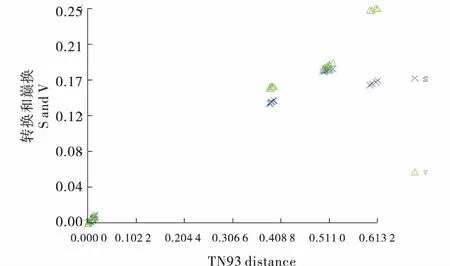
图1 甘肃叶螨不同种群ITS1序列碱基替换饱和性分析Figure 1 Saturability analysis of base substituttion of spider mite genus Tetranychus based on ITS1 sequences in Gansu
3 讨论
叶螨属的ITS序列具有物种内差异小,物种间差异大的特性[14],为叶螨属物种的鉴定提供了可靠的分子标记.其中二斑叶螨的多态型与其广泛分布、多食性均有着密切关系,给鉴定造成很大困扰[15-16].1971年国际动物命名委员会建议将红色型定为朱砂叶螨(T.cinnabarinus)[7],但是国内外学者对这两个物种持有不同的观点.匡海源等[18]对二者的形态特征(包括体色、足I胫节刚毛以及阳具形状)进行了对比,测定了两个种的非越冬型雌成螨的过冷却点,结果都存在差异,而且杂交试验的结果也证实了它们各为独立的种.但随着研究的逐渐深入和分子技术在物种鉴定上的应用,Navajas、Ueckermann等[5,19]比较了两种叶螨的rDNA ITS2和mtDNA COI序列,并采用构建微卫星富集文库等分子生物学手段,研究发现朱砂叶螨和二斑叶螨进化同源性很高,认为二者存在同物异名现象,应该分别为红色型和绿色型,提出二者属于同一个种.本研究分别提取了2种色型叶螨的ITS1序列,经过计算两者间遗传距离为0.003,在系统发育树中朱砂叶螨与二斑叶螨聚合在一起,该结果与李国庆等[20]报道二斑叶螨和朱砂叶螨遗传距离为0,在系统发育树中二者同在一个分支上的结果类似,说明二斑叶螨与朱砂叶螨为同种不同色型.
DNA条形码技术通常是利用线粒体5′端序列将物种鉴定到种水平的一种方法.本研究通过使用ITS1分子条形码对叶螨属种内差异进行分析,结果表明,6 种叶螨种间差异均大于2%,种内的差异性小于2%,该结果与Hebert等[21]报道98%的物种种间核苷酸差异大于2%,种内差异小于2%的结果相同.本试验中截形叶螨和神泽氏叶螨之间核苷酸差异为0,二斑叶螨与神泽氏叶螨以及截形叶螨与二斑叶螨之间核苷酸差异均为0.010,表明这3 个物种间的ITS1片段都具有高度的保守性,但是该结果与Navajas等[22]报道土耳其斯坦叶螨和截形叶螨之间核苷酸差异小于0.5%的结果有所不同,可能是因为以下原因:(1)不同种类的叶螨之间核苷酸距离存在差异性;(2)不同地域环境因素对叶螨形态及遗传特性的影响.核糖体RNA第一转录间隔区具有高度保守性,进化速率较慢,仅通过序列间核苷酸微小的差异难以对物种做出正确的鉴定,因此在进行有关叶螨的分类研究时,建议分子条形码鉴定应结合形态学鉴定结果进行.
崔玉楠[23]利用ITS作为分子标记对中国8个叶螨属物种进行了系统发育分析,结果表明,种间差异大于种内差异,系统发育树中同物种的不同个体都聚合成一簇,该结果与本研究结果一致.但是本研究中神泽氏叶螨的系统关系并未有充分的明确,可能是因为以下原因:(1)采集到的神泽氏叶螨样品有限,物种丰富度不够;(2)其体内寄生有Wolbachia、Cardinium等共生菌,从而引起细胞质不亲和现象,影响其种群遗传结构及遗传多样性[24].但不可否认的是rDNA ITS1是一种有效的DNA分子标记,适用于解决叶螨科属种的系统发生地位,同时它可以作为线粒体分子标记的一个重要辅助手段,为叶螨DNA条形码的研究提供参考.同时,本试验也研究了来自叶螨科2个属6种27个种群的rDNA ITS1长度为596~688 bp的片段,其保守位点390个,变异位点300个,简约信息位点294个,碱基A、T、C、G平均含量为32.5%,31.0%,18.6%,17.9%.A+T含量(63.5%)明显高于C+G含量(36.5%),有明显的A/T偏倚性.核苷酸多样性为0.128.共检测出9个单倍型,单倍型指数为0.775.该试验结果与杨顺义等[13]报道在34个截形叶螨地理种群中共获得518条mtDNACOI基因片段,测定片段长度为402 bp,T, C,A和G 4个碱基平均含量分别为43.2%、10.5%、32.2%和14.0%,A+T含量为(75.4%)明显高于C+G含量(24.6%),有明显的A/T偏倚性,核酸多样性指数为0.032 8,共检出12个单倍型,单倍型指数为0.800 4的结果相似,说明甘肃省叶螨群体内部遗传多样性丰富.
近年来,随着甘肃省玉米和果树等作物的种植面积增加,本研究中的6种叶螨已成为主要的为害螨品种,严重阻碍了甘肃省农业发展.本研究通过基于rDNA ITS1序列的甘肃省叶螨属Tetranychus和全爪螨属Panonychus种群的系统关系研究,以期为明确甘肃不同叶螨种群间的系统发育及进化关系提供一定的遗传学证据,进而为该螨的区域性发生规律研究和防治策略制定等提供分子生物学基础理论依据.目前本研究仅限于对采自甘肃的不同地理种群及不同寄主的共27个叶螨种群的rDNA ITS1序列和不同叶螨种内、种间的亲缘性差异等进行比较分析,但是有关不同叶螨基于基因组水平上的差异性分析等仍需进一步研究.
4 结论
本研究基于rDNA ITS1序列探讨了甘肃省叶螨属和全爪螨属种群的系统关系,结论可知,系统发育树中朱砂叶螨与二斑叶螨聚合在一起,支持二斑叶螨与朱砂叶螨为同种不同色型的观点;6 种叶螨种间差异均大于2%,种内差异小于2%;截形叶螨和神泽氏叶螨之间核苷酸差异为 0,二斑叶螨与神泽氏叶螨以及截形叶螨与二斑叶螨之间核苷酸差异均为0.010,表明 3 个物种间的ITS1片段都具有高度保守性;明确了叶螨属和全爪螨属的系统发生地位,山楂叶螨与其他叶螨属物种亲缘关系较远.

