甲状腺乳头状癌组织miR-129 表达与临床病理特征的相关性
李 滢 刘 芳 冯 利 陈 双
甲状腺癌是内分泌系统最常见的头颈部肿瘤。甲状腺癌的病理类型包括乳头状癌、未分化癌、髓样癌及滤泡状癌,其中甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的恶性肿瘤,占甲状腺癌的70%左右[1]。尽管多数患者预后良好,但是仍有一部分PTC 出现高侵袭、早期转移[2]。因此,开展PTC 相关分子标志物的研究,为临床早期诊断和治疗预后提供新的方法一直是临床上的研究热点。目前普遍认为,由正常细胞转变为癌细胞,累及周围组织器官或发生远处转移是一个及其复杂的基因变化[3]。微小RNA-129(miR-129)是一种内源性单链非编码的小RNA 分子,有调控细胞的生长、分化、增生和凋亡的作用[4]。近年研究发现,miR-129 在结直肠癌、前列腺癌等中呈低表达[5-6]。本研究旨在分析miR-129 在PTC 组织表达及其与临床病理特征的相关性,现报道如下。
1 资料与方法
1.1 临床资料 选取2010 年11 月—2014 年2 月浙江省台州恩泽医疗中心(集团)路桥医院收治的PTC 患者125 例作为研究对象,其中男32 例、女93例,年龄20~75 岁,平均(40.36±8.42)岁。病理分级和临床TNM 分期参照国际抗癌联盟第6 版甲状腺癌分期分级标准[7]:1 级77 例、2 级48 例;临床TNM 分期:Ⅰ期24 例、Ⅱ期51 例、Ⅲ期35 例、Ⅳ期15 例。本研究经医院伦理委员会审核通过。患者均知晓本研究内容并签署知情同意书。
1.2 纳入标准(1)均符合国际抗癌联盟第6 版甲状腺癌分期分级标准;(2)均进行全甲状腺切除+患侧中央区淋巴结清扫;(3)均经术后病理学确诊。
1.3 排除标准(1)有严重肝肾功能不全者;(2)合并其他恶性肿瘤者;(3)入院前经过放疗或化疗等治疗者;(4)临床及随访资料不完整者。
1.4 标本采集 选取125 例PTC 并行手术治疗患者,收集PTC 癌变组织125 份作为研究组,另在手术过程中收集125 份距离癌组织边缘5cm 以上正常甲状腺组织为对照组,两组组织标本均进行miR-129水平的检测。
1.5 定量聚合酶链反应(qPCR)检测甲状腺乳头状癌组及癌旁组织miR-129mRNA 表达 采用TRIzol[赛墨飞世尔科技(中国)有限公司,批号ab49534]提取0.3g 甲状腺癌组织及癌旁组织总RNA。使用RevertAid First Strand cDNA Synthesis 试剂盒(美国Life Technologies 公司,批号C120835)产生第一链互补(c)DNA。使用GAPDH 进行标准化(GAPDH 正向引物5'-CTCGCTTCGGC-AGCACA-3';反向5'-AACGCTTCACGAATTTGCGT-3')。PCR 引物由英潍捷基(上海)贸易有限公司提供并合成,序列如下:miR-182 正向引物:5'-CTTGCTATACAAGGGCAAGCACGAA-3',反向引物:5'-CTTGAGTACGACCAAATCCCGTC-3。具体操作:将2μL RNA 与1μloligo(dT)和10μL 无RNase 的去离子水混合,在PCR 机中在70℃下孵育5min 并立即在冰上冷却。通过加入4μL 5X 缓冲液,2μL 10mM 脱氧核糖核苷酸三磷酸,1μL RNA 抑制剂和1μL 逆转录酶诱导cDNA 合成,然后在PCR 机中于42℃温育1h。通过在70℃温育5min 终止反应。使用THUNDERBIRDS YBR qPCR Mix 试剂盒(日本Toyobo Co,Ltd,Tokyo,Japan公司,批号6514)进行定量测量。对于PCR,将12.5μL 2XqPCR Mix,2.0μL 每 种 引 物(2.5μM),2.0μL cDNA 和8.5μL 双蒸水加入0.2mL PCR 管中。扩增条件包括40 个循环,95℃,15min,95℃,15s,55℃,30s,72℃,25s。然后将反应保持在4℃。使用阈值循环(Ct)的值确定每个靶基因的mRNA 表达。在与GAPDH 比较后使用2-ΔΔCT 方法计算相对表达。
1.6 统计学方法 应用SPSS 20.0 软件进行数据统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用t 检验,计数资料以率(%)表示,两组间采用χ2检验,采用Kaplan-Meier 法估计不同临床特征PTC 患者的生存情况,通过非条件单因素和多因素Cox 比例风险回归模型分析影响PTC 患者预后的相关因素,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组组织标本miR-129mRNA 表达水平比较PTC 患者其PTC 癌变组织miR-129 mRNA 表达水平低于癌旁正常组织[(0.66±0.21)比(1.89±0.48),P<0.01]。
2.2 不同临床特征PTC 患者甲状腺癌组织miR-129 表达比较 根据ROC 曲线取miR-129 mRNA=0.49 时,约登指数最大为0.38。因此,miR-129 mRNA=0.49 时作为诊断PTC 的截点,miR-129 低表达患者(≤0.49)33 例(26.40%),miR-129 高表达患者(>0.49)92 例(73.60%)。miR-129 的表达与PTC 患者其年龄、性别、肿瘤大小情况均无明显关系(P>0.05),miR-129 的表达与PTC 患者临床分期、淋巴结转移及病理分级的表达有显著关系(P<0.001、P<0.001、P=0.018),见表1。
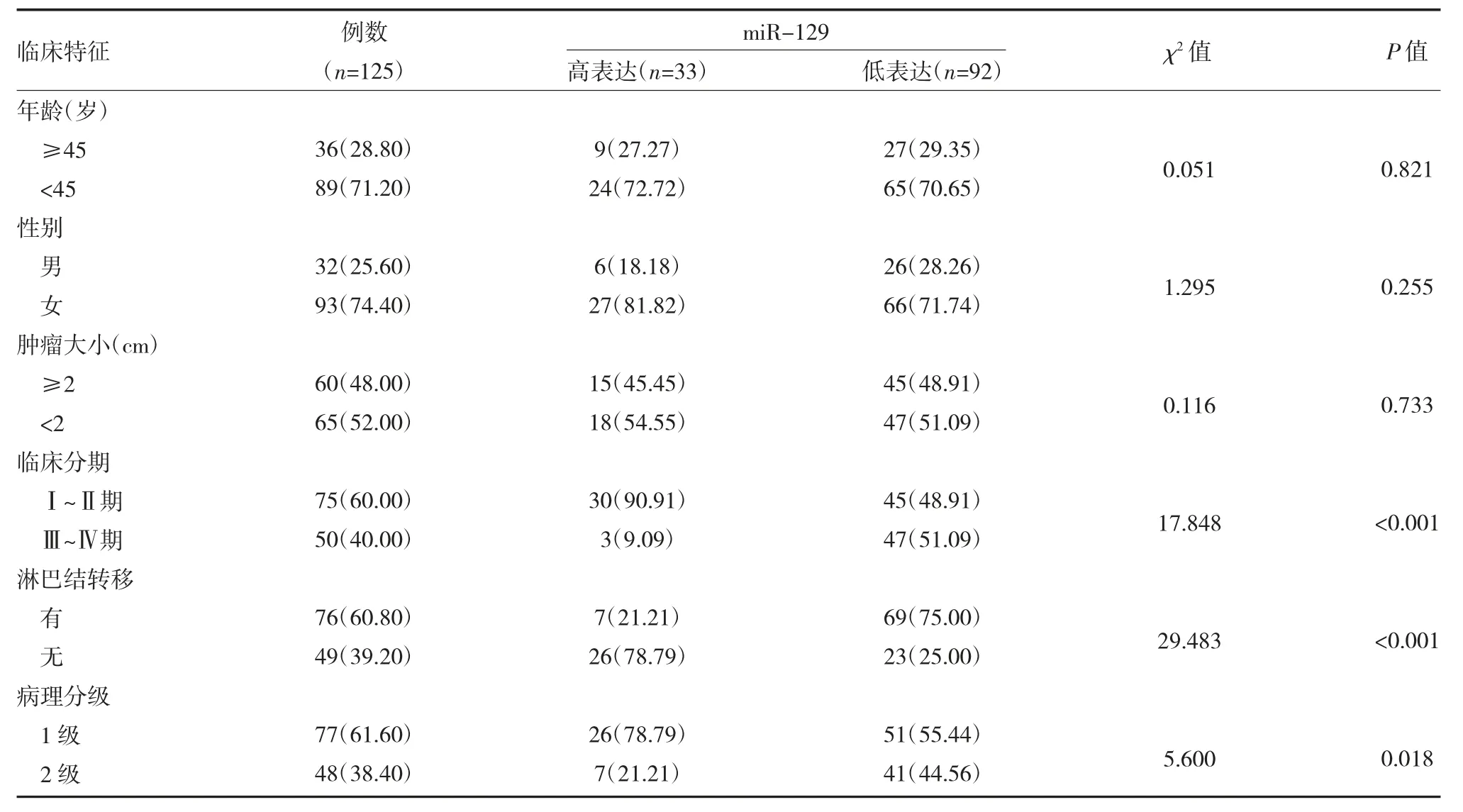
表1 不同临床特征的PTC 患者其miR-129 表达情况比较[例(%)]
2.3 PTC 患者预后生存情况 本研究125 例PTC患者中,自出院后至随访结束存活4~60 个月,5 年生存率50.40%(63/125)。其中miR-129 高表达和低表达患者5 年总生存率分别为72.73%(24/33)和42.39%(39/92),经统计学分析,差异有统计学意义(P<0.05)。
2.4 影响PTC 患者预后的单因素分析 经单因素分析得出:临床分期Ⅲ~Ⅳ期、有淋巴结转移、病理分级2 级及miR-129 水平低表达时患者生存时间均显著缩短(P<0.05),见表2。
2.5 影响PTC 患者预后Cox 多因素分析 经多因素Cox 比例风险回归模型分析得出:临床分期Ⅲ~Ⅳ期、有淋巴结转移、病理分级2 级及miR-129 水平低表达均为影响PTC 患者预后的独立危险因素(P<0.001),见表3。
3 讨论
机体内的细胞因子和基因的表达与患者治疗及预后情况密切相关[8],故寻找影响患者病情进展和预后的相关因素是改善PTC 患者预后的关键。miRNA是一类长度为20~24nt 的单链非编码微小RNA,广泛存在于动植物中。肿瘤细胞组织miRNA 基因的改变存在多样化,主要以基因缺失、过表达及基因扩增为主[9]。研究表明,miRNA 在细胞或组织中可充当抑癌基因或者促癌基因的角色,直接影响肿瘤的发生、发展[10]。相关研究证实,miR-34、miR-1301、miR-19等在PTC 异常表达,对PTC 患者造成严重影响[11-12]。
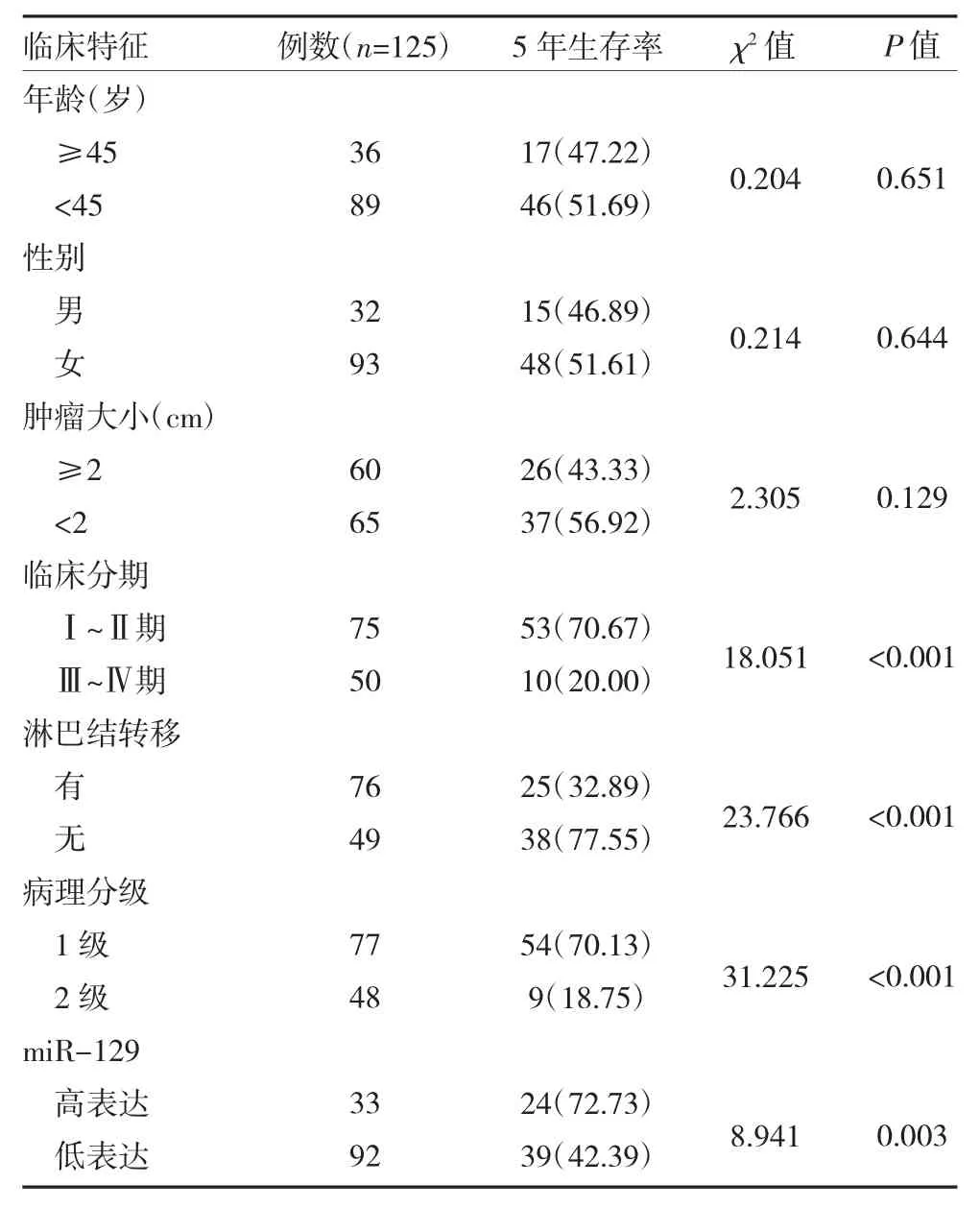
表2 影响PTC 患者预后的单因素分析
本组研究中,PTC 癌变组织miR-129 表达低于癌旁正常组织,患者临床分期越高、有淋巴结转移、病理分级越高其miR-129 低表达率明显升高,这提示miR-129 在机体中的表达与PTC 的发生和疾病进展有密切关系。于浩等[13]研究表明,miR-129 在膀胱癌组织呈低表达水平,且支持miR-129 可能成为膀胱癌诊断的无创肿瘤标记物,可用于早期诊断及预后判断和复发的预测。潘印等[14]研究显示,在前列腺癌患者,miR-129 在肿瘤低分化、病理分期越高中呈低表达。本研究结果与上述结果一致,进一步证实miR-129 参与肿瘤的发生、发展。多因素Cox 回归分析显示,临床分期Ⅲ~Ⅳ期、有淋巴结转移及病理分级2 级及miR-129 低表达均为PTC 患者预后独立危险因素(P<0.05)。既往研究表明,张力蛋白同源的基因、人类第10 号染色体缺失的磷酸酶及程序性细胞死亡因子4、肌球蛋白1 等在恶性肿瘤形成过程中起重要作用的抑癌基因,均为miR-129 的下游靶基因,通过调控这些下游靶基因,进而调控这些因子所在的信号传导通路,从而在恶性肿瘤的发生和进展中起促进作用[15]。由此可见,miR-129 在PTC 患者疾病的发生、进展以及预后中有着重要的影响,因此,miR-129 可作为判断甲状腺乳头状癌临床病理特征及预后的生物标志物,临床上检测miR-129 表达水平,预测PTC 患者的预后情况。
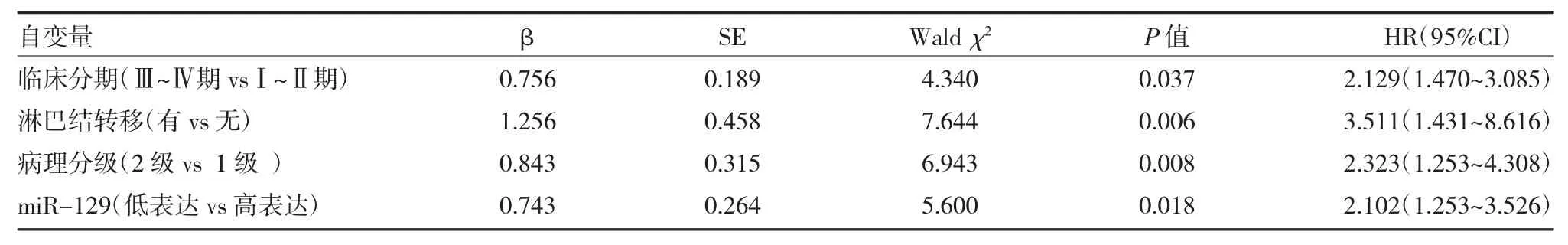
表3 影响PTC 患者预后Cox 多因素分析
综上所述,在PTC 癌组织miR-129 以较低水平表达,随患者临床分期越高、有淋巴结转移、病理分级越高时其表达率均上升。miR-129 表达水平与肿瘤的进展程度和恶性程度呈负相关,miR-129 低表达PTC患者预后相对较差,检测miR-129 表达水平有利于PTC 的诊断及预后评价。但本组研究所选样本量较少及研究及随访时间过短,对于miR-129 的表达是否受其他因素影响尚未明确,需进一步深入研究。

