抗氧化剂引发对无芒雀麦老化种子发芽及幼苗生长的影响
孙铭,王思琪,艾尔肯·达吾提,毛培胜*
(1.中国农业大学草业科学系,草业科学北京市重点实验室,北京 100193;2.新疆草原总站,新疆 乌鲁木齐 830049)
种子是植物遗传资源保存和种质创新的基础[1]。种子在生理成熟后干燥的状态下可维持较长时间的活力,但即使在良好的人为管理条件下贮藏也不可避免地要经历老化过程,在该过程中种子生存和萌发必需的成分被逐渐破坏,使其活力逐渐丧失并最终死亡[2-4],因此种子老化的研究显得尤为重要。种子在老化过程中会造成膜系统受损,酶活性普遍降低,遗传物质完整性下降,萌发及生长减缓,发芽能力丧失等现象,表现为发芽势、发芽率、发芽指数和活力指数降低,幼芽和幼根生长受到抑制[5-6]。目前认为活性氧(reactive oxygen species,ROS)产生与消耗失衡是造成种子老化的关键[7],因此ROS清除剂的研究对种子的老化修复尤为重要。
抗氧化剂是维持种子生命力的重要活性物质,添加适当的外源抗氧化剂,可以与种子内部的活性物质共同完成ROS的清除,进而延缓或者修复种子的损伤[7]。抗坏血酸(ascorbic acid,AsA)和谷胱甘肽(glutathione,GSH)是抗坏血酸谷胱甘肽循环中两种重要的抗氧化物质,褪黑素(melatonin,MT)则是目前已知的清除能力最强的自由基清除剂[8],它们在清除植物体内过量的ROS方面具有重要的作用。目前,这些抗氧化剂在种子生理方面已经有初步研究,主要集中在正常种子萌发及其抗逆生理方面。通过AsA处理盐[9-10]、重金属[11]、低温[12]和高温[13]等胁迫下的种子,发现AsA可以缓解胁迫对种子萌发及幼苗生长的抑制作用;MT同样对盐胁迫[14]、高温处理[15]等种子的萌发具有促进作用。相比而言,利用GSH外源添加研究种子生理的较少,如其对种子膜脂过氧化程度的影响[16]和重金属离子毒害的缓解[17]等。但在抗氧化剂的研究上,尤其是通过引发技术对种子老化及活力修复的研究较少。然而引发处理被认为是提高种子活力的有效手段,可以改善种苗的整齐度和出苗率,并增加种子和种苗的抗逆性[18]。本试验以无芒雀麦(Bromusinermis)种子为材料,利用AsA、GSH和MT溶液进行引发处理,探讨其对老化种子的发芽、幼苗生长及抗氧化酶活性的影响,以期为缓解种子的老化提供理论参考,对草牧业可持续发展具有重要意义。
1 材料与方法
1.1 试验材料
供试的无芒雀麦种子由中国农业大学牧草种子实验室提供,2016年秋季收获于河北省承德市国营鱼儿山牧场,试验于2017年5-12月进行。种子基本信息见表1。

表1 无芒雀麦种子基本信息Table 1 Basic information of smooth bromegrass seeds (%)
参照国际种子检验协会种子检验规程(International Seed Testing Association,ISTA,2016)[19]测定种子含水量。称取洁净的无芒雀麦种子约4.5 g放入样品盒后称重(精确到0.001 g),设置2次重复。将样品放于烘箱中在130~133 ℃下烘干1 h,然后盖好样品盒盖在干燥器中冷却45 min后称重。种子含水量计算公式为:种子含水量(%)=(M2-M3)/(M2-M1)×100%,式中:M1为样品盒和盖的重量(g),M2为样品盒、盖及样品的烘干前重量(g),M3为样品盒、盖及样品的烘干后重量(g)。
供试种子的初始含水量为10.6%,目标含水量为10.0%,需将其含水量调低。首先称取一定量的种子W0,计算出目标含水量时种子的质量,计算公式为:目标含水量时种子的质量(g)=[(100-MC0)/(100-MCr)]×W0,式中MC0为初始含水量(%),MCr为需达到的含水量(%),W0为初始种子质量(g)。将这些种子置于0.075 mm筛中室温干燥,并频繁称量其重量,达到目标含水量时立即将种子密封于铝箔袋中。
将调整好含水量的无芒雀麦种子3 g密封于10.0 cm×14.8 cm的铝箔袋中,在45 ℃恒温水浴箱内进行老化处理16 d,然后将种子恢复至室温后存放于4 ℃冰箱内备用,每个处理4次重复。
1.2 试验方法
1.2.1老化后抗氧化剂引发处理 将老化的无芒雀麦种子分别浸入AsA溶液(2 mmol·L-1)、GSH溶液(0.25 mmol·L-1)、MT溶液(100 μmol·L-1)以及蒸馏水(WT)中,在4 ℃冰箱中引发2 h,每个处理重复4次。引发后用蒸馏水冲洗3次,并用滤纸将种子表面的水分擦干,在室温下晾至含水量10.0%时的重量后封入铝箔袋中存放于4 ℃冰箱中备用。以老化后未引发的无芒雀麦种子(含水量为10.0%)作为对照(CK)。
1.2.2种子发芽和幼苗生长指标测定 参照国际种子检验协会种子检验规程(2016)[19],选取均匀饱满一致的无芒雀麦种子100粒,将其置于内部垫有3层滤纸的11.5 cm×11.5 cm的培养皿中,设4次重复。培养皿放于光照培养箱(GXZ-380B-LED,宁波江南仪器厂)中在15/25 ℃变温,光照8 h和黑暗16 h条件下培养,光照强度为66%。每24 h统计种子发芽情况,以胚根突破种皮2 mm为标准,计算平均发芽时间;以正常种苗作为种子发芽标准,第7天初次计数,第14天末次计数,计算发芽势和发芽率。待第14天发芽结束后,从中随机取10株正常种苗测量幼苗长和根长,并对这10株种苗进行称重。计算发芽势、发芽率、幼苗长、根长、苗重、平均发芽时间、发芽指数和活力指数。具体计算方法如下:
发芽势(%)=发芽初次计数的正常种苗数/供试种子数
发芽率(%)=发芽终期全部正常种苗数/供试种子数
平均发芽时间=∑nt/∑n
式中:n为在时间t时,新萌发的种子数,t为发芽时间。
发芽指数=∑(Gt/Dt)
式中:Gt为第t天的发芽数,Dt为发芽天数(d)。
活力指数=∑(Gt/Dt)×WF
式中:WF为苗重(g)。
1.2.3酶活性测定 选取0.1 g无芒雀麦种子,加入6 mL预冷的50 mmol·L-1pH 7.0的磷酸缓冲液(含0.1 mmol·L-1EDTA和1% pvp)和少量石英砂置于预冷的研钵中研磨至匀浆,然后将匀浆倒入离心管中混匀。所得匀浆在4 ℃ 8000 r·min-1下离心10 min,上清液为粗酶提取液。将粗酶液分装进行超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性的测定。采用氮蓝四唑(nitroblue tetrazolium,NBT)法测定SOD活性[20];采用愈创木酚显色法测定POD活性[21];采用紫外吸收法测定CAT活性[22]。采用考马斯亮蓝法测定蛋白含量,试剂盒购自苏州科铭生物技术有限公司。
1.3 数据处理
采用SPSS 22.0对老化种子的发芽、幼苗生长和酶活性指标进行方差分析,并在GraphPad Prism 7软件中作图。在PAST 3.15软件[23]中对5组试验(AsA、GSH、MT、WT和CK)测定的4个种子发芽指标(发芽率、发芽势、平均发芽时间和发芽指数)和4个幼苗生长指标(叶长、根长、幼苗重和活力指数)进行了欧式距离计算和基于非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)的聚类分析,采用bootstrap重复1000次。对4组引发处理(AsA、GSH、MT和WT)的8个发芽和幼苗生长指标进行主成分分析,以特征值大于1提取主成分。
2 结果与分析
2.1 抗氧化剂引发对老化种子发芽的影响
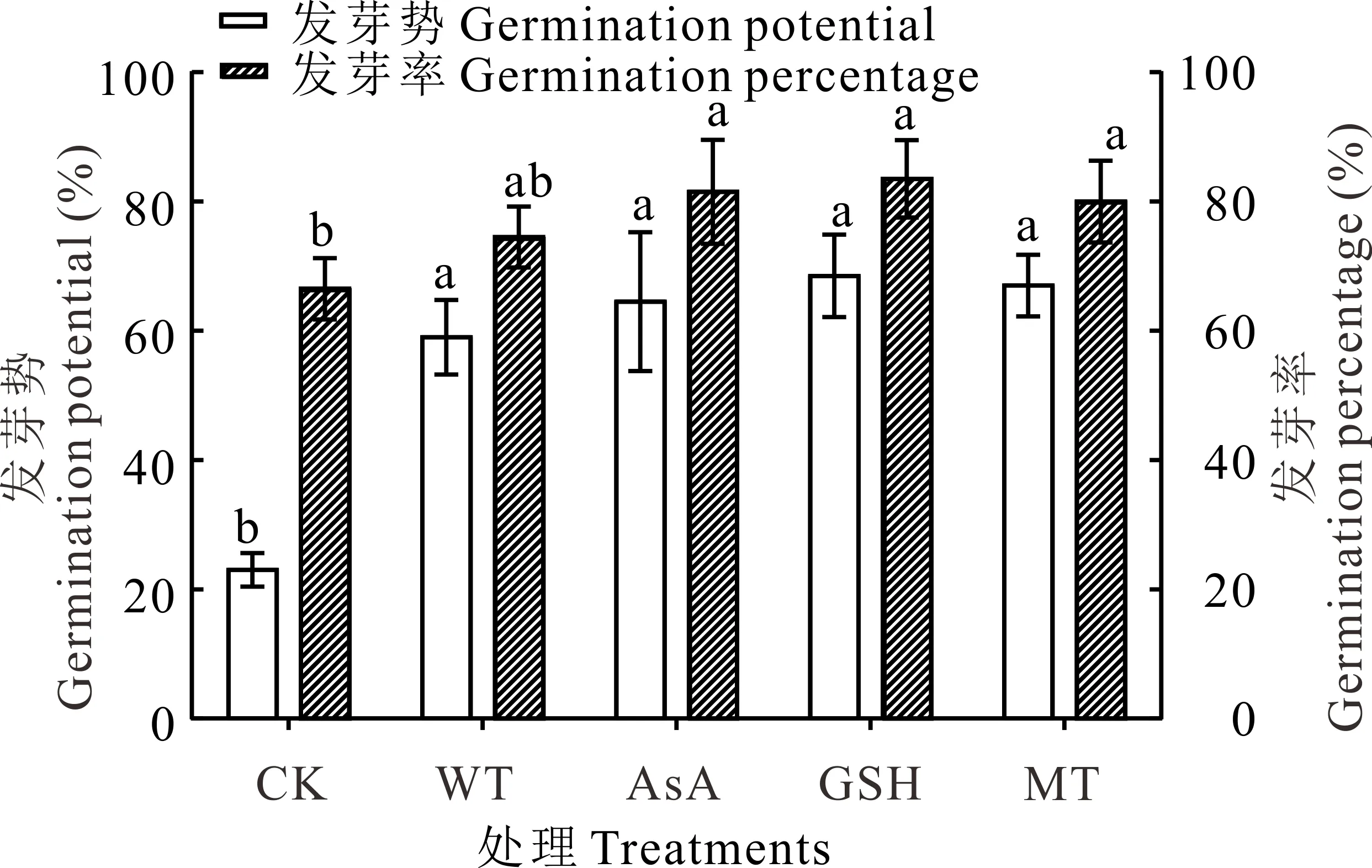
图1 抗氧化剂引发对无芒雀麦老化种子发芽率和发芽势的影响Fig.1 Effects of different antioxidants priming on germination percentage and germination potential of aged seeds of smooth bromegrass 同一指标中不同小写字母代表处理间差异显著(P<0.05),下同。Means designated by different lowercase letters indicate different significantly between treatments at 0.05 level, the same below.
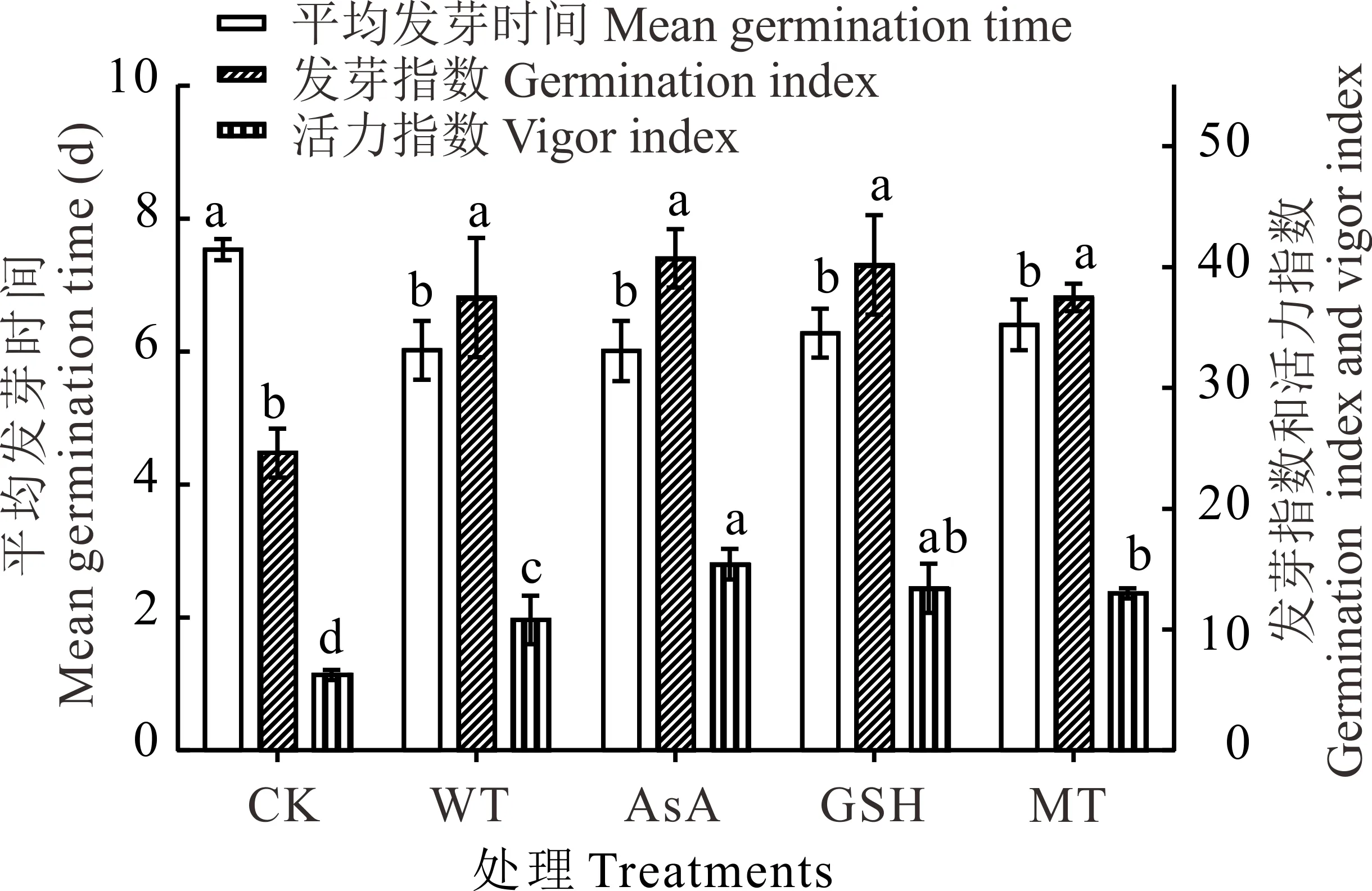
图2 抗氧化剂引发对无芒雀麦老化种子平均发芽时间、发芽指数和活力指数的影响Fig.2 Effects of different antioxidants priming on mean germination time, germination index and vigor index of smooth bromegrass aged seeds
无芒雀麦老化种子的发芽率和发芽势分别为67%和23%,说明老化处理后种子的发芽率和发芽势均有所降低,而且发芽势降低程度远大于发芽率(图1)。经过水和抗氧化剂引发后,无芒雀麦种子的发芽率、发芽势、发芽指数和活力指数均高于CK,平均发芽时间短于CK(图1和图2)。与CK相比,发芽率在水引发处理(WT)下提升了8.00%,但未达到显著水平(P>0.05);在各抗氧化剂处理下则均有显著提升(P<0.05),平均提升15.17%,其中GSH提升效果最佳为17.00%,为水引发提升效果的两倍多。经过引发的种子与CK相比,发芽势的提升效果比发芽率更好。经过引发(WT、AsA、GSH和MT)后发芽势和发芽指数均显著提升(P<0.05),分别平均提升41.75%和14.36%(图1和图2)。虽然各引发处理之间没有显著差异(P>0.05),但抗氧化剂引发的效果均比水引发好,其中GSH引发对发芽势提升效果最好(44.50%),而AsA对发芽指数的提升效果最好(16.10%)。抗氧化剂引发处理后种子活力指数也显著(P<0.05)高于CK和水引发处理,且AsA引发处理的活力指数显著(P<0.05)高于MT引发,但GSH引发处理与AsA和MT引发处理之间没有显著差异(P>0.05,图2)。此外,经过引发处理后,老化种子的平均发芽时间与CK相比均有显著的缩短(P<0.05),但引发处理之间没有显著差异(P>0.05)。抗氧化剂引发后老化种子第7天的发芽率高于水引发处理,而达到50%发芽率所需时间比水引发稍长(图1和图2),说明抗氧化剂对老化种子的生理效应需要一定的作用时间。
2.2 抗氧化剂引发对无芒雀麦幼苗生长的影响

图3 抗氧化剂引发对无芒雀麦老化种子幼苗生长的影响Fig.3 Effects of different antioxidants priming on seedling growth characteristics of smooth bromegrass aged seeds
无芒雀麦老化种子的幼苗生长测定结果表明(图3),经WT、AsA、GSH和MT引发后,无芒雀麦种苗的叶片和根均显著(P<0.05)长于CK,幼苗重量也显著(P<0.05)高于CK。与WT处理相比,叶长在抗氧化剂引发下平均提高了7.70%,但仅GSH处理具有显著差异(P<0.05),其余各抗氧化剂处理之间差异不显著(P>0.05);根长在抗氧化剂引发处理下同样有所提升,平均提升15.36%,GSH引发处理的提升效果最佳为20.09%,显著(P<0.05)高于WT和AsA处理;苗重经抗氧化剂引发处理后均显著高于WT处理,在3种抗氧化剂中提升效果最佳的为AsA处理,提升32.11%,其次为MT和GSH处理(图3)。
2.3 抗氧化剂引发对无芒雀麦老化种子酶活性的影响
经过抗氧化剂引发处理后,无芒雀麦老化种子抗氧化酶的活性变化呈现出不同的变化规律(图4)。引发后老化种子的SOD活性降低,且只有GSH引发后SOD活性显著(P<0.05)下降,其余各处理(WT、AsA和MT)之间及其与CK之间均无显著差异(P>0.05),表明GSH引发显著(P<0.05)降低老化种子的SOD活性。POD活性在抗氧化剂引发处理后与CK和WT处理相比均显著(P<0.05)升高,但MT、AsA和GSH引发处理之间没有显著(P>0.05)差异。此外,用AsA和GSH引发后老化种子的CAT活性与CK和WT相比显著(P<0.05)升高,而且AsA、GSH和MT引发处理间CAT活性差异显著(P<0.05),且MT引发处理CAT酶活性最低。

图4 抗氧化剂引发对无芒雀麦老化种子酶活性的影响Fig.4 Effects of different antioxidants priming on antioxidase activity in smooth bromegrass aged seeds
2.4 聚类和主成分分析
各试验组之间的欧氏距离范围介于4.74~51.79,平均值为23.70,其中GSH和MT之间的距离最小,GSH和CK之间的距离最大,说明GSH对老化种子的生理影响最大,而与MT的作用相当(表2)。聚类分析结果显示(图5),在阈值为23.78处被分为两组,CK(Cluster Ⅰ)和引发处理(Cluster Ⅱ & Ⅲ),而且可以看出水引发(Cluster Ⅱ)和抗氧化剂引发(Cluster Ⅲ)也可以明显的分开,并且具有较高的自展支持率(100%)。
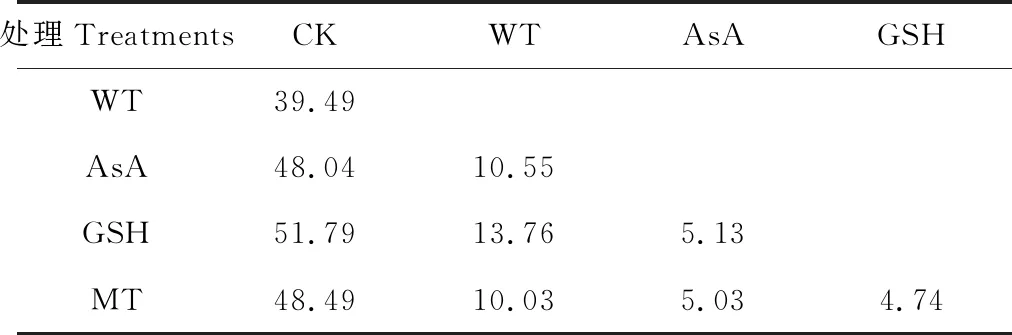
表2 基于种子发芽和幼苗生长指标的欧氏距离分析Table 2 Euclidean distance of control and 4 treatments based on 8 indexes of seed germination and seedling growth

图5 基于种子发芽和幼苗生长指标的聚类分析Fig.5 Dendiagram of the control and 4 treatments revealed by UPGMA cluster analysis of Euclidean distance based on 8 indexes
主成分分析发现(表3),特征值大于1的只有主成分1为3.9968,其贡献率高达99.92%,说明主成分1能代表8个指标几乎所有的信息,对其影响最大的指标是发芽率和发芽势。由此可见,发芽势和发芽率在诸多指标中可以更好地反映不同抗氧化剂引发对老化种子作用的差异。
3 讨论
种子内的ROS积累与清除之间动态的失衡是种子老化的主要因素,其中ROS的清除主要通过增强抗氧化物酶活性和增加非酶促抗氧化剂的含量来实现[7]。CAT、POD和SOD是植物抗氧化酶体系中非常重要的3种防御酶类,其中SOD被认为是植物细胞清除ROS的第一道防线,主要催化O2-的歧化反应生成H2O2和O2;CAT可以高效催化H2O2转化为H2O和O2,该途径为种子中H2O2清除的重要途径;POD则是以H2O2为电子受体催化底物氧化的酶。此外,AsA、GSH和MT等抗氧化剂均不同程度地参与了自由基攻击的防御,其中AsA和GSH不仅可以单独与ROS反应,还可以间接通过AsA-GSH循环来清除自由基。因此,这些酶和抗氧化剂在种子活力研究中扮演着非常重要的角色,往往高活力的种子具有相对较高的SOD、CAT、POD活性,而与之相伴的是较高的种子发芽率、发芽势、活力指数和抗逆性等[24]。这样的结果在非生物胁迫或外源处理正常种子中普遍存在,但利用抗氧化剂引发处理老化种子的研究报道几乎很少。
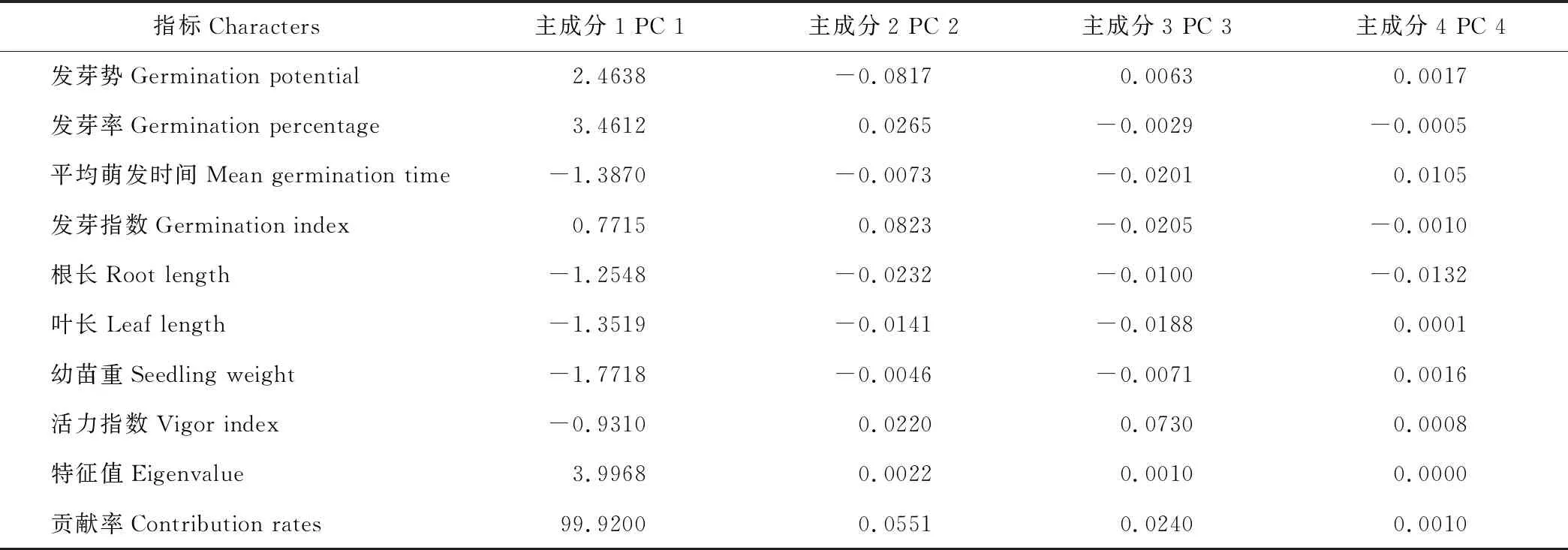
表3 不同引发处理后种子发芽和幼苗生长相关指标的主成分分析Table 3 Principal component analysis of 8 indexes related to seed germination and seedling growth after priming treatments
本研究通过抗氧化剂AsA、GSH和MT引发试验来探讨抗氧化剂、抗氧化物酶以及老化种子发芽和幼苗生长之间的关系。供试的无芒雀麦种子在10%含水量45 ℃条件下老化16 d后种子的发芽率达到66%,说明该种子批的活力已经处于中等水平,而燕麦(Avenasativa)种子在同等条件下老化16 d后其活力仍然处于相对较高的水平,且以往研究发现籽粒小的种质更耐老化[25],这可能与种子收获条件和物种自身抗氧化机制差异有关。王彦荣等[26]利用聚乙二醇对紫花苜蓿(Medicagosativa)和沙打旺(Astragalusadsurgens)种子进行引发,发现其对中等质量的种子具有更好的引发作用。本试验利用水、AsA、GSH和MT对老化的无芒雀麦种子进行引发,发现水对无芒雀麦老化种子的发芽有明显的促进作用,但种子发芽率显示水引发修复后种子仍然处于中等活力,而经过抗氧化剂引发处理的老化种子发芽率均达到高活力水平(发芽率≥80%),说明抗氧化剂对老化种子修复作用的水平更高。Brilhante等[27]研究人工加速老化的豇豆(Vignaunguiculata)种子发现,AsA直接处理能减轻电解质渗透率和脂质过氧化程度,并增加种子的发芽率,而老化前用AsA处理则不能。但Yan等[28]发现利用适宜浓度的AsA提前引发也可以减小种子在老化过程中发芽率的降低。Tommasi等[29]发现在老化的种子中GSH的含量发生下降,而Draganic等[30]外源添加GSH后老化种子的发芽率提升。MT在种子老化方面的研究几乎很少,但其对盐胁迫和高温胁迫下种子的发芽率有明显提升[14]。一般认为,水分引发主要是通过种子缓慢吸水,使损伤的细胞膜有充分时间进行修复和重组,降低种子内有机物质的外渗来提高种子活力[31]。抗氧化剂引发效果更佳可能是抗氧化剂如AsA、GSH和MT等在细胞膜被修复前浸入被损伤的细胞内部,参与了种子内部的代谢活动,与种子自身的修复系统共同对ROS造成的损伤进行修复,并促进了种子的萌发[7]。以往的研究还发现AsA能够调节种子萌发过程中脱落酸(abscisic acid,ABA)和赤霉素(gibberellin,GA)的拮抗作用,进而提高发芽率[32]。本研究中分析的CAT和POD的活性在抗氧化剂的作用下基本都有显著的提升,这与老化处理或胁迫处理下抗氧化剂对老芒麦(Elymussibiricus)[28]、黄瓜(Cucumissativus)[14]和榆树(Ulmuspumila)[33]等的影响基本一致。SOD的活性在引发后并没有得到提升,反而有所降低,与老芒麦[28]和黄瓜[14]的研究结果不同,这可能与无芒雀麦种子老化的过程中积累的ROS种类有关,比如SOD主要参与清除的ROS(如O2-)没有过度积累,而是一些其他的ROS(如H2O2等)积累造成了无芒雀麦种子的老化损伤,使得抗氧化剂引发没能引起SOD活性的升高,但这种推测还需要在以后试验中通过测定ROS的产生来进一步验证。综合以往的研究和本研究的结果,抗氧化剂对种子修复和促进发芽的活动可能主要包括细胞膜系统的修复,胚根的突出,抗氧化相关酶活性的改变以及内源激素的调节[18],而且抗氧化剂对种子的修复过程远比水分对种子的修复复杂,需要更长时间才能达到比水引发更好地效果。此外,抗氧化剂处理的无芒雀麦老化种子发芽后,还表现出比水引发更长的幼苗、根长以及更高的幼苗重,说明抗氧化剂在促进发芽后,还活化了水解酶,动员了种子贮藏组织中贮藏物质的水解,为幼苗生长提供营养。
种子发芽和幼苗生长相关指标是衡量不同状态下种子活力情况的直观表现。通过对不同试验组进行聚类,发现可以将抗氧化剂引发和未使用抗氧化剂的试验区分开来,说明在发芽和幼苗生长情况方面抗氧化剂整体作用明显。其中GSH引发与未引发的种子之间欧氏距离最大,与MT引发的种子之间的距离最近,说明GSH引发对无芒雀麦老化种子的作用在4种引发处理中最有效果,而与MT引发处理在发芽和幼苗生长情况方面差异不大。此外,主成分分析结果显示,发芽率和发芽势在诸多指标中可以更好地反映引发剂引发对老化种子在发芽和幼苗生长上的响应。
4 结论
综上所述,适宜浓度的AsA、GSH和MT溶液引发对无芒雀麦老化种子的发芽和幼苗的生长具有明显的促进作用,表现为提升了老化种子的发芽势、发芽率、发芽指数和活力指数,缩短了平均发芽时间,并增加了幼苗的重量以及根长和叶长,其中GSH溶液引发的整体效果最佳。3种抗氧化剂在引发处理中的作用不尽相同,它们都显著提高了老化种子的活力指数、苗重和POD活性(P<0.05),其中AsA和GSH还显著提高了CAT活性(P<0.05),而且GSH还显著提高了根长(P<0.05)。此外,3种抗氧化剂对老化种子中SOD的活性均没有显著影响(P>0.05)。说明不同的抗氧化剂在修复老化种子时,对抗氧化酶的作用具有选择性,可能与不同物种或老化条件下产生的ROS种类有关。而且抗氧化剂引发对老化种子修复的可能更为复杂,需要较长的时间来达到更好的作用效果。
——黔南扁穗雀麦

