Ni-B-M(M=Cr,Cu)非晶态纳米粒子电催化氧化甲醇的性能对比研究
武繁华,张忠林,李 瑜,刘莉雪,段东红, 刘世斌, 原沁波,王恩志,郝晓刚
(1.太原理工大学 洁净化工研究所,太原 030024;2.中北大学 理学院,太原 030051;3.清华大学 a.水沙科学与水利水电工程国家重点实验室,b.三江源协同创新研究中心,北京 100084)
直接甲醇燃料电池(DMFC)的半电池研究证明,甲醇电催化氧化过程要比氧还原慢许多,反应过电位相对较大,因此,阳极反应的电催化剂研发一直是DMFC研究领域的热点之一[1-3]。纳米Pt因其对甲醇电催化氧化的性能优异,被认为是直接甲醇燃料电池最佳阳极材料[4],但是Pt的储量有限、价格昂贵以及对甲醇氧化中间体CO有明显中毒现象,严重阻碍DMFC的商业化进程。近十几年,随着抗碳酸盐化阴离子交换膜技术的突破与发展[5-6],具有优异催化活性、储量丰富、价格便宜、与Pt同属第八族元素的Ni纳米金属逐渐引起了人们更多的研究兴趣[7-9]。
目前,Ni基甲醇电氧化催化剂的研究大多集中于晶态纳米材料,非晶态论述很少[10-12]。对于晶态材料来讲,台阶原子和扭结原子(即不饱和原子)通常是打破反应物分子化学键的催化活性位[13],大块的金属Ni对甲醇氧化并没有显示催化活性[14]。为此,十多年来具有高密度不饱和原子的Ni-B和Ni-P非晶态Ni基纳米材料开始进入甲醇电催化氧化研究者的视野。郑一雄等相继研究了非晶态Ni-B和Ni-Cu-P纳米合金上甲醇和乙醇的电氧化性能,与高度择优取向的镍(220)电极、晶态Ni-Cu合金相比,均显示出更高的催化活性[15-16]。HASSAN et al[17]等采用化学镀法在玻碳电极上制备了Ni-B纳米非晶态颗粒涂层,实验证明Ni-B/C对甲醇和乙醇均具有较好的电催化活性,是Ni-P/C和Pt/C的两倍。相关研究结果表明,在甲醇电催化氧化材料领域非晶态Ni基纳米合金将可能是纳米Pt的替代材料。为了提高非晶态Ni基纳米材料的催化活性,HAMEED et al[18]采用化学镀技术制备了Cu掺杂的非晶态Ni-P-Cu/C电极,TONG et al[19]采用简易的一锅溶剂热法制备了O掺杂的具有可调结构和组成的非晶态Ni-P-O纳米催化剂,研究结果均显示其催化活性较原二元纳米合金高得多。可见,掺杂第三种元素是提高非晶态纳米Ni-B,Ni-P活性的有效手段。本课题组前期研究了Co掺杂的非晶态纳米Ni-B-Co催化性能,研究表明,Co的掺杂明显改变了纳米Ni-B的电子结构,降低了起始反应电位,提高了催化活性[20]。然而,前期的诸多研究重点关注了非晶态纳米Ni基合金活性的提高,对掺杂元素的催化作用机制缺乏系统深入的探讨。
本文分别以与Ni同周期具有不同d电子数的Cr,Cu元素对非晶态纳米Ni-B掺杂,拟通过调节Ni纳米合金电子态改变其催化性能,进而探讨掺杂元素可能的作用机制。为此,采用化学还原法制备了纳米非晶态Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子,循环伏安法等技术考察Ni-B-M电催化氧化甲醇的性能,以期为纳米非晶态镍基材料甲醇电氧化催化剂的研发提供依据。
1 实验
1.1 Ni-B基非晶态纳米粒子的制备
采用化学还原法制备非晶态Ni-B,Ni-B-Cr和 Ni-B-Cu纳米粒子催化剂,硼氢化钾KBH4作为还原剂,聚乙烯吡咯烷酮PVP-k30s作为保护剂。具体步骤为:首先,将4.04 g 氯化镍NiCl2·6H2O和2 g PVP超声溶解在20 mL纯水中,并将其置于0 ℃的冰水浴中。然后,再将5.50 g硼氢化钾和0.96 g氢氧化钠NaOH超声溶解于60 mL纯水中,在强烈搅拌下将其40 mL溶液以1 mL/min的速率逐滴滴加至上面所述氯化镍溶液中。滴加结束后,在冰水浴中继续搅拌直至溶液不再有气泡产生,离心分离产生的黑色沉淀,并分别用纯水和无水乙醇洗涤3次。最后,在真空80 ℃下烘干12 h,得到了Ni-B催化剂样品,研磨备用。制备Ni-B-Cr和 Ni-B-Cu纳米粒子与上述过程相近,所有实验用量均保持不变,差别只在配置氯化镍与PVP混合液时加入0.09 g氯化铬CrCl3·6H2O或0.06 g 氯化铜CuCl2·2H2O.所制备的催化剂可分别记为 Ni-B,Ni-B-Cr和Ni-B-Cu.
1.2 工作电极的制备
工作电极以直径为6 mm的玻碳电极为基底。在每次实验前,电极表面均用Al2O3(0.05 μm)悬浮液抛光至镜面,且用纯水和无水乙醇超声洗涤。将8 mg先前制备的样品、12 mg Vulcan XC-72炭黑(BET:237 m2/g)与125 μL Nafion溶液(质量分数为5%)分散在乙醇(2.5 mL)+纯水(2.5 mL)混合液中,超声分散20 min,然后用移液管移取此悬浮液10 μL涂于干净的玻碳电极表面,红外线灯下烘干,备用。
1.3 Ni-B基非晶态纳米粒子的表征
采用美国TJA公司 Atomscan 16电感耦合等离子体光谱仪(ICP)测定样品中元素比例。采用中国DX-2700型X射线衍射仪(XRD)测定样品的晶相结构,辐射源为Cu Kα(λ=0.154 nm),管电压为40 kV,管电流为30 mA,扫描速率为8 (°)/min,2θ扫描范围为5°~85°.采用FEI公司产的Tecnai G2 F20场发射透射电子显微镜(HRTEM)表征样品的微观形貌,加速电压为200 kV.采用VG Scientific ESCALAB 250Xi型X射线光电子能谱仪(XPS)测定样品表面元素价态,激发源为Al Kα射线(hv=1 486.6 eV),电压为14.8 kV.
电化学测试采用美国PAR公司产的VMP2型多通道恒电位仪。实验装置为三电极体系,铂片和Hg/HgO分别为对电极和参比电极。本文所有电位均相对于Hg/HgO参比电极。所有实验均由超级恒温槽控制在±30 ℃下进行。
2 测试结果与讨论
2.1 Ni-B-M的物理表征结果
Ni-B,Ni-B-Cr和Ni-B-Cu样品原子比数据如表1所示。由数据可知,Ni-B-Cr和Ni-B-Cu样品中,Ni,B原子比相近,Cr/Ni或Cu/Ni摩尔比与前驱体投料比一致,均为0.02.图1为Ni-B,Ni-B-Cr和Ni-B-Cu样品的XRD谱图。可以看到,Ni-B,Ni-B-Cr和Ni-B-Cu样品均在2θ=45°左右出现一宽化的弥散衍射峰,这是元素Ni与类金属元素B非晶态合金的特征衍射峰[21]。另外,图中没有任何Cr,Cu单质或化合物的特征衍射峰,这表明Ni-B-Cr(或Cu)样品为单相Ni-B-Cr (或Cu)非晶态固溶体。同时,由于Ni-B-Cu样品的XRD谱图较Ni-B和Ni-B-Cr更加弥散,可见,Ni-B-Cu样品非晶态结构的无序度较大[22]。
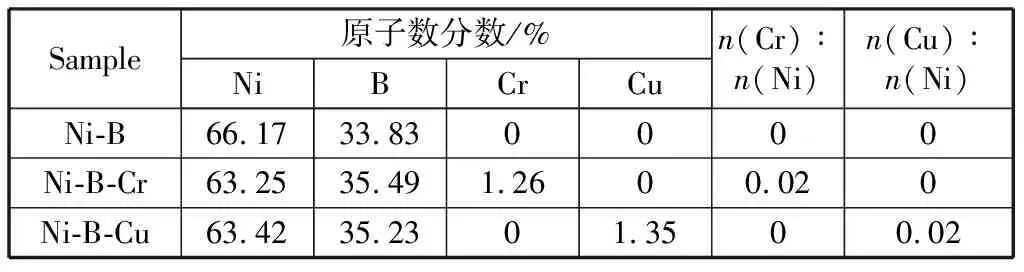
表1 Ni-B和Ni-B-Cr纳米粒子的组成Table 1 Composition of Ni-B and Ni-B-Cr nanoparticles

图1 非晶态Ni-B、Ni-B-Cr和Ni-B-Cu纳米粒子的XRD谱图Fig.1 XRD patterns of Ni-B, Ni-B-Cr, and Ni-B-Cu nanoparticles
Ni-B,Ni-B-Cr和Ni-B-Cu的TEM图像如图2所示。TEM图像显示,Ni-B,Ni-B-Cr和Ni-B-Cu样品均为球形类球形,粒径较为均匀,Ni-B的平均粒径约为13 nm,Ni-B-Cr为8 nm,Ni-B-Cu为9 nm.可见,Cr和Cu元素的掺杂均可减小Ni-B的粒径,粒子细化现象可能是源于掺杂原子的原子半径、成键电子结构及其配位数不同引起的纳米粒子的成核及生长困难。同时,Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子均呈现不同程度的团聚,这可能与巨大的比表面能相关[21]。
图2中插图是选定区域电子衍射(SAED)图,均出现非晶态结构特有的漫射德拜环[23]。可见,进一步证实了Cr和Cu掺杂的Ni-B纳米粒子均为非晶态结构。

图2 Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子的TEM图(插图为选区电子衍射图)Fig.2 TEM of images of Ni-B, Ni-B-Cr, and Ni-B-Cu, respectively (Insets are corresponding SAED patterns)
图3所示为Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子Ni与B的XPS高分辨率图谱,表2为其主要的表面结合能计算值。从图3和表2可知,在非晶态Ni-B和Ni-B-Cu纳米粒子中,元素B均存在金属(B0)和氧化硼B(B3+)两种价态形式,同样,元素Ni也均含有Ni0和氧化态Ni2+两种价态。在B 1s谱图中,Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子B0的结合能依次为187.96,187.98,187.64 eV;在Ni 2p谱图中,Ni0的电子结合能依次为852.49,852.18,852.36 eV.由此可知,B0的结合能在掺杂Cr时变化很小,即Cr与B之间基本不发生明显的电子转移;但Cu的掺杂减小了B的结合能,即表明Cu的d电子转移给了B;同时,Ni0的结合能在掺杂Cr或Cu后,均减小了。由于Cr与Cu的电负性与电子结构不同,其与Ni之间的电子转移存在差异。原子Ni(3d84s2)比原子Cr(3d54s1)有更多的d,可推测[20],元素Ni的一些成键d电子会转移到Cr的3d电子带;但由于Ni的电负性(1.91)要比Cr(1.66)高,Cr的电子云会整体向Ni偏移,因此,Ni-B-Cr纳米粒子中Ni最后所得到的负电荷量相对Ni-B增大了。Ni成键d电子向Cr的转移可能会增大Ni 3d轨道的空缺率。对于Cu来讲,Cu(3d104s1)原子比Ni (3d84s2)原子有更多的成键d电子,Cu元素的一些d电子会转移到Ni的3d电子带;同时,Ni的一些s电子向Cu的s电子带移动。由于Ni的电负性略高于Cu(1.90),因而Ni最后获得的电子比Cu多,电子结合能降低。Cu d电子向Ni的转移可能会降低Ni 3d轨道的空缺率。另外,由图3(c)可见,在Ni-B-Cr纳米粒子表面Cr元素的Ni 2p3/2结合能为577.00 eV,表明Cr元素在Ni-B-Cr纳米粒子表面以单一的Cr3+氧化物形态存在。
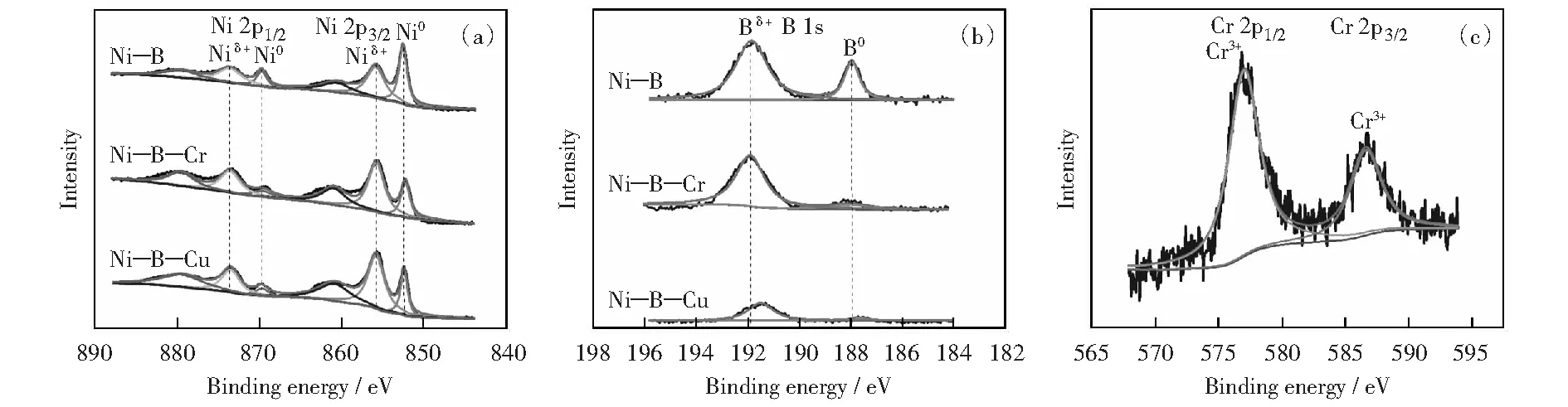
图3 窄谱图(a) B 1s Ni 2p窄谱图(b),Cr 2p窄谱图(c)Fig.3 XPS spectra of Ni 2p (a) and B 1s (b) and Cr 2p (c)
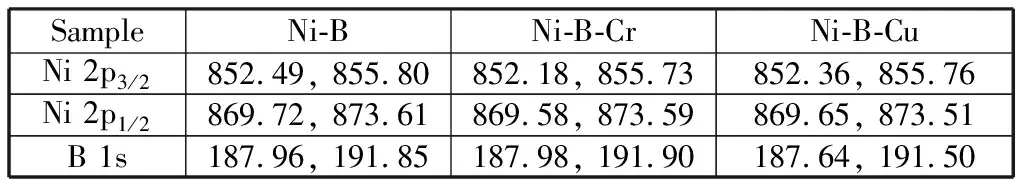
表2 Ni-B,Ni-B-Cr,Ni-B-Cu纳米粒子Ni,B的XPS结合能Table 2 XPS binding energies of nickel and boron with different valencies in Ni-B, Ni-B-Cr and Ni-B-Cu nanoparticles eV
2.2 Ni-B-M的电化学性能表征结果
2.2.1在NaOH电解液中循环伏安测试结果
图4为Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子在1.0 mol/L氢氧化钠电解液中扫描速率为10 mV/s下的循环伏安曲线。由图4可知,在氧气析出之前Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子均存在一对氧化还原峰[24],氧化峰为Ni(OH)2氧化为羟基氧化镍NiOOH的过程,还原峰为相应的还原反应[25-27]。
Ni(OH)2+OH-→NiOOH+H2O+e-.

图4 Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子在1.0 mol/L NaOH溶液中扫速为10 mV/s下的循环伏安曲线Fig.4 Cyclic voltammograms of Ni-B, Ni-B-Cr, and Ni-B-Cu nanoparticles at a potential scan rate of 10 mV/s in 1.0 mol/L NaOH solution
由图4可看到,Ni-B-Cr及Ni-B-Cu纳米粒子上Ni(OH)2氧化峰电流明显高于Ni-B纳米粒子,且氧化峰的半峰宽也较大,这可能与Ni-B-Cr和Ni-B-Cu纳米粒子表面Cr(VI),Cu(III)的存在有关[28]。此外,Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子氧化的起始反应电位基本一致,即Cr、Cu物质的量比为0.02时,对Ni(OH)2氧化的起始电位影响很小。
2.2.2在含甲醇电解液中循环伏安测试结果
图5(a)为Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子在CH3OH(1.0 mol/L)+ NaOH(1.0 mol/L)中的循环伏安曲线。由图可见,Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子上氧化峰电流分别为789.67,748.47,1 143.16 A/g;峰电位分别为0.73,0.77,0.81 V,其中Ni-B-Cu的峰电流最高;Ni-B-Cr的峰电流略低于Ni-B,Cr的掺杂对Ni-B-Cr纳米粒子电催化活性有微弱影响。可见,掺Cu有利于提高Ni-B纳米粒子的催化性能。此外,图5(a)显示3种电催化剂上反应起始电位很接近,表明三者的甲醇电氧化反应机理未有明显不同。图5(b)为3种催化剂甲醇电氧化的Tafel曲线图。可以看到,Ni-B,Ni-B-Cr,Ni-B-Cu纳米粒子在0.55~0.57 V范围塔费尔斜率分别为195.90,214.52,202.16 mV,这表明Cr,Cu掺杂Ni-B后塔费尔斜率略有提高,反应的控制步骤出现一定变化。

图5 Ni-B、Ni-B-Cr和Ni-B-Cu纳米粒子在1.0 mol/L NaOH+1.0 mol/L CH3OH溶液中的循环伏安曲线(a)及在0.55~0.57 V之间的塔菲尔曲线(b)Fig.5 Cyclic voltammograms (a) and corresponding Tafel plots (b) for methanol oxidation on Ni-B, Ni-B-Cr, and Ni-B-Cu nanoparticles in 1.0 mol/L NaOH solution containing 1.0 mol/L methanol at a scan rate of 10 mV/s
2.2.3电化学阻抗谱测试结果
图6是Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子在1.0 mol/L NaOH+1.0 mol/L CH3OH溶液中的电化学阻抗谱图(振幅为5 mV,电位为0.50 V,频率范围100~0.1 kHz),右上为等效电路图。高频半圆与电荷转移电阻(Rct)和双层电容有关;中频和低频半圆与电极表面吸附电阻有关(用Rads表示)。由图可知,相对于Ni-B样品,掺杂Cr样品的高频半圆略有增加,掺杂Cu样品的高频半圆减小。减小的半圆表明,通过掺杂Cu元素Ni-B纳米合金降低了甲醇氧化的电荷转移电阻,提高了甲醇氧化的催化活性。相反,掺杂Cr增大了甲醇氧化的电荷转移电阻,降低了甲醇氧化的催化活性。
根据图6右上等效电路图拟合的各参数见表3。
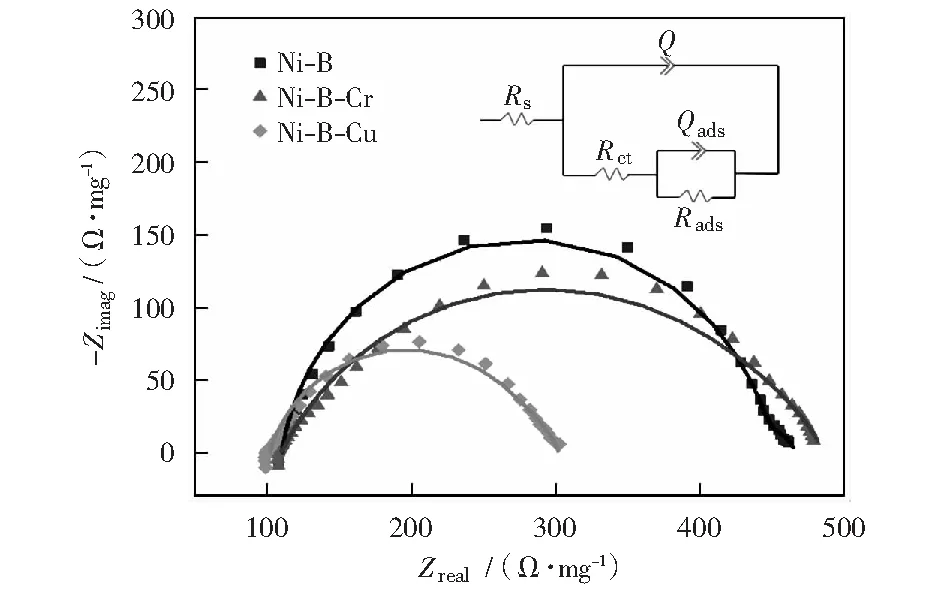
图6 Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子在1.0 mol/L NaOH+1.0 mol/L CH3OH溶液中的电化学阻抗谱曲线(插图为相应的等效电路图)Fig.6 Electrochemical impedance spectroscopy for Ni-B, Ni-B-Cr, and Ni-B-Cu nanoparticles recorded at 0.5 V in 1.0 mol/L NaOH+1.0 mol/L CH3OH solution. Inset is the corresponding electrical equivalent circuit
等效电路由5个元件组成:溶液电阻(Rs)、常相位角元件CPE(Q)、电荷转移电阻(Rct)、表面吸附电阻(Rads)、吸附过程的电容(Qads).CPE(Q)代表的是电极与溶液之间界面的双层电容(Cdl),表示与理想电容理想行为的偏差[20,29]。CPE的阻抗定义如下:
ZCPE=[Y0(jw)n]-1.
式中:Y0是与表面电活性相关的常数,w是径向频率,指数n来源于lgZ对lgf的斜率,其值为-1≤n≤1.若n=0,则CPE表现为纯电阻;若n=1,则CPE表现为纯电容。
从表3中可以看出,Ni-B纳米合金掺杂Cr后,甲醇氧化的电荷转移电阻Rct增大,表面吸附电阻Rads减小;掺杂Cu元素后,甲醇氧化的电荷转移电阻Rct和表面吸附电阻Rads均减小。可见,Cu促进了Ni-B-Cu纳米粒子上甲醇电氧化吸附过程的动力学,提高了Ni-B-Cu纳米粒子的催化活性。
2.2.4计时电流法测试结果
图7是Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子在1.0 mol/L NaOH+1.0 mol/L CH3OH溶液中对甲醇电催化氧化的计时电流曲线(CA)(电位0.7 V,持续时间3 600 s).由图7可得,Ni-B,Ni-B-Cu和Ni-B-Cr纳米粒子上极化电流在最初均迅速降低,接着电流小幅上升,再后电流进入缓慢衰减阶段,此时甲醇电氧化处于准稳态,其中Ni-B-Cu的极化电流明显高于Ni-B,Ni-B-Cr的极化电流,不过Ni-B-Cr的极化电流在衰减阶段衰减幅度要明显小于前两者,可见,掺杂Cr元素提高了Ni-B纳米粒子的活性稳定性。

表3 根据Fig.6拟合的电化学阻抗谱参数Table 3 Fitting parameters of electrochemical impedance spectroscopy according to the equivalent circuit shown in Fig.6

图7 Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子在1.0 mol/L NaOH+1.0 mol/L CH3OH溶液中的计时电流曲线(插图为准稳态时的放大图)Fig.7 Chronoamperometry curves for methanol oxidation on Ni-B, Ni-B-Cr and Ni-B-Cu nanoparticles in 1.0 mol/L NaOH+1.0 mol/L CH3OH solution at 0.7 V. Inset is the enlarged view at quasi-steady states
3 讨论
综合上述实验结果可得,影响非晶态Ni-B-M纳米粒子催化活性的一个重要因素是掺杂元素M对Ni元素的电子效应,有文献报道,当Ni的成键d电子转移给M的d带时,可增大Ni 3d轨道的空缺率,增强Ni 3d轨道对甲醇和吸附态反应中间体的吸附能力,有利于甲醇的吸附动力学。在本研究中,掺杂元素分别选择了Cr,Cu,前者Ni的成键d电子转移给Cr 3d带,增大了Ni 3d轨道的空缺率,后者Ni 3d带接收Cu的成键d电子,减小了Ni 3d轨道的空缺率,也就是说,掺杂Cr元素提高了Ni活性位对甲醇的吸附能力,掺杂Cu元素降低了Ni活性位对甲醇的吸附能力。电化学阻抗实验结果证明了掺杂Cr元素降低了Ni-B对甲醇的吸附阻抗。但Ni-B-Cr的催化活性并未因甲醇吸附能力提高而提高,反而由于吸附态甲醇较高的稳定性,导致脱氢氧化后续步骤(电荷转移)阻力的增大,催化活性不及Ni-B.另外,Ni-B-Cr表面Cr(Ⅵ)铬酸盐钝化膜[30]的存在可能会覆盖部分活性位点,这应该也是Ni-B-Cr活性低的因素之一。不过,可能是由于Cr(Ⅵ)铬酸盐钝化膜的存在防止了表面Ni原子的溶解损失,其活性稳定性有了提高。
掺杂Cu元素不利于Ni活性位对甲醇的吸附,但表面Cu(Ⅲ) 以CuOOH和CuOO·H形式存在[31-32],其与NiOOH作用相同,是吸附态甲醇脱氢氧化的活性物质,Cu活性中心作用机制如下:
Cu(Ⅱ)+OH-→Cu(Ⅲ)+e-.
Cu(Ⅲ)+CH3OHads+OH-→Cu(Ⅱ)+CO2+H2O .
Cu和Ni活性中心共同起到吸附甲醇和吸附态甲醇脱氢氧化作用,提高了Ni-B-Cu甲醇吸附能力,降低了电荷转移阻力,提高了催化活性。
4 结论
通过化学还原法可以成功制备Ni-B,Ni-B-Cr和Ni-B-Cu纳米粒子;纳米粒子均呈类球形,掺杂Cr和Cu元素可减小Ni-B粒径;掺杂Cr能够引起Ni成键d电子向Cr 3d转移的电子效应,增强Ni活性中心对甲醇的吸附能力;相反,掺杂Cu能够引起Cu成键d电子向Ni 3d转移的电子效应。Ni-B-Cu纳米粒子对甲醇电氧化具有更佳的催化活性, Ni-B-Cr具有较高的活性稳定性。相关研究结论将为提高非晶态Ni-B纳米粒子催化活性提供指导。

