氧化镁蒸氨反应的动力学和机理研究
丁 珂 ,孙晓君 ,李会杰 ,黄娜娜 ,仇 龙 ,刘云义 ,2,李 雪 ,2
(1.沈阳化工大学化学工程学院,辽宁省化工应用重点实验室,辽宁沈阳110142;2.辽宁精细化工协同创新中心)
氢氧化镁是一种重要的无机化学材料,在高分子材料的阻燃、废水废气的处理等方面具有广泛的用途[1-3]。同时,中国具有丰富的镁系资源,物理粉碎法和直接水化法是制备氢氧化镁的常见方法,然而当菱镁矿品位较低时,这2种方法制备得到的氢氧化镁均不符合行业标准[4-6]。因此对于低品位的镁矿资源一般在750~1100℃下煅烧,得到轻烧粉(主要成分为MgO),将轻烧粉和铵盐等物质反应,制备得到镁盐溶液,再和沉淀剂反应制备氢氧化镁产品[7-9]。氧化镁水化“溶解-沉淀”机理得到广泛认同[10-15]。但对轻烧粉/氧化镁和铵盐反应过程及其机理鲜有报道。
本文以轻烧粉为原料,和氯化铵进行蒸氨反应,探讨了镁离子浓度与反应时间和温度的关系,并对反应所得滤渣做了分析。以氢氧化镁(纯度>99%)煅烧制备的氧化镁为原料,探究了氧化镁水化反应动力学和蒸氨反应机理,以期为相关蒸氨实验和工艺提供理论和数据参考。
1 实验
1.1 实验原料与仪器
轻烧粉,氢氧化镁 (纯度>99%),四口烧瓶,KBF1200X型马弗炉,DF-101S型集热式恒温搅拌水浴锅。
1.2 实验方法
取一定比例轻烧粉和氯化铵固体,在500 mL体系中搅拌混合均匀,用恒温油浴锅控制反应温度。将反应液进行过滤、洗涤、干燥,反应所得滤液中镁离子浓度用乙二胺四乙酸(EDTA,0.05 mol/L)标准溶液滴定。滤渣置于马弗炉中在900℃下煅烧2 h,测定滤渣的质量变化率(%)。
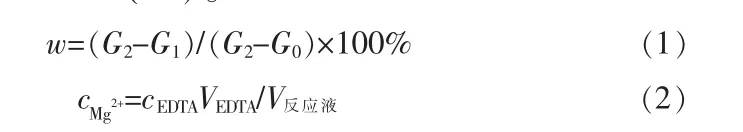
式中:G2-G1和G2-G0分别为煅烧前后样品质量。
取一定量实验室自制氢氧化镁(纯度>99%)在600、700、800℃下煅烧4 h,使氢氧化镁完全转化为氧化镁。
1.3 分析测试仪器
采用D8型X射线衍射仪(XRD)测定样品的晶体结构,Cu靶,Kα射线,管电压为40 kV,管电流为40 mA;步长为 0.05(°)/s,扫描范围为 10~80°。
反应后所得滤渣使用WSB-2型白度计测定白度。样品测试前,在样品表面进行离子溅射喷金,以增加其导电性能,再将样品直接固定在导电胶带上。采用JSM-6360 LV型扫描电镜,测定样品的表面形貌。
2 实验结果与讨论
2.1 轻烧粉蒸氨反应
轻烧粉与NH4Cl物质的量比为1∶2,在不同反应温度、反应时间DE条件下做蒸氨反应。测定所得溶液中 Mg2+、NH4+的浓度,结果见图 1~2。 由图 1~2 可知,随着蒸氨反应的进行,溶液中镁离子浓度不断增加。常压条件下,蒸氨反应温度越高,越有利于蒸氨反应的进行。当反应120 min,70~90℃时,溶液中镁离子浓度约为0.37 mol/L;100℃时镁离子浓度为0.834mol/L。100℃时,当蒸氨反应进行到20 min时,镁离子浓度迅速达到了0.5374mol/L,此时活性氧化镁浸出率为51.67%;随着反应的继续,镁离子的浸出率显著提高;反应时间为200 min后,镁离子的浓度为0.9818 mol/L,活性氧化镁浸出率为94.41%;当反应时间为240 min,Mg2+的浓度为0.9843 mol/L,活性氧化镁浸出率为94.64%,由此可见反应时间为200min时,继续延长反应时间对轻烧粉中Mg2+的浸出率影响不大。这可能是因为反应初始溶液中的Mg2+浓度低和NH4+浓度高,促使反应不断向Mg2+浓度增高和NH4+浓度降低的方向进行,当反应200 min时,溶液中的Mg2+和NH4+浓度达到动态平衡,活性氧化镁浸出率变化不大。
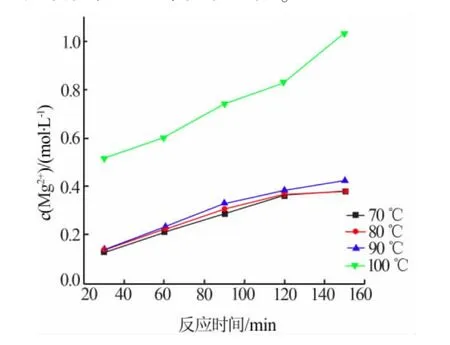
图1 反应温度和时间对Mg2+浓度的影响
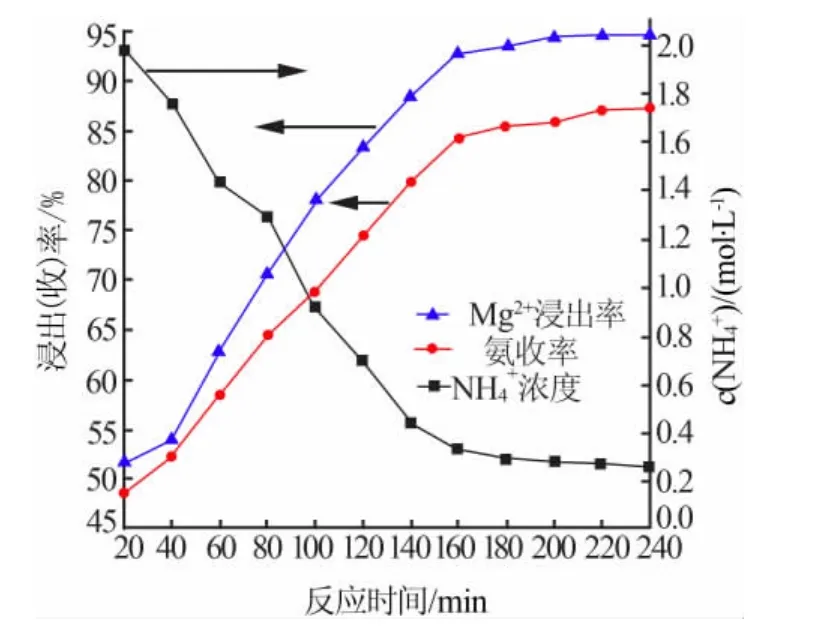
图2 轻烧粉蒸氨反应数据图
图3为轻烧氧化镁反应所得滤渣照片。由图3可见,轻烧粉和氯化铵蒸氨反应后所得滤渣在900℃下煅烧2 h,得到图3c样品;轻烧粉和稀盐酸反应后所得滤渣如图3d所示。分别对这2组样品做XRD表征,结果见图4。
由图3可知,轻烧粉的白度为83.5,蒸氨所得滤渣的白度为85.5;滤渣在900℃下煅烧得到的样品白度为82.2;轻烧粉与盐酸反应所得滤渣白度为36.7。这是因为在蒸氨反应过程中轻烧粉中的氧化镁反应生成镁离子,反应剩余物氢氧化镁的密度逐渐减小,杂质含量相对少,导致白度下降。由图4可知,残渣的主要组分为Mg2SiO4。

图3 轻烧氧化镁反应所得滤渣照片
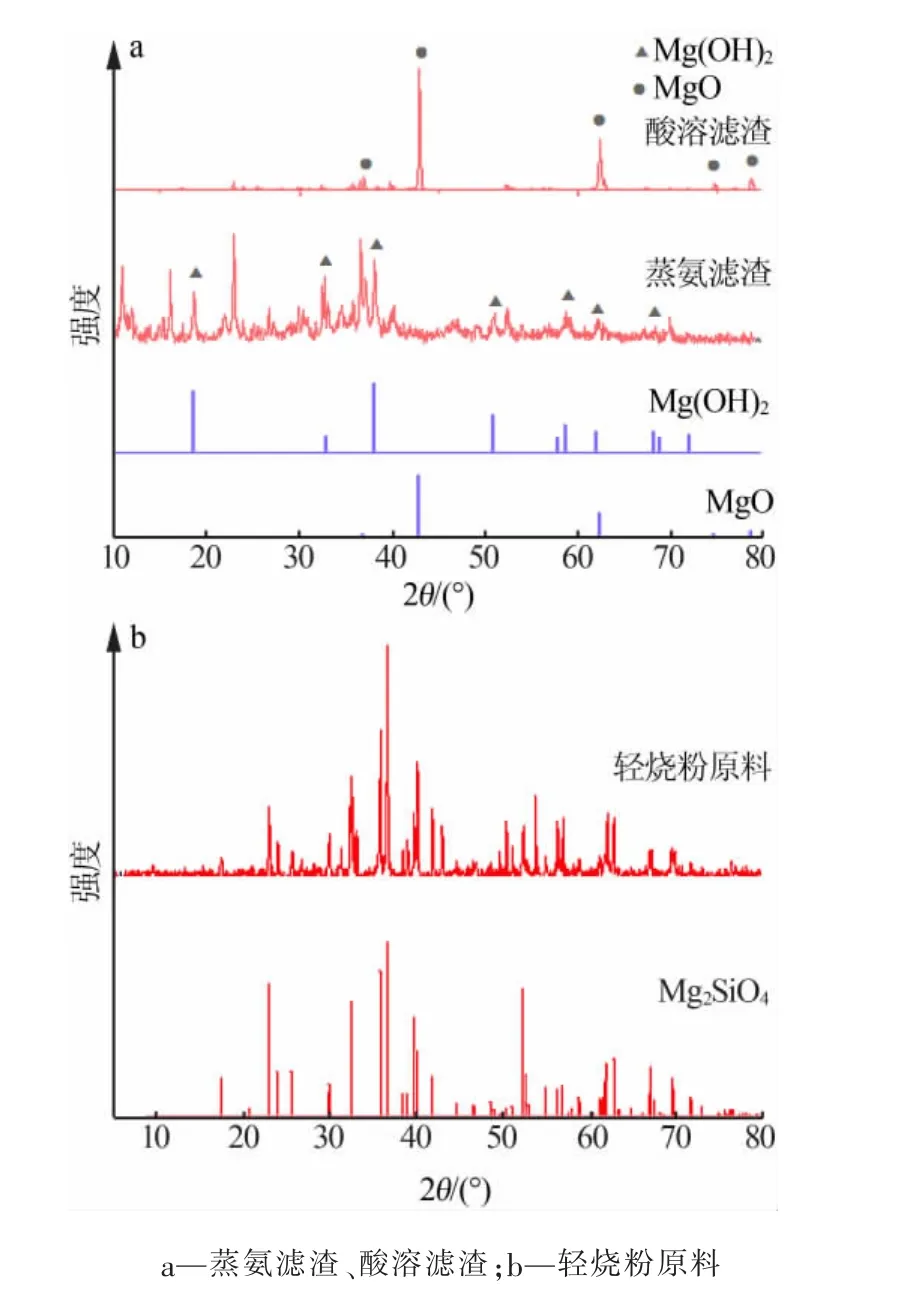
图4 轻烧氧化镁反应所得滤渣的XRD谱图
对于蒸氨反应而言,反应剩余物中不存在氧化镁,而存在氢氧化镁。即氧化镁和氯化铵反应过程中未生成Mg2+的氧化镁,反应生成了氢氧化镁。
2.2 氧化镁水化反应
取600、700、800℃下煅烧氢氧化镁(纯度>98%)得到的氧化镁 20 g,与 500 mL水分别在 20、40、60℃下进行水化反应。结果见图5。
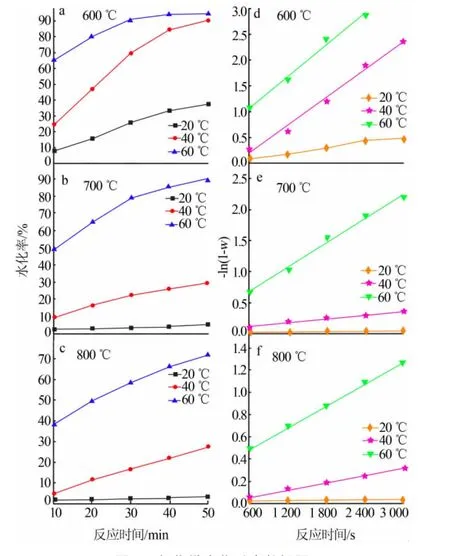
图5 氧化镁水化反应数据图
采用试差法将图5a~5c的实验结果代入各级反应速率方程。由试差法可得:氧化镁水化数据{t,w}分别作-ln(1-w)~t图得到其线性关系图和速率方程(图5d~5f),速率常数通过回归直线的斜率得到,其水化动力学方程:

式中,w为氧化镁水化率,%;k为反应速率常数,t为水化反应时间。

表1 氧化镁水化速率常数
将表 1 所得数据{1/T ,ln k},做 ln k~1/T 图(图5d~5f),依据 Arrhenius方程的不定积分公式:

通过拟合得到直线的斜率,可以求出不同煅烧温度所得氧化镁的水化反应活化能。结果见表2。由表2可知,不同煅烧温度制备的氧化镁的反应活化能不同,随着煅烧温度的升高氧化镁水化反应活化能升高;轻烧粉蒸氨反应中,升高蒸氨反应温度,有利于氧化镁的水化和提高反应速率。同时,根据Bebson关于化学反应和扩散控速的活化能判断依据:E扩散<25.12 kJ/mol<E化学[8],由表 2 可知,氧化镁水化反应属于化学反应控速机理。

表2 氧化镁水化反应活化能
2.3 氧化镁蒸氨反应
以氢氧化镁600℃煅烧制备的氧化镁为原料,对改变反应时间所得蒸氨反应剩余物做了表征。结果见图6。由图6可知,随着蒸氨反应的进行,六方片状晶体结构遭到破坏变成微小颗粒状晶体。这是因为氧化镁蒸氨反应遵循氧化镁水化反应机理中的“溶解”机理。同时,由图6f的XRD表征可得,当蒸氨反应进行30 min时,溶液中氧化镁全部被水化成氢氧化镁。
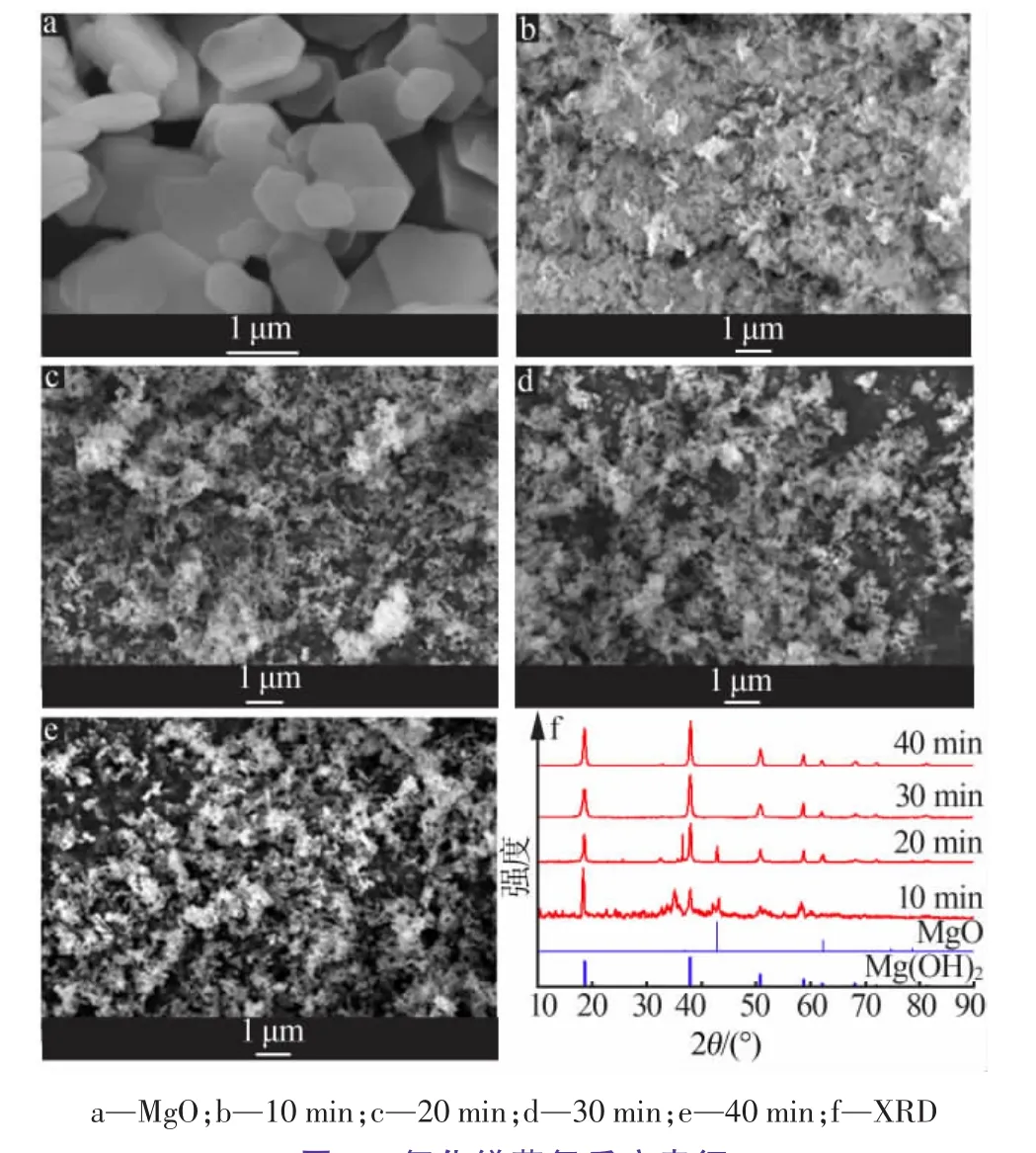
图6 氧化镁蒸氨反应表征
不同煅烧温度制备的氧化镁,按 n(MgO)∶n(NH4Cl)=1∶2.2 配置成 500 mL 溶液在 100℃下进行蒸氨反应,结果见图7。由图7可知,不同煅烧温度制备的氧化镁进行蒸氨反应时,0~30 min生成镁离子的速率有明显差异;30 min之后溶液中镁离子生成速率大致相同。
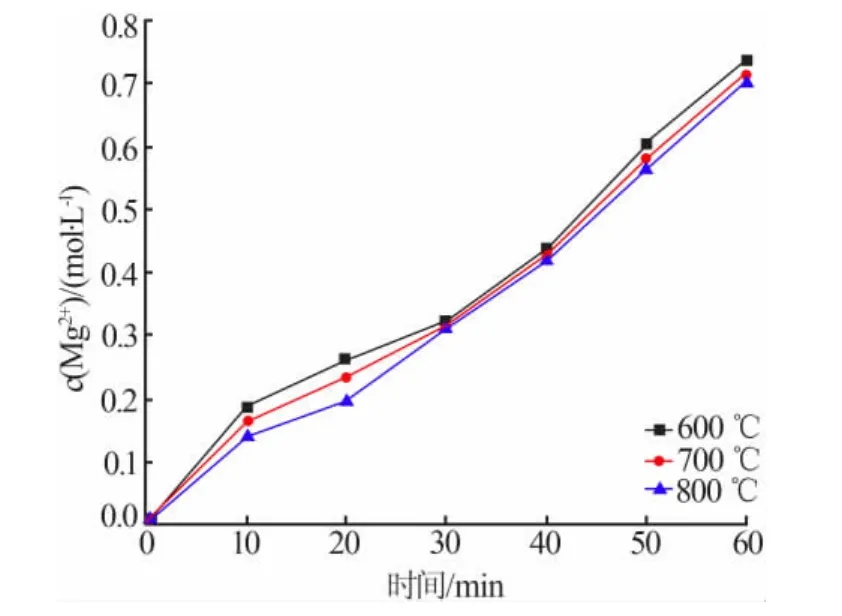
图7 氧化镁蒸氨反应速率图
将氧化镁和氢氧化镁按相同的物质的量比和氯化铵做蒸氨反应,再将氧化镁和氢氧化镁按照一定物质的量比混合后和氯化铵做蒸氨反应,结果见图8。由图8可知,在蒸氨反应0~20 min时,氢氧化镁的镁离子浸出速率明显高于氧化镁的浸出速率。20~90 min两者的镁离子浓度差值逐渐减小,90 min后镁离子增长速率基本一致。这与氧化镁蒸氨反应中氧化镁的水化趋势相符。
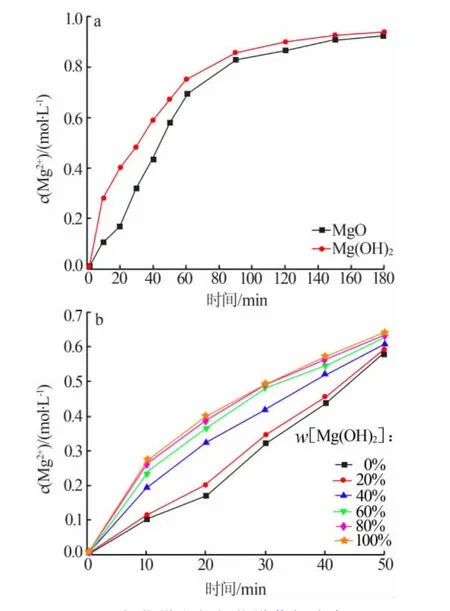
图8 氧化镁和氢氧化镁蒸氨速率图
综上所述可以得出,氧化镁和氯化铵进行反应可分为2个阶段:第一阶段,其蒸氨速率较氢氧化镁慢,主要是由于大部分氧化镁在铵盐溶液中进行水化反应生成氢氧化镁[15],同时,溶液中的少量氧化镁和反应生成的氢氧化镁同时做蒸氨反应:
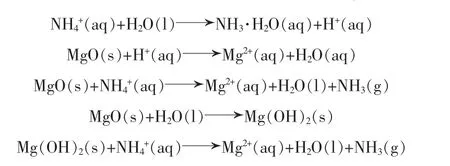
当30 min之后,氧化镁被完全水化成氢氧化镁,蒸氨反应进入第二阶段:整个反应体系变为氢氧化镁蒸氨体系:
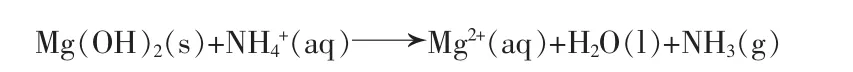
同时,氨气在水中的溶解度随温度的升高降低明显,范天博等[16]根据实验数据关联得到氨气在水中的溶解度公式:
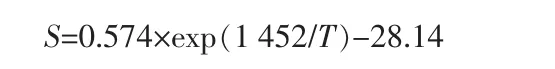
根据公式可以计算,当蒸氨反应温度为100℃时,氨气在水中溶解度<0.5%。即蒸氨反应温度越高越有利于氧化镁的水化,同时有利于氨气的挥发,促使整个蒸氨体系正向进行。
3 结论
1)轻烧粉蒸氨反应中,温度对镁离子浓度影响大。当反应2 h时,70~90℃溶液中镁离子浓度约为0.37 mol/L,100℃时浓度为0.834 mol/L。蒸氨所得滤渣通过XRD分析可知,部分氧化镁变成氢氧化镁存在于残渣中。
2)对不同煅烧温度制备的氧化镁进行水化反应动力学分析可知:氧化镁水化反应符合一级反应动力学;随着煅烧温度的升高,氧化镁水化反应活化能逐渐增加。当煅烧温度为600℃时,反应活化能为64.7899 kJ/mol;当煅烧温度为800℃时,反应活化能为81.3506 kJ/mol;水化反应属于化学反应控速机理。
3)不同煅烧温度的氧化镁进行蒸氨反应,在反应前期(0~30 min),溶液中 Mg2+浓度差异较大;蒸氨反应速率随体系中氢氧化镁含量的增加而升高。氧化镁蒸氨体系可分为2个阶段:第一阶段,大量氧化镁在铵盐体系中进行水化反应生成氢氧化镁,同时部分氧化镁和氢氧化镁进行蒸氨反应生成镁离子;第二阶段,整个体系完全变成氢氧化镁蒸氨体系。

