三黄清胃丸治疗幽门螺旋杆菌相关性胃炎主要活性成分及潜在靶点的网络药理学分析
林道斌, 杨华, 程亚伟, 张达坤, 杨永和, 蔡媛媛, 舒盼, 谢红丹
(广州中医药大学附属海南省中医院脾胃肝病科,海南海口570000)
自20世纪80年代Marshall和Warren成功从胃黏膜中分离出幽门螺旋杆菌(Helicobacter pylori,HP)以来,因HP引起的慢性胃炎受到了越来越多学者们的关注,针对HP的抗菌方案也不断发生变化。目前,根据美国胃肠病学院(American College of Gastroenterology,ACG)发布的最新临床指南[1],西药抗菌的一线方案电抗生素及质子泵抑制剂(PPI)组成。但药物的副作用和细菌耐药性日益凸显,因此,寻找安全、副作用少的新的治疗方法十分必要。
海南省中医院脾胃肝病科杨永和主任医师根据自身数十年临床经验,并结合全国名老中医罗凌介的学术思想研制的三黄清胃丸[2]对幽门螺旋杆菌相关性胃炎(helicobacter pylori-associated gastritis,HAG)的治疗表现了良好的效果,其治疗后复发率和副作用远远低于西药治疗方案。虽然通过临床观察试验已经明确了三黄清胃丸的临床疗效,但关于其药物的主要成分及作用机制仍不明确,而通过网络药理学[3]方法对三黄清胃丸进行整体研究,不但有利于下一步深入进行实验研究,也有利于该药的推广和应用,现将研究结果报道如下。
1 材料与方法
1.1 三黄清胃丸有效成分的筛选 本研究通过中药系统药理学分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)检索三黄清胃丸组成药物半夏、黄连、黄芩、干姜、甘草、人参、大黄的所有活性成分。再根据口服利用度(OB)≥30%和类药性(DL)≥0.18进一步筛选药物的主要活性成分。OB和DL是评判药物有效利用度的关键指标,一般而言OB≥30%、DL≥0.18的活性成分可视为药物的主要活性成分[4]。
1.2 药物作用靶点的筛选 将“1.1”项获得的药物成分化学结构的mol2格式文件反向分子对接服务器(DRAR-CPI)(http://cpi.bio-x.cn/drar/)数据库[5],根据对接分数(Z-score)<-1筛选靶点蛋白PDB ID,并导入Uniprot(https://www.uniprot.org/)数据库[6]获取靶点基因。
1.3 疾病相关靶点的获取和三黄清胃丸治疗HAG潜在靶点筛选 在GeneCards数据库(https://www.genecards.org/)[7]中以幽门螺旋杆菌相关性胃炎的英文关键词“helicobacterpylori associated gastritis”或“helicobacterpylori related gastritis”作为关键词,搜索HAG的疾病相关靶点并建立数据集,再与“1.2”项所得的药物作用靶点进行Venn分析,将两者交集靶点作为三黄清胃丸治疗HAG的直接作用靶点。为了更加直观地分析药物的作用机制,将药物活性成分与核心靶点输入Cytoscape 3.6.1软件构建活性成分—潜在靶点网络关系图,并根据网络节点的相关拓扑参数作进一步分析。
1.4 基因本体论(GO)功能注释及京都基因与基因组百科全书(KEGG)通路富集分析 最后再将筛选出的三黄清胃丸治疗HAG的潜在靶点导入DAVID在线工具(https://david.ncifcrf.gov/)进行GO、KEGG功能注释和富集分析。
2 结果
2.1 三黄清胃丸有效成分及药物靶点的筛选结果 通过TCMSP数据库分别检索相关药物,并按OB≥30%和DL≥0.18作为条件共获得174种活性成分,研究过程中我们发现有9种活性成分为多个药物共有成分,为使统计结果准确,我们将其单独归为一类,分别是黄芩、半夏共有的黄芩素(baicalein),半夏、人参、黄芩、干姜、大黄共有的β-谷甾醇(beta-sitosterol),黄芩、黄连共有的黄连碱(coptisine),人参、黄芩共有的Diop,黄连、黄芩共有的表小檗碱(epiberberine),人参、甘草共有的山柰酚(kaempferol),黄连、甘草共有的槲皮素(quercetin),黄芩、干姜、甘草共有的谷甾醇(sitosterol),半夏、人参、黄芩共有的豆甾醇(stigmasterol)。其余药物活性成分筛选结果为甘草85种、黄芩24种、人参13种、半夏9种、大黄9种、黄连8种、干姜3种。药物靶点通过DRARCPI平台共检索到2 499个,去重保留唯一值后有341个。
2.2 疾病相关靶点及三黄清胃丸治疗HAG潜在靶点筛选结果 通过GeneCards数据库检索到707个HAG疾病相关靶点,与“1.2”项获取的药物作用靶点进行Venn分析后,得到交集靶点94个,这94个靶点可视为三黄清胃丸治疗HAG潜在靶点。见图1。
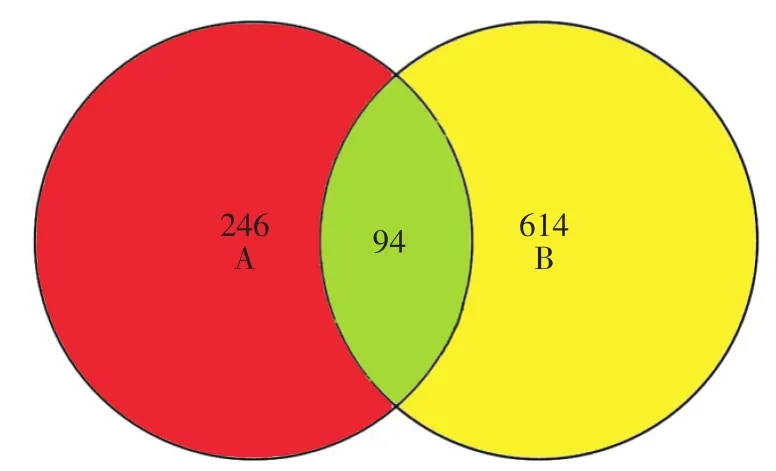
图1 药物靶点与HAG疾病靶点韦恩分析图Figure 1 The Venn diagram ofdrug targets and HAG disease-related targets
2.3 活性成分—潜在靶点网络关系图 将药物活性成分与潜在靶点输入Cytoscape 3.6.1软件后,建立了一个各个节点联系密切的网络关系图,见图2。在该图中活性成分节点有140个,靶点节点94个。图中,红色节点代表靶点,紫色节点代表甘草活性成分,淡蓝色节点代表黄芩活性成分,浅绿色代表共有活性成分,深绿色代表人参活性成分,紫红色代表半夏活性成分,淡红色代表黄连活性成分,黄色代表大黄活性成分,深蓝色节点代表干姜活性成分。本研究还运用Cytoscape 3.6.1软件中的Network Analysis-Analyze Network插件对该网络图中的每个节点进行分析,得到网络中各个节点的度值(Degree)。Degree在活性成分节点表示该活性成分所对应的靶点个数,在靶点节点表示能与该靶点发生作用的活性成分个数,这意味着Degree值越大,在三黄清胃丸治疗HAG的过程中所发挥的作用也越大。

图2 活性成分—靶点相互作用网络关系图(节点大小与Degree成正比)Figure 2 Active component-target interaction networks(Node size is in directproportion to Degree)
通过分析结果我们得出,平均每个活性成分能作用于5个靶点,有30%的活性成分作用靶点高于均值,可视为三黄清胃丸治疗HAG的关键活性成分,而Degree最高的前5种活性成分分别为槲皮素68个、山柰酚22个、汉黄芩素(wogonin)20个、黄芩素14个、芦荟泻素(aloe-emodin)12个。在靶点方面,平均每个靶点能与8种活性成分联系,有12%的靶点高于均值,这也意味者这些靶点可能是三黄清胃丸治疗HAG的关键靶点,其中前5个靶点前列腺素G/H合酶2(PTGS2)对应了133种活性成分,前列腺素G/H合酶1(PTGS1)和一氧化氮合酶2(NOS2)都对应了87种,过氧化物酶体增殖因子活化受体γ(PPARG)对应了70种,糖原合成酶激酶3β(GSK3B)对应了59种。表1、2分别列举了高于Degree均值的靶点、活性成分。

表1 在活性成分—靶点网络中高于靶点均值的基因Table 1 Genes above the targetmean value in active com ponent-targetnetworks

表2 活性成分—靶点网络中的活性成分关键节点拓扑学性质及其来源Table 2 Topologicalproperties and origin of key nodes ofactive com ponents in com ponent-targetnetworks
2.4 GO功能注释及KEGG通路富集分析结果 利用DAVID平台的GO和KEGG通路富集分析功能对94个靶点进行研究,GO富集分析中根据错误发现率(FDR)<0.01确定了350个条目,其中涉及生物过程的有288条,如凋亡过程的负调控、对药物反应、对乙醇反应等。涉及细胞组成的有26条,如细胞外间隙、细胞质基质、线粒体。涉及分子功能的有36条,如酶结合、蛋白结合、蛋白激酶结合等。同时根据FDR<0.01还找到了89条信号通路,根据FDR由小到大排名前10的有癌症通路、乙型肝炎通路、肿瘤坏死因子(TNF)信号通路、膀胱癌通路、弓形体病通路、南美锥虫病通路、直肠癌通路、胰腺癌通路、前列腺癌通路、Nod样受体(NOD)受体信号通路。表3、4,图3、4根据FDR<0.01分别列出了前20条GO条目、KEGG通路。
3 讨论
本研究通过网络药理学方法对海南省中医院院内制剂三黄清胃丸治疗HAG的主要活性成分及潜在靶点进行了研究。研究发现,前5种作用靶点最多的活性成分中,共有化合物槲皮素的作用靶点最多,能通过抗炎[8]、抑制HP[8]、抗细胞氧化[9]等途径发挥治疗作用。另一共有成分山柰酚,也具有类似的抗炎[10]及抑制HP[11]作用。汉黄芩素能通过调节花生四烯酸的代谢,减少细胞凋亡,减轻胃黏膜炎症反应[12]。黄芩素是黄芩的主要活性成分之一,不但具有较强的清除氧自由基,抗氧化、减少促炎因子释放,降低炎症反应的作用[13],而且是目前最为人所熟知的抗HP的中药活性成分之一,其抗HP的机理可能与减轻细菌毒力和抑制细菌繁殖有关[14]。有研究[15]表明芦荟泻素可以通过抑制HP中的乙酰转移酶的活性,进而抑制HP的生长。
除此之外,我们通过三黄清胃丸的活性成分—靶点网络中还发现了94个三黄清胃丸治疗HAG的直接作用靶点,其中有12个靶点的Degree高于均值,包括PTGS2、PTGS1和NOS2等。前列腺素G/H合酶又称环氧化酶(COX),PTGS2和PTGS1属于环氧化酶的2种同工酶,两者在功能上既有差别又有联系,共同参与机体稳态和炎症的前列腺素合成[16]。其中COX1是固有型酶,广泛存在于胃肠道和肾脏,促进生理性前列腺素(PG)的生成[17],对消化道黏膜起着保护作用。COX2是诱导型酶,在正常组织中活性极低,但在炎症的刺激下其表达水平可上调,并依赖其环氧化活性和过氧化活性,将花生四烯酸在各种刺激因子的作用下释放的磷脂酶A2转化为前列腺素的中间代谢产物前列腺素G2(PGG2)和前列腺素H2(PGH2),再在其他前列腺素合成酶的作用下产生具有生物活性的前列腺素[18],导致疼痛和炎症反应。因此,多种成分对环氧化酶的共同调控对整个HAG治疗过程有着重要意义。

表3 94个潜在靶点的GO分析结果(FDR<0.01)Table 3 GO enrichment results for 94 Drug targets(FDR<0.01)

表4 94个潜在靶点的KEGG分析结果(FDR<0.01)Table 4 KEGG pathways enrichment results for 94 potentialDrug targets(FDR<0.01)

图3 94个潜在靶点的GO分析结果条形图(FDR<0.01)Figure 3 Bar chartofGO enrichment results for 94 potentialDrug targets(FDR<0.01)

图4 94个潜在靶点的KEGG分析结果气泡图(FDR<0.01)Figure 4 Bubble chartofpathways enrichment results for 94 potentialdrug targetgenes(FDR<0.01)
NOS2和一氧化氮合酶3(NOS3)分别是一氧化氮合酶(NOS)的诱导型和内皮型酶。正常生理情况下,低浓度的NOS对胃黏膜的黏液分泌和血液循环有着积极作用[19],但在病理状况下如HP的刺激会使NOS的表达水平升高[20],使一氧化氮(NO)与氧产生大量氧代谢产物,这些产物与蛋白质、核酸等结合后会对机体的组织细胞产生毒性,降低胃黏膜屏障功能[21]。特别是在HP感染的条件下,胃黏膜中的氧化和硝酸基程度较高,与过量NO结合后会产生强致癌物质亚硝胺,对HAG的演变造成不良影响[22]。因此,对NOS3和NOS2的调控可能是三黄清胃丸治疗HAG的一个重要途径。
过氧化物酶体增殖物激活受体(PPARG)是一类由配体激活的转录因子,目前已发现有3种亚型PPARα、PPARβ、PPARγ等[23]。其中由PPARG编码的PPARγ不但对HP感染的胃黏膜表现出抗炎和细胞保护作用[24],而且因为能够抑制细胞异常增殖和促进癌细胞凋亡的作用成为了目前肿瘤研究的热点[25]。而其抗肿瘤的一项重要机制与B淋巴细胞瘤2(BDL2)密切相关,有报道[26]称,PPARγ能抑制BCL2的过度表达诱导胃癌MGC803细胞凋亡。另一靶点GSK3B在HP感染时,HP的主要毒性因子CagA与GSK3B基因结合使不可溶部分增加,降低其活性,并且可通过消耗GSK3B诱导上皮细胞—间充质转化(EMT),整个过程不仅会产生急慢性炎症,还会导致癌症的发生[27]。而根据KEGG富集分析结果,癌症通路富集基因最多,据此可以推测三黄清胃丸可在一定程度上对HAG的癌变有干预作用。
MAPK14是丝裂原蛋白激酶14,又称为P38α。HP的类脂多糖可诱导P38α的活化[28],从而介导炎症因子的释放产生炎症反应。所以抑制P38α的活化可能是三黄清胃丸对HAG治疗的一个重要方面,而且已有研究[29]表明,P38是人参皂苷降低炎症反应的一个重要靶点,通过抑制P38α及其他炎症因子的活性发挥作用。
毒蕈碱型乙酰胆碱受体M3(CHRM3)广泛分布于中枢和外周神经系统,控制着平滑肌收缩及腺体组织的分泌功能[30],在刺激状态下特别是胆汁酸等因素的作用下,会促进胃蛋白酶原和胃酸的分泌,进一步加剧胃黏膜的损害[31,32]。5-羟色胺(5-HT)转移蛋白基因(SLC6A4)蛋白是一种膜传递蛋白,其对胃肠道的作用主要通过该基因编码的5-HT转运体(SERT)实现,SERT的生理作用是将发挥功效后的5-HT再摄取进行灭活[33],若SERT的表达量及活性降低,则会引起胃肠道内游离5-HT增多,5-HT及其亚型可增强胃肠道的功能运动[34]。而胃肠活动对消化道慢性炎症有一定的改善。所以可以推测三黄清胃丸主要成分对于SLC6A4的调节作用可能类似于5-HT再摄取抑制剂的作用。半胱氨酸蛋白酶3(CASP3)是含半胱氨酸的天冬氨酸蛋白水解酶的一种亚族,起着细胞凋亡执行者的作用[35]。在HAG疾病过程中胃上皮细胞凋亡是胃黏膜损伤的一个重要标志[36,37],其方式之一便是HP上调CASP3的表达,下调粘钙蛋白E的表达通过线粒体途径诱导凋亡[38]。所以作用于CASP3靶点暗示着抗细胞凋亡也是三黄清胃丸疗效的一个重要方面。CA2是碳酸酐酶(CA)的14种形式之一,CA是一种含锌金属酶,在机体内对二氧化碳和水转化为碳酸氢盐起着催化作用,并对胃中盐酸的分泌起作用[39]。而提高胃内pH值可提高根除HP的效果[40],所以相关成分作用于CA2靶点可能是通过调节胃内酸碱环境配合其他成分对HP的灭活。
另外,本研究还对94个治疗靶点做了KEGG通路富集分析。根据FDR<0.01确定了89条作用通路,FDR最小的前10条通路中有3条与HAG相关,除了文中的癌症通路,还有TNF信号通路以及NOD样受体信号通路。TNF是一种细胞信号因子,介导着多个系统的炎症反应,是炎症急性期的主要细胞因子[41],可在HP脂多糖的刺激下[42]触发多项级联反应,诱导细胞凋亡[43]。而NOD属于胞内识别受体,可在危险相关分子模式和病原相关分子模式的激活下[44],与其适配器蛋白凋亡相关斑点样蛋白和半胱天冬氨酸蛋白酶原结合形成炎症小体,诱导炎症反应[45]。所以,三黄清胃丸可能通过作用于上述信号通路及其他通路对HP诱发的慢性胃炎进行调控。
综上所述,本研究通过网络药理学方法对三黄清胃丸治疗HAG的作用机制进行了分析,发现了140种可直接作用于HAG靶点的活性成分以及94个潜在靶点,并通过KEGG通路富集分析确定了89条作用通路,结果与目前文献报道基本吻合,证明了其科学性。同时上述研究成果也给我们下一步研究指明了方向,为在动物实验中深入探讨三黄清胃丸治疗HAG的作用机制奠定了基础。

