远端胃癌行D2根治术中清除第12p组淋巴结的临床意义
蒋笃均 蔡 彬 周廷亮 张 跃
胃癌早期诊断困难,大部分患者发现时已处于进展期[1]。胃癌D2根治术是目前治疗胃癌的最主要方法,于腹腔镜辅助下进行胃癌D2根治术已逐渐得到医学界认可[2-3],但仅仅采用手术进行根治切除后患者5年生存率仍不理想,总体疗效不满意。规范的胃癌外科治疗必定是从系统清扫淋巴结开始,其中肝十二指肠韧带内沿门静脉下半(No.12p组)淋巴结解剖位置较深,对于腔镜下淋巴组织暴露及完整清除提出了较高技术要求,其是否应被纳入胃癌D2根治术一直是困扰学界的较大争议[4]。本文回顾性分析我院D2根治术中清除No.12p淋巴结的180例远端胃癌患者临床资料及病理资料,分析该淋巴结清除的临床意义,结果如下。
1 资料与方法
1.1 一般资料
回顾性分析2015年2月至2018年4月我院行胃癌D2根治术(对照组,n=126)、胃癌D2根治术中清扫No.12p淋巴结的远端胃癌患者(观察组,n=180)临床资料及病理资料。纳入标准:①均在术前经B超、胃镜及腹部CT行胃癌术前影像学与病理分期,未见明显手术禁忌证,肿瘤浸润深度达T2~T3(T2:侵及固有肌层或浆膜下,T3:侵至浆膜层);②胃镜病理活检证实为进展期远端胃癌,影像学检查确认无其他部位转移,行胃癌D2根治术(包括全胃切除术与远端胃切除术),观察组另行肝十二指肠韧带内(包括No.12a、No.12b、No.12p组)淋巴结清扫术;③知情同意本研究并签署知情同意书。排除标准:①合并呼吸功能障碍、肝肾功能不全、重症心血管疾病;②肥胖、营养不良或早期胃癌;③局部浸润且有肝脏等其他部位转移。本研究获得院伦理委员会批准。观察组中男性122例,女性58例;年龄26~75岁,平均(50.18±5.14)岁。对照组中男性80例,女性46例;年龄25~76岁,平均(50.11±5.19)岁。2组一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2 方法
所有患者均于术前予以对症治疗,纠正低蛋白血症、水电解质紊乱及贫血。
1.2.1 对照组 于腹腔镜下实施胃癌D2根治术。术前插胃管行胃肠减压,全麻后取截石位,常规消毒铺巾,脐下为观察通道,穿刺10 mm Trocar,建立CO2气腹,气腹压12~16 mmHg,于左右上腹位置建立术者、助手操作通道,术者在患者左侧,助手在患者右侧。术中采用Storz电视腹腔镜系列,应用双极电凝刀(Sabre 2400,ASPEN LABS USA)进行解剖。患者取头高脚低位,后以腹腔镜对腹腔进行全面探查,依据探查结果进行手术,若肿瘤位于胃窦部位则行胃远端切除,若肿瘤位于贲门及胃体则行全胃切除。腹腔镜下应用超声刀依次游离动静脉及韧带,将整个胃彻底游离,后按由上至下、由左至右、先胃大弯后胃小弯顺序行胃内淋巴结清扫,关闭CO2气腹,以荷包包埋并以大网膜加强。腹腔镜下应用毕Ⅰ式与毕Ⅱ式空肠Brauns吻合行远端胃大部切除,应用食管空肠Roux-en-Y吻合术及空肠P式襻代胃术行根治性全胃切除,术毕常规放置引流管,逐层关腹。
1.2.2 观察组 在行D2根治术同时进行No.12p组淋巴结清扫。常规开腹后第一助手捏握并缓慢牵拉十二指肠降部,纵行切开十二指肠外侧腹膜,使结肠肝曲游离,保证一定手术视野,行Kocher切口游离并显露大网膜右侧缘,以闭合切割器离断十二指肠后提起近端胃,充分保留并展平肝十二指肠韧带。于横结肠上缘将胃结肠韧带切开,选择结缔组织疏松间隙,锐钝结合分离结肠系膜前叶,于手术灯光下仔细辨认小血管分支,将靠近结肠血管弓处切断、结扎、缝合,向上分离,横行切开肝十二指肠韧带脏层腹膜。清扫胰头周围淋巴脂肪组织、胃网膜右动脉根部幽门淋巴结群及脂肪组织,自胰十二指肠分支分布将胃网膜右动脉结扎并离断,暴露并摘除胆总管至胰头后方门静脉旁的No.12p组淋巴结,自胆总管右侧缘切开肝十二指肠后腹膜,向上游离直达胆囊管的下段平面,靠近肝缘横向切开后腹膜,纵行切口肝固有动脉血管鞘,清扫No.12p淋巴结,靶内游离向上至肝门,向下游离至胃十二指肠根部。以血管吊带暂时提起并标记肝固有动脉,以橡胶带向右牵引,清扫肝十二指肠韧带后方淋巴结与脂肪组织,清扫No.12b淋巴结。清扫第一肝门周围淋巴、脂肪组织,整个过程以电刀锐性分离。将可疑肿大的No.12p组淋巴结放入具有标志的小瓶,以10%福尔马林固定,石蜡包埋后进行多层切片,每枚淋巴结做3张切片,厚度为3 μm/片,行HE染色,光学显微镜观察,分析其大体分型及组织学分型。
1.3 观察指标
比较2组手术效果。对比观察组不同病理参数患者No.12p淋巴结转移率,分析远端胃癌患者发生No.12p淋巴结转移的危险因素。
1.4 统计学方法
2 结果
2.1 2组手术一般情况比较
观察组手术时间、术中出血量长/高于对照组(P<0.05);2组术后住院时间、下床活动时间、排气时间比较,差异无统计学意义(P>0.05)。见表1。

表1 2组手术一般情况比较
2.2 术后并发症发生率比较
观察组术后未见死亡或胆瘘、吻合口瘘、大出血等病例,出现胃瘫6例,淋巴管瘘5例,腹泻3例,腹腔感染2例,门静脉损伤2例。对照组也未见手术死亡病例,术后出现严重腹泻5例,胃瘫、腹腔感染各2例,胆瘘2例。出现并发症者均经对症处理后好转。2组并发症发生率分别10.00%(18/180)、8.73%(11/126),差异无统计学意义(χ2=0.139,P>0.05)。
2.3 不同病理参数患者No.12p淋巴结转移率比较
观察组中共清扫出淋巴结93枚,其中24例在清扫中发现No.12p淋巴结转移,转移率为13.33%(24/180)。Borrman Ⅲ~Ⅳ型患者No.12p淋巴结转移率高于Borrman Ⅰ~Ⅱ型,多发癌No.12p淋巴结转移率高于胃角、胃窦区,浆膜受侵者No.12p淋巴结转移率高于浆膜未受侵者,高、中分化者No.12p淋巴结转移率低于低分化者,N0~1 No.12p淋巴结转移率低于N2~3,肿瘤直径<3 cm、3~5 cm者No.12p淋巴结转移率低于肿瘤直径>5 cm者,差异均有统计学意义(P<0.05)。No.12p淋巴结转移率在其他不同病理参数中比较无统计学差异(P>0.05)。见表2。
2.4 影响远端胃癌患者发生No.12p淋巴结转移的危险因素
Logsitic回归分析发现,Borrman分型、浆膜受侵、分化程度低、肿瘤直径为远端胃癌患者发生No.12p淋巴结转移的危险因素(P<0.05)。见表3。
3 讨论
手术为治疗胃癌的主要手段,其中D2根治术是胃癌的标准根治性手术[5],腹腔镜下D2根治术具有创伤小、痛苦少、恢复快等优势,日本《胃癌处理公约》建议,按肿瘤A级根治原则(D>N),即Ⅰb期胃癌应行D2清扫术,Ⅱ期及Ⅰ期胃癌应行D2+和(或)D3根治术,才能够达到更为彻底的A级(绝对)根治度[6]。胃癌D2根治术的核心技巧为周围淋巴结的清扫,其中No.12p组淋巴结附近重要血管较多,清扫包括众多血管甚至血管鞘的境界解剖与剥离,因此是当前难题。有部分学者[7]坚持认为在未发现明显肿大的淋巴结时只需常规清扫No.12a组淋巴结(肝固有动脉下半淋巴结)即可,另一部分学者[8-9]认为必须对肝十二指肠韧带内包括No.12b组(胆总管下半淋巴结)及No.12p组(门静脉下半淋巴结)淋巴结进行脉络化甚至骨骼化清扫。
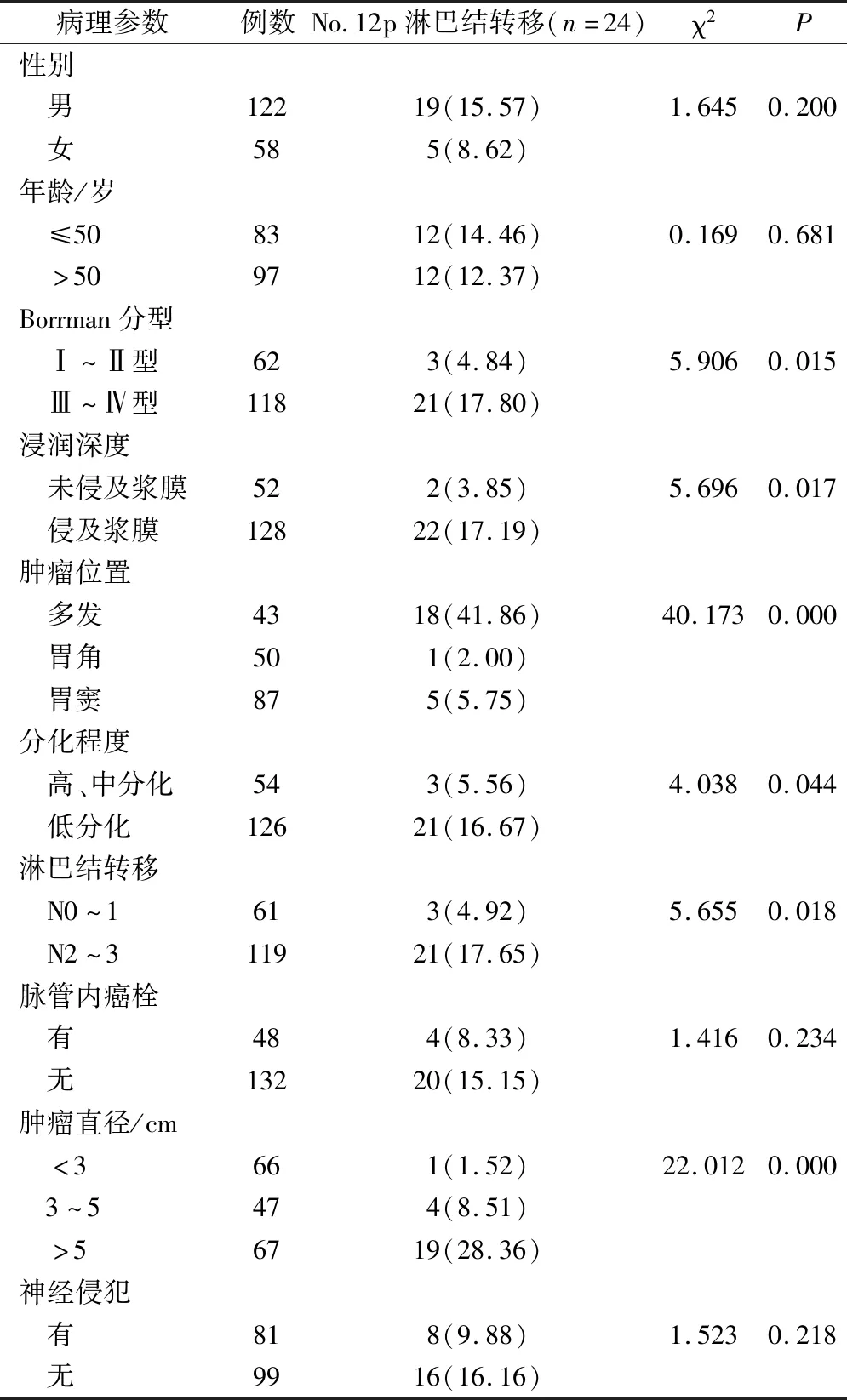
表2 不同病理参数患者No.12p淋巴结转移率比较(例,%)

表3 影响远端胃癌患者发生No.12p淋巴结转移的危险因素
本研究中,观察组在胃癌D2根治术基础上实施No.12p组淋巴结清扫,结果显示观察组的手术时间、术中出血量较对照组增加,但2组术后住院时间、下床活动时间、排气时间、并发症发生率比较无显著性差异,这与郭志斌[10]的研究结果基本相近,因此为确保淋巴结清扫更彻底,在胃癌D2根治术中对No.12p淋巴结进行清扫有一定意义。手术外科医师需保持全面思维,将原发癌类型与淋巴结肿大联系至一起考量,对病理分期较好患者,门静脉周围No.12p淋巴结可能出现明显肿大甚至融合,应仔细进行清扫及处理,不可因此放弃根治性切除;对于门静脉未见明显肿大者,应考虑小结节孤立型淋巴转移存在的可能性,不可缩小清除范围而应当更认真扩大清扫范围。
本研究中,观察组共24例在清扫中发现No.12p淋巴结转移,转移率为13.33%,这与Feng等[11]的研究结果(No.12p淋巴结转移率为9.20%)相比略高。No.12p淋巴结结构特殊,胃幽门部及小弯部淋巴引流进入门静脉周围No.12p淋巴结,因而在胃癌根治术中肝十二指肠韧带内的处理原则及处理技巧均有着不同争议。本研究资料也显示,随Borrman分型增加,胃癌组织浸润深度逐渐加深,分化程度逐渐降低,淋巴结转移范围及站别逐渐增加,No.12p淋巴结转移率均有一定程度上升,此外多发癌的No.12p淋巴结转移率也明显高于胃角、胃窦区,这与倪中凯[12]的研究结果相近。Borrman分型Ⅲ~Ⅳ型病例生长方式较Ⅰ~Ⅱ型有明显特殊性,尤其是Ⅳ型弥漫浸润的侵袭范围广,更易发生淋巴结与腹膜转移,远期生存率低;肿瘤部位与肝十二指肠韧带内淋巴结转移范围及规律有关,尤其是进展期远端胃癌的组织及脉管遭到肿瘤组织破坏,存在较大概率的跳跃转移;肿瘤分化程度在一定意义上体现肿瘤恶性程度,随肿瘤分化程度下降,肿瘤生长方式侵蚀性增强,越易向深部组织浸润,突破更多肿瘤脉管网络,更易发生淋巴结转移,此外若浆膜受累,则肿瘤细胞有极大可能向腹腔内脱落,经跨越幽门环方式侵及十二指肠,增加胃十二指肠动脉淋巴引流发生肿瘤的可能性,本组中侵及浆膜患者No.12p淋巴结转移率高于未侵及浆膜者,因此对于侵及浆膜的远端胃癌患者应考虑行肝十二指肠韧带内No.12p组淋巴结清扫。同时肿瘤大小与其生长速度及生长时间呈正比,而肿瘤大小是否可在动力学上推动外周淋巴结转移,尚需进一步临床试验,因而在术中依据对胃癌原发灶的观察及术者亲自触摸对肿瘤大小进行判断,结合术前影像学进行评估,可决定方案内是否进行No.12p组淋巴结的清扫。
本研究中,多因素Logsitic回归分析发现,Borrman分型Ⅲ~Ⅳ型、浆膜受侵、分化程度低、肿瘤直径大为远端胃癌患者发生No.12p淋巴结转移的危险因素,提示对于Borrman分型Ⅲ~Ⅳ型、浆膜受侵、分化程度低、肿瘤直径大者有必要将No.12p淋巴结纳入胃癌D2手术切除范围,原因有:①剥离裸露肝动脉、清除No.12a淋巴结时,肝动脉与门静脉多有重叠或交叉,不可能将No.12a与No.12p淋巴结完全区分;②锐性解剖肝十二指肠韧带时,若裸露肝动脉、结扎切断胃十二指肠动脉,将肝动脉悬吊提起,并剥离裸露门静脉一并清除No.12p淋巴结,不会明显增加手术并发症,简便、安全、可行。对于No.12p淋巴结转移患者,剥离裸露门静脉可彻底切除转移病灶,真正做到R0切除,有益于延长患者术后生存期[13]。
在安全性方面,有学者[14]认为D2胃切除术不需常规裸露胆总管清除No.12b淋巴结,以免增加胆瘘并发症,本研究中观察组未见胆瘘病例,而对照组2例出现胆瘘,可能与剥离肝十二指肠韧带神经淋巴板、裸露胆总管有关,因而建议于高度怀疑转移时清除No.12b。同时在清扫该部位淋巴结时需充分暴露术野,直视下完成操作,解剖层次辨别不清时,可将左手拇指、食指放置在肝十二指肠韧带前后以感知胆总管位置及是否有肿大淋巴结,以解剖镊子将淋巴结夹持,后采用低功率电刀或超声刀于淋巴结与胆总管的间隙操作,对于小出血点则采用电凝止血,动脉性出血者需缝扎[15]。同时门静脉损伤是清扫No.12p淋巴结最常见并发症,而本研究中观察组2例见门静脉损伤,建议采用超声刀,在清扫完肝总动脉前上部淋巴结后,将非工作面沿动脉上缘上行至肝左动脉,其后方即为门静脉,应准确识别并减少损伤。
综上所述,对于远端胃癌,在行D2根治性切除手术时建议清除No.12p组淋巴结,虽然会需要一定手术时间,并增加术中出血量,但不会增加后期并发症,尤其是Borrman分型Ⅲ~Ⅳ型、浆膜受侵、分化程度低、肿瘤直径大等高危病例,更应剥离裸露门静脉、清除No.12p淋巴结。

