甲氨蝶呤治疗急性淋巴细胞性白血病期间不良反应的特征及影响因素分析
王 艳 李 璠 曹 江
急性淋巴细胞性白血病(acute lymphocytic leukemia,ALL)是临床常见儿童恶性肿瘤,占儿童急性白血病的75%以上,随着化疗技术的进展,甲氨蝶呤的应用已将ALL转变为可以治愈的疾病,绝大多数患者可获得无病生存[1]。然而,甲氨蝶呤具有较强的细胞毒性,治疗期间极易导致恶心、呕吐、口腔黏膜损害甚至骨髓抑制、肝肾功能损伤、神经系统毒性等不良反应,影响治疗依从性,甚至导致治疗失败[2]。因此,目前ALL的治疗规范中均强调甲酰四氢叶酸钙(CF)的解救治疗,以降低正常细胞受累,但CF在解救正常细胞的同时也会对甲氨蝶呤的治疗效果造成影响[3]。因此,根据ALL患儿治疗期间不良反应特征及影响因素选择合适的用药剂量与解救时机,方能最大限度保证疗效与安全性的平衡。为此,本研究选取142例患儿进行了前瞻性分析,旨在为ALL的合理用药提供参考。
1 资料与方法
1.1 选取标准与排除标准
选取我院2014年7月至2017年7月收治的142例ALL患儿,选取标准:①参照中华医学会儿科学分会血液学组制定的儿童ALL诊疗建议确诊[4];②符合大剂量甲氨蝶呤治疗适应证;③监护人自愿参与此次研究。排除标准:①因治疗期间严重过敏反应,未完成治疗疗程;②合并心、肝、肾等脏器严重功能不全;③合并其他恶性肿瘤或既往有大剂量甲氨蝶呤治疗史;④合并感染、电解质异常或凝血功能异常。
1.2 一般资料
142例患儿中,男63例,女79例,年龄1~16岁,平均(5.79±1.82)岁,临床分型:标危(SR)68例,中危(MR)52例,高危(HR)22例;MTHFR C677T基因型:CC 29例,CT 71例,TT 42例;RFC1 A80G基因型:GG 12例,GA 35例,AA 31例,GA+AA 64例。
1.3 研究方法
1.3.1 治疗方案 参照治疗方案(CALLG2008)、儿童ALL诊疗建议、Hyper-CVAD方案、改良Boom方案及BFM90方案,实施大剂量甲氨蝶呤化疗[5]:化疗前3 d口服碳酸氢钠(尿液碱化),化疗前24 h内静脉注射100 ml 5%葡萄糖水并口服碳酸氢钠5 ml·kg-1,而后给予甲氨蝶呤注射液(澳大利亚Pfizer,生产批号130219-2,规格20 ml∶0.5 g)静脉滴注,剂量1~3 g·m-2,首次剂量不超过总剂量的1/6且不超过500 mg,并于30 min内快速滴注完毕,剩余剂量于24 h内缓慢滴注。甲氨蝶呤给药后36 h给予CF解救,剂量为15 mg·m-2,每隔6 h给药1次,同时监测甲氨蝶呤血药浓度,至血药浓度降至0.1 μmol·l-1以下可停止解救。化疗期间密切观察患儿口腔黏膜、胃肠道、肝肾不良反应,同时给予保胃、护肝、止吐等对症治疗[6]。
1.3.2 观察指标 (1)不良反应特征:参照药物不良反应判断标准(NCI-CTC 4.0)[7],记录患儿甲氨蝶呤用药后至下一疗程开始前(平均2~3周)不良反应发生情况,包括骨髓抑制、胃肠道反应、黏膜损伤、感染、过敏反应、肝功能异常、肾功能异常等,记录指标包括不良反应发生率、分级(1~5级)、发生时间及持续时间。(2)不良反应影响因素:比较不同一般资料、血药浓度、临床分型、MTHFR C677T基因多态性、RFC1 A80G基因多态性患儿不良反应发生情况,采用非条件Logistic多因素回归分析,总结影响甲氨蝶呤治疗ALL期间不良反应的影响因素。
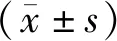
2 结果
2.1 不良反应发生情况
患儿甲氨蝶呤治疗期间最常见的不良反应为骨髓抑制,发生率为52.82%,且以3~4级为主,其次为1~2级胃肠道反应,患儿不良反应均经对症治疗后于1~21 d内消失(表1)。

表1 患儿甲氨蝶呤治疗期间不良反应特征分析(n=142)
2.2 单因素分析
不同年龄患儿感染率比较、不同性别患儿胃肠道反应及黏膜损伤发生率比较、不同RFC1 A80G基因型患儿骨髓抑制发生率比较,差异有统计学意义(表2)。

表2 不同临床资料患儿不良反应发生情况/例
注:*为组间比较,P<0.05。
2.3 多因素分析
将各个协变量以向后法引入Logistic回归方程,非条件Logistic多因素回归分析结果示,年龄与甲氨蝶呤治疗期间感染率相关,性别与甲氨蝶呤治疗期间胃肠道反应及黏膜损伤相关,RFC1 A80G基因型与治疗期间骨髓抑制相关,见表3。

表3 影响甲氨蝶呤治疗ALL期间不良反应的相关因素分析
3 讨论
ALL是一种造血干细胞恶性克隆性疾病,居小儿恶性肿瘤发病率之首,好发于3~7岁学龄前儿童,患儿以白血病细胞丧失分化、成熟能力为主要病理改变,其正常骨髓细胞被白血病细胞取代后,骨髓正常造血功能将逐渐衰竭,进而造成出血、感染风险增加,生存质量受到严重威胁[8]。大剂量甲氨蝶呤的应用,使ALL患儿5年无事件生存率达到70%~90%,且较传统化疗方案而言,更易通过血脑屏障与血睾屏障,能够有效控制髓外复发,延长患儿无病生存期[9]。
然而,甲氨蝶呤在杀伤肿瘤细胞的同时,对快速增殖的正常细胞也有着较强的杀伤效应,故可导致黏膜损伤、骨髓抑制等不良反应,甚至部分患儿可出现神经系统、心血管系统并发症[10]。因此,如何有效降低甲氨蝶呤治疗期间不良反应风险,一直是临床关注的重点问题。作为一种四氢叶酸类药物,CF在拮抗甲氨蝶呤相关不良反应环节得到了广泛应用,其可通过提供还原叶酸,恢复蛋白质合成,但高剂量CF可造成甲氨蝶呤药效受限,为保证治疗效果,临床一般不推荐持续给予大剂量CF[11],若能根据患儿不良反应相关危险因素做出临床决策,将为CF用法用量的选择提供更为可靠的参考。
通过多因素回归分析,可以发现,在感染的发生中,年龄扮演了重要角色,即患儿年龄越小感染发生率越高,其原因考虑与年龄较小者免疫功能发育尚不完善,而大剂量甲氨蝶呤对免疫细胞的破坏进一步破坏机体防御功能有关[12],加之低龄患儿易因蚊虫叮咬、皮肤擦伤发生皮肤损伤,第一道免疫屏障被破坏,进一步造成呼吸道感染、肺炎、肛周脓肿甚至败血症发生风险加剧。对于该类患儿而言,可考虑适当提前CF救治时机,以抵抗甲氨蝶呤所致免疫功能下降。
本研究结果示,胃肠道反应及黏膜损伤的发生均与患儿性别具有一定关联,一方面考虑与此次研究不同性别患儿年龄分布存在差异有关,另一方面,甲氨蝶呤在体内吸收、分布、消除亦可能受性别影响,也在一定程度上造成了药物毒性的性别差异。与此同时,较其他RFC1 A80G基因型患儿而言,AA基因型者具有更高的骨髓抑制发生风险,可能与该类个体对甲氨蝶呤敏感性较高有关,亦有学者指出,AA基因型个体造血细胞内甲氨蝶呤更易发生向甲氨蝶呤多聚谷氨酸(MTXPG)的转化,进而造成药物排泄延迟、免疫功能受损[13]。
综上所述,甲氨蝶呤治疗ALL期间患儿不良反应发生率较高,且集中于骨髓抑制、胃肠道反应等,肝、肾功能异常也时有发生,在强调规范化CF解救的基础上,应针对患儿存在的低龄、基因型等危险因素,适当缩短CF周期或提高用药剂量,以期在保证治疗效果的前提下,尽可能降低患儿不良反应发生风险。

