闽西地区猪流行性腹泻病毒N基因分子进化及序列分析
董波 李静楠 曹雪珍

摘要:分析闽西地区猪流行性腹泻病毒(PEDV)N基因的遗传进化特征,收集闽西地区猪流性腹泻病例组织样品8份,用逆转录PCR(RT-PCR)扩增N基因,连接至pMD-18T载体进行测序,并与国内外已知参考毒株序列进行比对及遗传进化分析。结果显示,8株闽西流行毒株之间N基因核苷酸的同源性为9.8%~100.0%,推导的氨基酸序列的同源性为99.5%~100.0%,而闽西毒株与早期疫苗毒株CV777和SM98的同源性较远。氨基酸序列分析表明,闽西毒株氨基酸序列存在15处突变,与2010年后中国流行毒株变异位点相同。提示闽西地区毒株为目前国内流行毒株,与疫苗毒株亲缘关系较远,可能导致机体针对疫苗毒株产生的抗体不能够有效抵抗变异毒株,不能给猪群提供很好的免疫保护,因此需要基于变异毒株研究出有针对性的疫苗来预防PEDV。
关键词:猪流行性腹泻病毒;N基因;遗传分析
中图分类号: S852.65+1 文献标志码: A 文章编号:1002-1302(2019)17-0059-04
猪流行性腹泻(porcine epidemic diarrhea,简称PED)是由猪流行性腹泻病毒引起的一种高度接触性传染病,以腹泻、呕吐为主要临床特征,冬、春季多发[1]。该病在世界大多数国家均有报道,尤其对韩国、中国、日本、菲律宾、泰国等亚洲国家造成了严重经济损失,引起养猪业的广泛关注[2]。2010年末,我国暴发的PED影响了河北、安徽、广西、广东、浙江、江西、四川、湖南、福建等省份的养猪业[3]。此次疫情造成的损失惨重,甚至之前接种过猪流行性腹泻病毒(PEDV)疫苗的猪群也同样发病,究其原因,可能是由于流行毒株变异或者毒力增强,使现有疫苗难以提供免疫保护[4]。
猪流行性腹泻病毒为冠状病毒科冠状病毒属成员,为单股正链RNA病毒,编码2个复制酶多聚蛋白ppla和pplab,1个非结构蛋白ORF3和4个结构蛋白纤突蛋白(spike,简称S)、膜蛋白(membrane,简称M)、核衣壳蛋白(nucleocapsid,简称N)和小膜蛋白(small membrane,简称E)[5]。其中,N蛋白由1 326个核苷酸组成,编码442个氨基酸。N蛋白是一种多功能磷酸化蛋白质,能够与细胞膜和磷脂结合,改变宿主细胞的转录,促使RNA复制体的形成和病毒组装[6]。N基因在诱导免疫和病毒感染的致病机制中起重要作用,N蛋白的表达可抑制细胞RNA和蛋白质G2/M期的合成从而促进病毒的繁殖[7]。在早期感染PEDV时,宿主体内就能产生抗N蛋白高水平的抗体,因此N蛋白可作为早期检测发病猪是否感染PEDV的免疫靶细胞[8]。
近年来,PEDV的流行趋势不断增长,给养猪业造成严重的影响。因此,对PEDV的遗传变异情况进行监测是防控的重要环节。本研究收集闽西地区PEDV流行毒株,利用逆转录PCR(RT-PCR)扩增N基因,将PEDV N基因序列进行同源性比较,绘制系统发育进化树,理清闽西地区PEDV与国内外流行毒株以及疫苗毒株之间的遗传进化关系,为做好PEDV的防控提供资料参考。
1 材料与方法
1.1 样品
样品选取2013年1月至2016年12月闽西地区规模化养猪场的PEDV阳性样品8份。1.2 主要試剂
AxyPrep总RNA小量制备试剂盒、AxyPrep质粒DNA小量试剂盒、AxyPrep凝胶回收试剂盒,购自康宁生命科学(吴江)有限公司;dNTP、反转录酶M-MLV、5×M-MLV buffer、pMD18-T Vector,购自宝生物工程(大连)有限公司;DL2000 DNA marker、10×loading buffer,购自广州瑞真生物技术有限公司;Oligo(dT)18、Murine RNase Inhibitor、T4 DNA Ligase、10×Ligase Buffer,购自南京诺唯赞生物科技有限公司;胰蛋白酶(tryptone)、酵母(yeast extract),购自OXOID公司;Ampicillin(氨苄西林)(100mg/mL)、NaCl、琼脂粉,购自Biowest公司;异丙醇、三羟基甲基氨基甲烷(Tris碱)、溴化乙锭(EB)、三氯甲烷、乙二胺四乙酸(EDTA)、乙醇、十二烷基硫酸钠(SDS)、DEPC(焦碳酸二乙酯)水,购自广东省汕头市西陇化工股份有限公司。
1.3 提取病毒总RNA及逆转录
按照试剂盒提供的操作手册,从试验猪小肠组织及内容物中提取总RNA。取洁净EP管,加入RNA 11 μL、Oligo(dT)18 1 μL,12 000 r/min离心40 s,于70 ℃水浴10 min,加入 5×M-MLV Buffer 5 μL、M-MLV 1 μL、dNTP 1 μL、DEPC水6 μL,混匀后,42 ℃水浴30 min,95 ℃ 水浴10 min。cDNA于 -80 ℃ 下保存。
1.4 E基因的扩增
参考GenBank上已发表的PEDV毒株N基因序列,使用Premier Premier 5.0生物软件设计合成1对特异性引物,PEDV-N-F:GGATCCATGGCTTCTGTCAGCTTTC;PEDV-N-R:CTCGAGTTTCAACGGCCGTATCACC。以cDNA为模板,进行PCR扩增。PCR反应程序如下:95 ℃预变性5 min;94 ℃ 变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。使用琼脂糖凝胶电泳进行鉴定,观察并记录结果。
1.5 重组质粒的构建和鉴定
采用AxyPrep凝胶回收试剂盒回收PCR产物,将纯化产物与pMD18-T Vector连接,16 ℃水浴4 h。将10 μL连接产物转化入DH5α感受态细胞,37 ℃培养过夜。提取质粒,进行鉴定。将阳性质粒送至生工生物工程(上海)股份有限公司进行测序。
1.6 序列分析
8株闽西毒株分别命名为LY201301、LY201302、LY201401、LY201402、LY201501、LY201502、LY201601和LY201602。采用表1中标准毒株的基因库登录号,获取参考毒株N基因序列。通过DNAstar和MEGA 5.2分子生物学分析软件对8株闽西地区的PEDV N基因序列与国内外已发表的毒株进行同源性分析,绘制PEDV基因系统遗传进化树。
2 结果与分析
2.1 N基因的扩增、纯化、克隆及测序
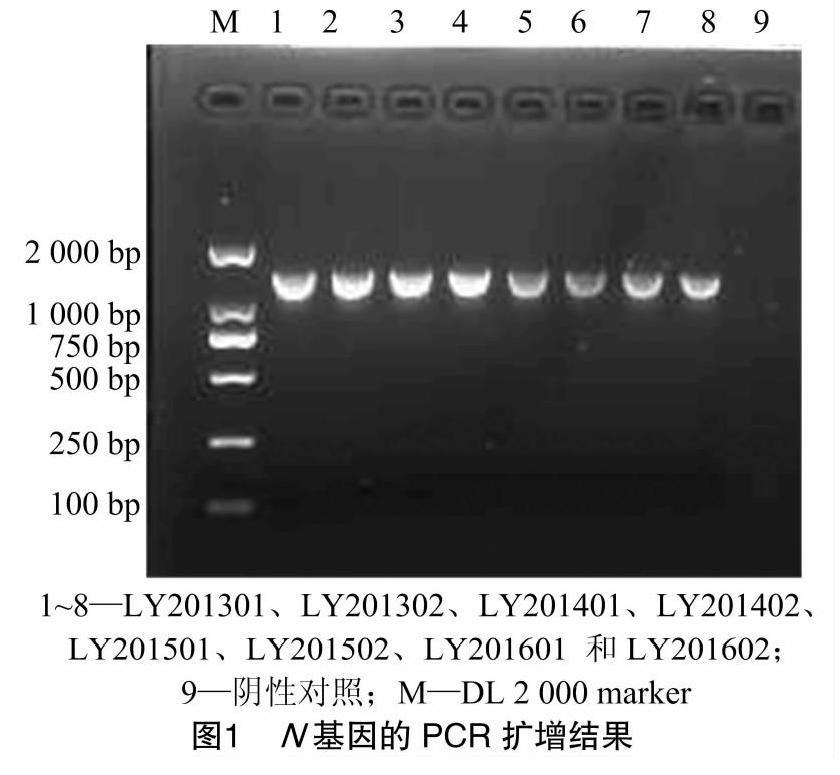
采用RT-PCR技术,对8份样品的N基因进行扩增,产物经凝胶电泳鉴定,由图1可知,获得大小约为1 326 bp的基因片段。将纯化后的PCR产物连接到pMD18-T载体上,送至生工生物工程(上海)股份有限公司测序,序列结果正确。
2.2 N基因的序列比对及同源性分析
闽西毒株N基因核苷酸序列之间的同源性为99.8%~100.0%,与26株引用毒株之间的同源性为94.3%~99.8%。闽西毒株与2010年以后中国分离毒株的同源性均在99%以上,与2013年美国毒株的同源性也均在99%以上。由图2可知,经遗传进化分析,34株毒株可分成3大组,Ⅰ组包括疫苗株CV777、2株韩国毒株(Attenuated DR13和SM98)及6株早期中国毒株;Ⅲ组包括2013年分离的4株美国毒株、1株韩国毒株、2010年后分离的中国流行毒株以及8株闽西毒株。系统发育分析显示,闽西毒株与经典毒株CV777、2010年前中国分离毒株以及韩国毒株(Attenuated DR13和SM98)的亲缘性较远,与2010年以后中国分离毒株的亲缘性较高,与2013年美国毒株的亲缘性也较高,说明闽西毒株与目前国内以及美国流行毒株可能来自同一祖先。
2.3 N基因的氨基酸结构特征
由表2的序列比对结果可知,N基因全长为1 326 bp,编码442个氨基酸,包含1个完整的阅读框架。闽西毒株与疫苗毒株CV777相比,氨基酸序列仅存在15处突变。这些突变位置与2010年后的中国变异毒株一致。
3 讨论
在PEDV的RNA合成过程中,N蛋白能与细胞膜磷脂结合,促进病毒的组装和RNA复制体的形成[9]。另外,在PEDV的结构蛋白中,N蛋白所占比例最大,它能在感染的细胞中大量表达,并且在感染初期,动物体内就能产生较高水平的抗N蛋白的抗体[10]。N蛋白具有高度保守的特性,可以作为早期诊断的靶蛋白,可利用N蛋白建立PEDV的分子生物学诊断技术[11]。因此,选择N基因进行PEDV遗传进化分析,有助于了解病毒的流行趋势与进化规律,对于病毒的防控和疫苗的研制具有重要意义[12]。本研究收集8株闽西毒株,利用PCR扩增获得8株病毒N基因,使用生物信息学软件进行系统发育分析,有助于从分子水平阐明闽西PEDV毒株与国内外毒株的亲缘关系。
同源性分析结果显示,闽西毒株之间的核苷酸同源性为 99.8%~100.0%,与2010年后中国分离毒株的进化关系较近,说明闽西毒株与目前国内流行毒株具有很高的同源性。然而,闽西PEDV流行毒株与疫苗毒株CV777的核苷酸同源性为94.0%~95.4%,遗传进化关系较远,提示以CV777为免疫原设计的疫苗,在防治PED方面可能作用不显著,成为控制PEDV暴发的主要隐患。另外,闽西毒株与2013年美国流行毒株的同源性较高,亲缘性较近,均属于Ⅲ组,说明闽西流行毒株与2010年后中国分离毒株以及2013年后美国分离毒株可能来自同一祖先。并且由遗传进化树可见,早期韩国毒株(virulent DR13)也处于Ⅲ组,提示该毒株和目前国内外流行毒株存在着潜在关系,需要进一步分析。8株闽西毒株N基因无特有的片段缺失和插入,存在15处相同突变,这些突变位点与2010年后中国分离毒株的突变位点一致,进一步证实了闽西毒株属于2010年后中国流行毒株,也表明N基因相对保守,在目前国内的流行毒株中基本没有出现变异。
总之,本研究结果证实闽西PEDV毒株属于目前国内外的流行毒株,与疫苗毒株(CV777)的进化关系较远,可能导致由CV777设计的疫苗对当前流行毒株的保护力不够,不能给猪群提供很好的免疫保护,因此需要设计有针对性的疫苗来预防PEDV。并且氨基酸序列分析表明,闽西毒株N基因与疫苗毒株CV777相比存在15處基因改变,但是与目前流行毒株相比没有明显变化,证明N基因是高度保守的,因而可以作为疫苗候选基因。本研究结果希望能从分子水平阐明闽西地区PEDV的遗传进化特征,同时希望为PEDV疫苗的设计提供资料基础。参考文献:
[1]殷 震,刘景华. 动物病毒学[M]. 北京:科学出版社,1985.
[2]Chen J,Wang C H,Qiu H,et al. Molecular epidemiology of porcine epidemic diarrhea virus in China[J]. Archives of Virology,2010,155(9):1471-1476.
[3]Pan Y F,Tian X Y,Li W,et al. Isolation and characterization of a variant porcine epidemic diarrhea virus in China[J]. Virology Journal,2012,9(1):1-9.
[4]Stevenson G W,Hoang H,Schwartz K J,et al. Emergence of porcine epidemic diarrhea virus in the United States:clinical signs,lesions,and viral genomic sequences[J]. Journal of Veterinary Diagnostic Investigation,2013,25(5):649.
[5]吕茂杰,陈建飞,时洪艳,等. 猪流行性腹泻病毒核衣壳蛋白与感染细胞核磷蛋白的共定位分析[J]. 微生物学报,2011,61(5):643-647.
[6]Li B X,Ge J W,Li Y J. Porcine aminopeptidase N is a functional receptor for the PEDV coronavirus[J]. Virology,2007,365(1):166-172.
[7]Lee H-K,Yeo S-G. Cloning and sequence analysis of the nucleocapsid gene of porcine epidemic diarrhea virus Chinju99[J]. Virus Genes,2003,26(2):207-212.
[8]孙东波,冯 力,时洪艳,等. 猪流行性腹泻病毒分子生物学研究进展[J]. 动物医学进展,2006,27(10):11-14.
[9]李好磊,李叶珍,赵 顾,等. 猪流行性腹泻病毒N基因重组真核质粒构建及其表达[J]. 浙江农业学报,2017,29(7):1103-1109.
[10]吴玉璐,朱建平,杨 莘,等. 猪流行性腹泻病毒N基因的表达及抗原性分析[J]. 中国预防兽医学报,2013,35(4):299-303.
[11]易新健,刘 准,张翠翠,等. 一株猪流行性腹泻病毒S、M、N基因的遗传变异分析[J]. 动物医学进展,2017,38(2):12-16.
[12]祁光宇,刘 斌,赵兴绪,等. 猪流行性腹泻病毒HB2015分离株N基因表达及单克隆抗体的制备[J]. 江苏农业学报,2018,34(1):76-80.

