荸荠多酚氧化酶基因的克隆及其在鲜切荸荠贮藏过程中的表达分析
宋慕波 帅良 方方

摘要:利用RACE技术首次从荸荠中克隆得到PPO基因全长cDNA序列,并分析其在鲜切荸荠贮藏过程中的表达变化。克隆得到的荸荠PPO基因cDNA序列全长为2 006 bp,开放阅读框长度为1 734 bp,编码577个氨基酸,命名为CwPPO(登录号:MG702489)。预测分析表明,CwPPO编码蛋白质的分子量为64.86 ku,分子式为C2891H4417N795O873S18,理论等电点为6.50,属亲水性蛋白。CwPPO蛋白可能定位于线粒体基质空间,具有3个典型的保守结构域和2个铜离子结合域。此外,预测发现CwPPO有20个丝氨酸磷酸化位点、7个苏氨酸磷酸化位点及6个酪氨酸磷酸化位点,其二级结构以不规则卷曲为主。系统发育分析显示,CwPPO蛋白与菠萝、油棕有较近的亲缘关系。荧光定量分析发现,CwPPO在鲜切荸荠中的初始表达水平较低,但在贮藏后期表达量快速提高。
关键词:鲜切荸荠;多酚氧化酶;基因克隆;表达分析
中图分类号: TS255.3 文献标志码: A 文章编号:1002-1302(2019)17-0046-04
荸荠(Eleocharis tuberosa)别称马蹄、地栗,属莎草科多年生浅水草本植物,其球茎风味独特并有较高的药用价值[1]。随着中国经济的发展,鲜切果蔬产品越来越受到消费者的喜爱。荸荠洗净和削皮不易,残留果肉的表皮寄生病菌容易进入人体而引发疾病,加之一般荸荠加工产品难以保持荸荠口感爽脆、清甜可口的特点,因此,卫生和方便的鲜切荸荠产品有较好的市场前景。然而,鲜切荸荠保鲜难度大、货架期短,特别是色泽劣变问题严重影响了鲜切荸荠产业的持续健康发展[2]。
多酚氧化酶(polyphenol oxidase,简称PPO)是植物体内普遍存在的一种末端氧化酶,可催化酚类物质氧化,形成黑色高聚物,其在果蔬褐变过程中起到的关键作用已经在苹果、梨和姜等果蔬的研究中得到证实[3-5]。一些研究表明,鲜切荸荠表面黄化可能与PPO活性相关,例如,壳聚糖、柠檬酸和水杨酸处理在抑制PPO活性上升的同时改善了鲜切荸荠的黄化[6-8]。然而,Pan等研究发现,导致荸荠黄化的物质是柚皮素和圣草酚而不是PPO参与的氧化反应产物[9]。因此,PPO在鲜切荸荠黄化过程中的作用仍不明确。
由于PPO是参与果蔬褐变的关键酶,其编码基因已在菠萝、甘薯、茶树、香蕉等多种植物中克隆得到[10-12]。荸荠分子生物学方面的研究较少,关于荸荠PPO基因的克隆和相关分子生物学研究未見报道。鉴于此,本研究拟利用前期获得的荸荠转录组数据进行荸荠果肉的PPO基因全长cDNA的克隆,研究鲜切荸荠贮藏过程中PPO基因的表达变化,可为多酚氧化酶的研究、鲜切荸荠黄化机制研究以及完善鲜切荸荠贮藏方案提供理论依据。
1 材料与方法
1.1 原料及处理
荸荠(Eleocharis tuberosa)于2016年12月10日购自广西壮族自治区贺州市八步区农产品市场。购买后运回实验室清洗,挑选大小均一和无机械损伤、无病虫害的荸荠,去皮后横切成厚度为0.5 cm的圆片,然后用0.1%(w/V)次氯酸钠溶液杀菌10 min,将样品晾干后置于塑料托盘中用0.02 mm聚乙烯保鲜膜包装,于10 ℃下贮藏。
1.2 试剂
植物RNA提取试剂盒,华越洋生物科技(北京)有限公司;SMARTer RACE 5′/3′ Kit RACE试剂盒、LA Taq DNA聚合酶、PMD-19T载体、感受态细胞DH5α、感受态细胞Stellar、DNA Marker、SYBR Green qPCR Master Mix荧光定量酶、6×Loading buffer、PrimeScriptTM RT reagent Kit反转录去基因组试剂盒,日本TaKaRa公司;溴化乙锭,生工生物工程(上海)股份有限公司;DNA凝胶回收试剂盒,天根生化科技(北京)有限公司;琼脂糖,西班牙Biowest公司;Tris、乙醇、EDTA-Na2均为分析纯,国药集团药业股份有限公司。
1.3 试验方法
1.3.1 荸荠果肉总RNA提取 采用华越洋植物RNA提取试剂盒提取荸荠果肉总RNA,具体方法按照说明书进行。得到RNA后利用K5600超微量分光光度计测定其纯度和含量,RNA样品保存于-80 ℃超低温冰箱中,用于反转录等后续试验。
1.3.2 荸荠果肉PPO基因克隆 3′RACE-cDNA和5′RACE-cDNA的合成具体操作按照SMARTer RACE 5′/3′ Kit RACE试剂盒进行。根据之前从荸荠转录组数据中得到的PPO基因片段设计3′RACE和5′RACE引物(表1)。PCR反应程序:94 ℃预变性1.5 min;94 ℃变性30 s,68 ℃退火45 s,72 ℃延伸2 min,25个循环;72 ℃延伸10 min,产物于4 ℃保存。PCR产物经回收、连接(pRACE vector)、转化(Stellar感受态细胞)、重组子筛选及菌液PCR鉴定后,测序委托华大基因科技股份有限公司进行。应用DNAMAN软件和NCBI在线工具对荸荠PPO基因进行序列基本结构和特征分析。
根据拼接得到的基因全长核苷酸序列设计引物(表1)。以反转录cDNA为模板,进行PCR扩增,经检测和测序获得全长序列。
1.3.3 荸荠PPO基因生物信息学分析 采用NCBI中的BLASTN、BLASTP程序进行核苷酸序列及其推导的氨基酸序列的同源性比较;ORF Finder程序寻找开放阅读框;采用ProtParam Tool分析蛋白质理化性质;采用Conserved Domains分析氨基酸序列的保守区域;采用Post Prediction和SubLocv 1.0进行蛋白亚细胞定位信号预测;ProtScale以Hphob./Kyte & Doolittle算法进行亲疏水性预测;使用NetPhos 2.0 Server预测蛋白质序列的磷酸化位点;使用ExPaSy-SOPMA软件分析蛋白质的二级结构;使用Clustal X2软件进行多重序列比对;采用Mega 5软件进行系统进化树构建;采用SWISS-MODEL预测蛋白质三级结构;采用Swiss-PdbViewer构建蛋白模型的拉氏构象图。
1.3.4 荸荠PPO基因的表达分析 根据获得的荸荠PPO基因cDNA序列利用Primer 5.0设计Q-PCR特异引物(表1)。采用PrimeScriptTM RT reagent Kit去除基因组和反转录试剂盒合成Q-PCR的模板cDNA,操作方法見说明书。参考TaKaRa公司的SYBR Green qPCR Master Mix说明书进行 Real-time PCR扩增。以18S rRNA(登录号:MG742686)为内参。利用2-ΔΔCt方法计算鲜切荸荠PPO基因在贮藏过程中的表达量。各样品的表达量均为3次生物重复的平均值。
2 结果与分析
2.1 荸荠果肉PPO基因cDNA全长序列克隆
荸荠转录组测序筛选得到与其他植物PPO基因同源性较高的基因片段,利用NCBI的BLAST程序进行比对,结果显示,与其他植物的PPO基因核苷酸序列相似度为62%~73%,其中与菠萝(Ananas comosus,XM_020246795.1)PPO基因核苷酸序列相似性最高,为73%。根据该序列设计3′RACE和5′RACE引物,进行PCR获得3′和5′端序列分别约为1 700 bp和600 bp(图1-A,图1-B)。将片段回收后进行测序分析发现3′端序列长度为1 663 bp,包含了3′非翻译区(3′UTR)及poly A结构;5′端序列长度为547 bp,包含了5′非翻译区(5′UTR)。将3′和5′端序列拼接后得到基因全长序列,在拼接序列的5′端和3′端设计引物扩增PPO的cDNA全长序列(图1-C),测序结果显示,该序列与拼接结果一致。
将克隆得到的全长序列使用NCBI中ORF Finder软件进行分析。该序列长度为2 006 bp,含有1个1 734 bp的最大开放阅读框(ORF)、57 bp的5′UTR区、188 bp的3′UTR区及27 bp的polyA结构,起始密码子ATG位于第58~60位,终止密码子为TGA(图2)。将该cDNA序列在NCBI上进行比对,发现该序列与油棕(Elaeis guineensis;XM_010912626.2,XM_010928464.2)、海枣(Phoenix dactylifera;XM_008779971.1)和菠萝(Ananas comosus;XM_020246795.1)的PPO基因相似度较高,均大于68%。因此,可证明已经克隆获得荸荠PPO基因,将此基因命名为CwPPO,并在GenBank上登录,登录号为MG702489。
2.2 CwPPO基因生物信息学分析
经预测分析,CwPPO编码蛋白质的分子量为64.86 ku;分子式为C2891H4417N795O873S18;理论等电点为6.50;利用ProtScale软件预测其属于亲水性蛋白,亲水指数(GRAVY)为-0.572。
CwPPO蛋白存在跨膜结构,属于跨膜蛋白,可能存在由内到外或由外到内的双向跨膜的2个跨膜螺旋结构域。采用NCBI的Conserved domains数据库预测CwPPO的保守结构域,发现了3个典型的保守结构域,分别为未知功能的保守结构域(446~575,PPO1_KFDV,pfam12143)及酪氨酸普通中心区域(162~372,Tyrosinase,pfam00264)、多酚氧化酶中间保守域(379~429,PPO1_DWL,pfam12142)(图3)。使用SignalP 3.0和Post Prediction预测显示CwPPO为非分泌蛋白,定位于线粒体基质空间的可能性最大。
蛋白质的磷酸化是最普遍和重要的蛋白翻译后修饰方式。经磷酸化预测发现,CwPPO编码的蛋白可在20个Ser、7个Thr和6个Tyr氨基酸位点进行磷酸化修饰。在这33个磷酸化位点分值最高的是S467,为0.997。磷酸化位点能够影响CwPPO蛋白的分子构象和活性,其位点预测能够为今后基因表达调控,蛋白修饰提供参考。
采用SOPMA软件预测CwPPO蛋白的二级结构,结果显示,该蛋白最主要的结构是无规则卷曲占64.52%,其次α-螺旋占19.83%, 延伸链占15.65%。α-螺旋和延伸链
分散于整个蛋白质中,且N-末端多以无规则卷曲形式存在,C-末端主要为延伸链形式。
利用Swiss-model预测CwPPO蛋白的三级结构,由软件自动匹配模板(PDB No. 4z11.1)进行参照建模,CwPPO蛋白三维结构中的α-螺旋、延伸链和无规则卷曲呈均匀分布,中间有2个铜离子结合域,位于172~202和324~359处(图4)。采用Swiss-Pdb Viewer软件分析上述同源建模结果,通过拉氏构象可以看出蛋白质残基的二面角(ψ和φ)位于核心区域,表明其空间结构稳定,故上述利用同源建模的方法对CwPPO蛋白进行建模的结果较为可靠(图5)。
2.3 CwPPO蛋白序列多重比对和进化树构建
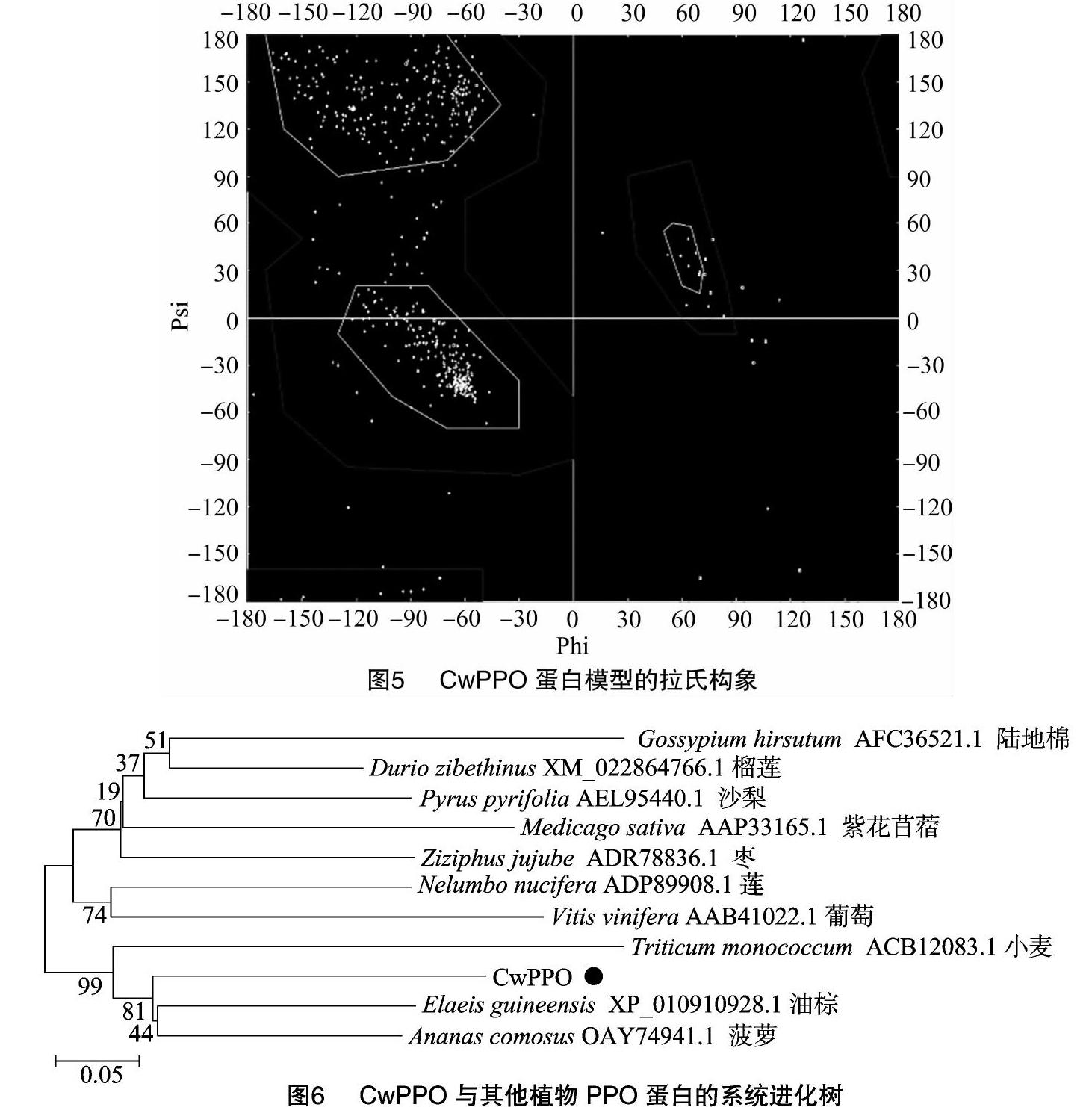
通过与其他植物PPO蛋白比对发现,不同PPO功能区域的氨基酸序列较为保守,而C-端、N-端区域的差异较大,尤其C-端的差异最大。为了解CwPPO蛋白与其他植物PPO蛋白的进化关系,对CwPPO蛋白进行多序列比对并建立系统进化树(图6)。结果发现,CwPPO与油棕(Elaeis guineensis)、菠萝(Ananas comosus)的PPO蛋白亲缘关系较近。
2.4 CwPPO在鲜切荸荠贮藏过程中的表达分析
通过荧光定量PCR分析鲜切荸荠贮藏过程中CwPPO的表达变化。结果表明,荸荠果肉中CwPPO的初始表达水平较低,切分后随着贮藏时间的延长,CwPPO表达水平逐渐升高,与鲜切荸荠的颜色变化表现出一定的相关性(图7)。
3 讨论与结论
多酚氧化酶(PPO)能够氧化植物中的酚类物质形成黑色高聚物,是导致鲜切果蔬褐变的关键酶[13]。其编码基因PPO在多种植物中属于多基因家族,如番茄、马铃薯中都发现了多个不同的编码基因[14-15]。但并非所有植物的PPO都属于多基因家族,例如葡萄藤中仅发现了1个PPO基因[16]。笔者前期在荸荠转录组数据中只发现了1个与其他植物PPO同源性较高的基因片段。本试验克隆得到的荸荠果肉PPO基因序列长度为2 006 bp,编码577个氨基酸,命名为CwPPO。CwPPO蛋白保守结构域预测显示其含有3个典型的保守结构域,这与以往报道的PPO蛋白的保守结构域[17]吻合。植物多酚氧化酶基因序列的2个铜离子结合域的同源性都很高,这是多酚氧化酶的主要功能区[18]。通过对蛋白序列进行保守结构域分析,发现CwPPO基因包含2个含铜的高度保守区(CuA、CuB),在同源构建CwPPO蛋白的三维模型中也可以看到2个铜离子结合域,分别是位于172~202和324~359处,这些功能域是植物PPO的主要功能区。系统进化树分析结果显示,CwPPO编码的氨基酸与油棕(Elaeis guineensis)、菠萝(Ananas comosus)有较近的亲缘关系。
鲜切荸荠10 ℃下贮藏前2 d基本没有颜色变化,之后荸荠表面组织才均匀黄化,与传统酶促褐变相比有明显的“启动”期。同时,贮藏期间荸荠PPO活性也较低,表明荸荠果肉中可能预先并不存在大量的PPO,而且鲜切荸荠贮藏过程中PPO的底物含量也较低[19-20]。因此,研究者推測荸荠的黄化与PPO参与的酶促褐变不同。本研究发现鲜切荸荠贮藏过程中CwPPO的表达水平逐渐升高,与荸荠黄化进程表现出了一定的相关性。切割伤害可以诱导植物PPO表达,增加酶的合成量,从而导致鲜切果蔬和外植体的褐变[21]。随着贮藏时间的延长,荸荠完全黄化后还会出现明显的褐变。因此,PPO可能没有参与荸荠贮藏前期的黄化过程,但贮藏后期逐渐积累的PPO是否参与了鲜切荸荠黄化后的褐变有待进一步研究。
参考文献:
[1]何凤平,潘永贵,张伟敏. 鲜切荸荠类黄酮3′-羟化酶分离纯化及其动力学性质[J]. 食品科学,2017,38(8):17-23.
[2]邓丽莉,明 建,田维娜,等. 乙醛熏蒸处理对鲜切荸荠品质变化的影响[J]. 食品科学,2010,31(2):233-236.
[3]He Q,Lou Y G. Enzymatic browning and its control in fresh-cut produce[J]. Stewart Postharvest Review,2007,3(6):1-7.
[4]Li J,Bao X L,Xu Y C,et al. Hypobaric storage reduced core browning of Yali pear fruits[J]. Scientia Horticulturae,2017,225:547-552.
[5]Queiroz C,Da Silva A J,Lopes M L,et al. Polyphenol oxidase activity,phenolic acid composition and browning in cashew apple (Anacardium occidentale L.) after processing[J]. Food Chemistry,2011,125(1):128-132.
[6]Pen L T,Jiang Y M. Effects of chitosan coating on shelf life and quality of fresh-cut Chinese water chestnut[J]. LWT - Food Science and Technology,2003,36(3):359-364.
[7]Jiang Y M,Pen L T,Li J R. Use of citric acid for shelf Life and quality maintenance of fresh-cut Chinese water chestnut[J]. Journal of Food Engineering,2004,63(3):325-328.
[8]Peng L T,Jiang Y M. Exogenous salicylic acid inhibits browning of fresh-cut Chinese water chestnut[J]. Food Chemistry,2006,94(4):535-540.
[9]Pan Y G,Li Y X,Yuan M Q. Isolation,purification and identification of etiolation substrate from fresh-cut Chinese water-chestnut (Eleocharis tuberosa)[J]. Food Chemistry,2015,186:119-122.
[10]荣 霞,赖钟雄,林玉玲,等. 橄榄多酚氧化酶基因(PPO)克隆及其试管苗离体保存过程中的表达分析[J]. 热带作物学报,2014,35(4):738-745.
[11]陈 娇,袁德保,谭 琳,等. 香蕉PPO基因的克隆及原核表达[J]. 贵州农业科学,2015,43(7):14-18.
[12]雷东锋,冯 怡,蒋大宗. 植物中多酚氧化酶的特征[J]. 自然科学进展,2004,14(6):606-614.
[13]Yoruk R,Marshall M R. Physicochemical properties and function of plant polyphenol oxidase:a review[J]. Journal of Food Biochemistry,2003,27(5):361-422.
[14]Newman S M,Eannetta N T,Yu H,et al. Organisation of the tomato polyphenol oxidase gene family[J]. Plant Molecular Biology,1993,21(6):1035-1051.
[15]Hunt M D,Eannetta N T,Yu H,et al. cDNA cloning and expression of potato polyphenol oxidase[J]. Plant Molecular Biology,1993,21(1):59-68.
[16]Dry I B,Robinson S P. Molecular cloning and characterisation of grape berry polyphenol oxidase[J]. Plant Molecular Biology,1994,26(1):495-502.
[17]田奇琳,林玉玲,郑庆游,等. 龙眼DlPPO1基因的克隆及其表达调控分析[J]. 西北植物学报,2016,36(6):1098-1104.
[18]You Y,Duan X,Wei X,et al. Identification of major phenolic compounds of Chinese water chestnut and their antioxidant activity[J]. Molecules (Basel,Switzerland),2007,12(4):842-852.
[19]庞学群,张昭其. 防褐处理对切分马蹄、马铃薯低温贮藏期间褐变的影响[J]. 食品科学,2002,23(4):126-129.
[20]Ru Z W,Lai Y Y,Xu C J,et al. In early stage of browning of phalaenopsis leaf explants[J]. Journal of Agricultural Science,2013,5(9):57-64.

