荷花淹水胁迫下实时定量PCR内参基因的验证
徐君 江君 王欢

摘要:旨在筛选荷花淹水胁迫过程中表达稳定的内参基因,使不同胁迫处理下荷花目标基因的定量更为准确。以不同淹水胁迫时间的荷花叶片为材料,利用实时定量PCR技术验证5个植物常用内参基因,包括18S rRNA(18S)、actin(ACT)、elongation factor 1α(EF1α)、Histone H3(HIS)及β-tubulin(TUB)的表达水平,结合GeNorm、NormFinder和BestKeeper软件对结果进行分析,对其表达稳定性进行评价。将优选的2个内参基因(18S和ACT)应用于荷花转录因子基因ERFB2-1(ethylene responsive factor B2-1)和ERFB2-2的淹水胁迫表达,结果显示表达趋势一致,验证了可靠性。本研究对荷花淹水胁迫过程中关键基因表达的qRT-PCR分析有重要的应用价值。
关键词:荷花;淹水胁迫;qRT-PCR;内参基因
中图分类号: S682.320.1 文献标志码: A 文章编号:1002-1302(2019)17-0050-04
荷花(Nelumbo nucifera)是莲科莲属的多年生挺水植物,是我国十大名花之一[1]。荷花原產我国,具有分布范围广、种质资源丰富、群体花期时间长及叶色碧绿等特点,深受人们的喜爱,加上经济用途广泛,文化底蕴深厚,因而成为极好的水景美化植物和家庭园艺常用植物[2]。荷花是一种水生花卉,环境的变化使荷花时常要面对淹水胁迫影响[3],因此,耐淹水胁迫资源和基因的挖掘是荷花育种目标之一。
随着分子生物学的不断发展,功能基因研究已成为植物耐胁迫育种的重要辅助手段,而基因的表达分析则是植物功能基因研究的基础[4-5]。在比较耐淹荷花品种和淹水敏感型荷花品种功能基因差异表达的研究过程中,较多的涉及到应用实时定量PCR(quantitative real-time PCR,简称qRT-PCR)验证和分析基因的表达模式和水平,为了校正不同样本RNA提取效率、质量、反转录及扩增效率上的差异,试验中需要用到在实验条件下细胞中能够恒定表达的基因也就是内参基因作为标准[6-7],因此,筛选淹水胁迫条件下稳定表达的内参基因对qRT-PCR试验结果的可靠性有着关键的作用。
迄今,国内外对黄花蒿[8]、天蓝苜蓿[9]、牡丹[10]等多种植物在不同试验条件下进行了内参基因的筛选,对荷花花瓣着色过程中内参基因的稳定性也有研究报道[11],但对荷花在淹水胁迫条件下内参基因的筛选则没有报道。本研究选取了植物研究中常用的内参基因18S核糖体RNA(18S)、肌动蛋白(ACT)、转录延伸因子(EF1α)、组蛋白H3(HIS)及微管蛋白(TUB)作为候选基因,研究荷花不同淹水胁迫时间下这5个基因的表达,利用内参基因稳定性参考软件BestKeeper[12]、GeNorm[13]及NormFinder[14]对其稳定性进行了评价,为后续探索荷花耐淹水胁迫条件下的基因表达分析提供依据。
1 材料与方法
1.1 试验材料
以2015年9月在河北白洋淀原生境收集的荷花“白洋淀红莲”种子为材料,种子晒干后保存。2017年5月,对种子尾部破壳,在25 ℃及16 h/d光照条件下浸种,胚轴发生1~2周后,选取芽长度一致的小苗用于淹水胁迫试验。淹水试验在培养箱内的水桶中进行,以小苗全部浸没水中为处理组,淹水胁迫时间为1、2、4、12 h,以未淹水处理荷花幼苗作对照。采集叶片,液氮速冻后置于-80 ℃冰箱保存备用。
1.2 叶片总RNA提取及cDNA第一链合成
叶片总RNA提取方法参照上海生工生物工程有限公司(简称上海生工)柱式植物总RNA抽提纯化试剂盒(产品编号:B518661-0100)。利用琼脂糖凝胶电泳及Nano drop2000检测总RNA质量。cDNA第一链合成采用上海生工M-MuLV第一链cDNA合成试剂盒(产品编号:B532435-0020)。反转录后经Nano drop检测,稀释至20 ng/μL,放置于-20 ℃冰箱保存备用。
1.3 内参基因选择及qRT-PCR引物设计
选择常用的5个荷花看家基因作为内参候选基因,包括18S、ACT、EF1α、HIS及TUB(表1),根据qRT-PCR引物设计原则,采用Beacon Designer 7软件设计引物,并在NCBI-BLAST上对引物进行特异性检测,引物由生工生物工程(上海)股份有限公司合成。合成片段经普通PCR扩增,凝胶电泳检测,并经熔解曲线分析验证后,用于qRT-PCR试验。
1.4 内参基因RT-PCR试验及数据分析
内参基因的RT-qPCR试验在枫岭FTC-3000 Real-Time PCR仪完成,反应参照上海生工2×SG Fast qPCR Master Mix试剂盒(产品编号:B639271-0005)。反应体系:2×SG Fast qPCR Master mix 10 μL,上、下游引物各0.5 μL(10 μmol/L),cDNA模板1 μL,DNF Buffer 2 μL,ddH2O补充至20 μL。每个样本重复3次,扩增程序:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,40个循环。反应结束后,进行熔解曲线分析。所得结果分别采用GeNorm、NormFinder和BestKeeper软件进行分析。
2 结果与分析
2.1 叶片总RNA提取质量及引物特异性鉴定
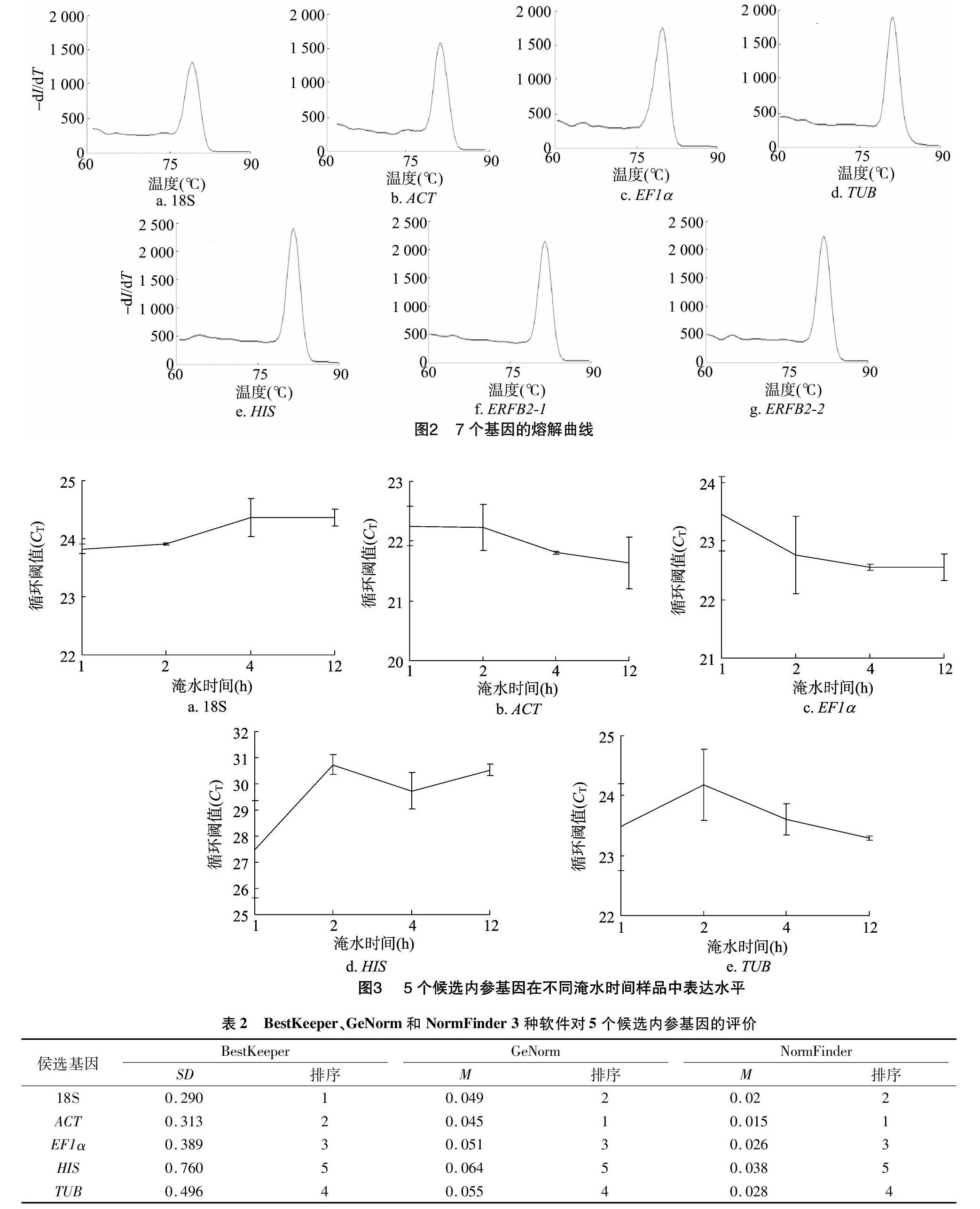
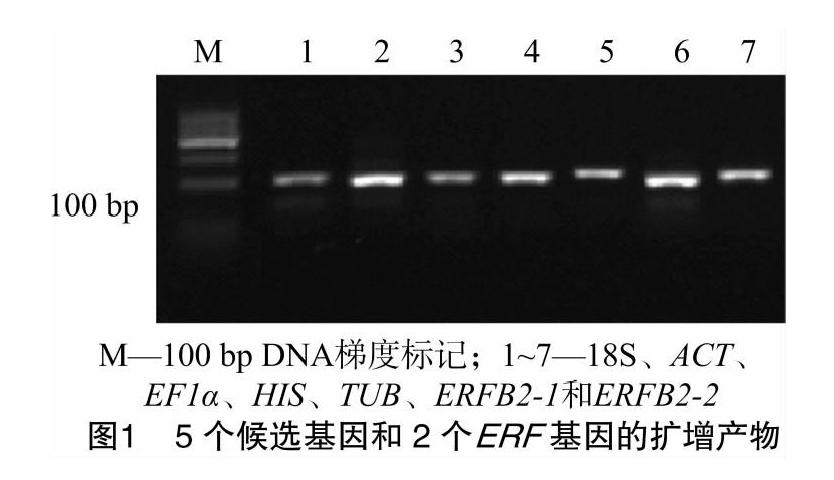
Nano drop2000检测显示,提取总RNA的D260 nm/D280 nm数值为1.9~2.0,符合后续试验要求。以对照叶片cDNA为模板,采用表1的7对引物对5个候选基因及2个ERF转录因子基因进行PCR扩增,凝胶电泳结果显示扩增产物单一,且片段大小均在100 bp左右(图1),与预期扩增大小一致。进一步对cDNA进行qRT-PCR扩增,结果发现各基因的熔解曲线只有明显的单一信号峰(图2),说明7对引物均可特异扩增相应片段,其反应特异性高,结果可靠,可用于后续试验。
2.2 內参基因的表达稳定性分析
2.2.1 候选基因CT值 CT值与基因表达量成反比,CT值越大,表达量越小。图3为5个候选内参基因在淹水胁迫处理不同时间后,在荷花叶片中qRT-PCR反应的CT值。结果
表明,5个看家基因的CT值为21~32,其中,ACT的CT值最小,为21.244 1~22.666 2,说明该基因平均表达水平最高;HIS的CT值最大,为27.498 5~31.136 1,说明该基因平均表达水平最低,且其表达量要明显低于另外4个候选基因。
2.2.2 软件分析候选内参基因表达稳定性 BestKeeper、GeNorm和NormFinder是3种常用的内参基因稳定性分析软件。表2为3种软件对5个候选内参基因在荷花叶片不同时间淹水胁迫处理时间下qRT-PCR反应的表达量稳定性分析结果。BestKeeper根据内参基因的CT值计算标准偏差(SD),SD值越小,则表示该基因稳定性越好,根据该软件分析结果,18S与ACT的SD值最小,表明二者的表达量在荷花淹水胁迫处理过程中最为稳定,其次为EF1α和TUB,而HIS的表达稳定性较差。GeNome根据平均表达稳定性指数M确定最稳定的内参基因,M值越大,基因的稳定性越低,根据该软件分析结果显示,ACT的M值最小,表达稳定性最高,其次为18S,HIS的M值最大, 表达稳定性最差。NormFinder使用Excel软件计算基因的稳定值M,M值越小,则该基因越稳定,该软件分析结果与GeNome一致,5个内参基因稳定性从高到低排序为ACT>18S>EF1α>TUB>HIS。综合表现看,ACT和18S为淹水胁迫不同时间处理下表达量最稳定的2个基因。而HIS在荷花淹水胁迫过程中表达最不稳定。
2.2.3 优选内参基因稳定性验证 为进一步验证优选内参基因基因18S和ACT在荷花淹水胁迫过程中对qRT-PCR计算结果的影响,分别以18S和ACT为内参基因,以淹水胁迫1、2、4 h的荷花白洋淀红莲幼苗为材料,未淹水材料为对照,采用qRT-PCR检测了荷花ERFB2-1和ERFB2-2基因在不同胁迫时间处理下的表达情况。结果如图4所示,随着淹水胁迫时间的延长,ERFB2-1表达量先明显增加,后呈现先减少再增加的趋势;而ERFB2-2的表达量则较为稳定。以18S为内参时,目的基因ERFB2-1和ERFB2-2在荷花不同时间淹水胁迫处理下表达模式与以ACT为内参时的变化规律一致。
3 讨论与结论
qRT-PCR技术以内参基因作为标准校准目的基因的表达量,具有灵敏度高、重复性好的特点,目前已成为研究中检测或比较基因表达水平的标准技术[12]。在植物研究中,ACT、EF1α等是常用的内参基因,但近年来越来越多的研究显示,真正恒定表达的基因不存在,胁迫条件不同,内参基因的稳定性也不尽相同。如大豆在干旱胁迫条件下,稳定表达的基因为TUB和EF1α[13];在盐胁迫下稳定的内参基因则为ACT[14];低磷胁迫下则是18S和TUB最为稳定[15]。因此,qRT-PCR试验前提是选择合适的内参基因,以确保在不同因素下基因相对表达量结果的可靠和稳定。
本研究分析了荷花白洋淀红莲在淹水胁迫下内参基因的稳定性,结果显示,GeNorm和NormFinder的分析结果一致,而与BestKeeper的分析结果存在差异,虽然3种软件分析结果略有不同,但对大部分候选基因稳定性的分析结果一致,其中HIS在淹水胁迫不同时间表达差异较为剧烈,而18S和ACT在荷花淹水胁迫过程中表达相对稳定。18S核糖体RNA由于在植物体内表达稳定、丰度高,而被认为是合适的内参基因。但近期有研究显示,在部分植物,如小麦、苜蓿中,18S的CT值均小于15,表达丰度过高,容易忽视背景造成的差异从而影响基因定量的准确性[16]。本研究试验条件下,荷花叶片18S的CT值在24左右,表达丰度适中,适于作为内参基因。而ACT则是最为常用的内参基因,在荷花花瓣色素形成过程中也是最稳定的内参基因之一[11]。本研究中,以18S和ACT分别作为内参时,2个目的基因表达趋势均一致,说明在荷花淹水胁迫qRT-PCR试验过程中,以18S或ACT作为内参基因具有可靠性。
综上所述,本研究认为,在运用qRT-PCR技术研究荷花淹水胁迫下基因表达时,可选用18S或ACT作为内参基因。本研究结果为进一步分析关键基因在荷花应对淹水胁迫中的作用研究提供了参考。
参考文献:
[1]中国科学院武汉植物研究所.中国莲[M]. 北京:科学出版社,1987:1-3.
[2]王其超,张行言. 中国荷花品种图志[M]. 北京:中国林业出版社,2005:7-9.
[3]李祥志,刘兆磊,陈发棣,等. 荷花耐深水评价体系及耐深水鉴定[J]. 安徽农业科学,2014,42(3):679-682.
[4]Huggett J,Dheda K,Bustin S,et al. Real-time RT-PCR normalisation; strategies and considerations[J]. Genes and Immunity,2005,6(4):279-284.
[5]Postollec F,Falentin H,Pavan S A,et al. Recent advances in quantitative PCR (qPCR) applications in food microbiology[J]. Food Microbiology,2011,28(5):848-861.
[6]Suzuki T,Higgins P J,Crawford D R. Control selection for RNA quantitation[J]. BioTechniques,2000,29(2):332-337.
[7]Bustin S A,Benes V,Garson J A,et al. The MIQE guidelines:minimum information for publication of quantitative real-time PCR experiments[J]. Clinical Chemistry,2009,55(4):611-622.
[8]周良云,莫 歌,王 升,等. 基于實时荧光定量PCR对镉处理下黄花蒿内参基因稳定性的分析[J]. 中国中药杂志,2014,39(5):777-784.
[9]张德辉,孙亚丽,赵 亮,等. 天蓝苜蓿锌胁迫下实时定量PCR内参基因筛选[J]. 中国环境科学,2015,35(3):833-838.
[10]Li J,Han J,Hu Y,et al. Selection of reference genes for quantitative real-time PCR during flower development in tree peony (Paeonia suffruticosa Andr.)[J]. Frontiers in Plant Science,2016,7:516.
[11]王彦杰,陈叶清,薛泽云,等. 荷花花瓣着色过程实时荧光定量PCR内参基因的筛选及验证[J]. 南京农业大学学报,2017(3):408-415.
[12]杨 苓,胡晓静,徐志峰,等. 桃蛀螟实时荧光定量PCR内参基因的筛选[J]. 昆虫学报,2017,60(11):1266-1277.
[13]刘伟灿,王 骐,周永刚,等. 大豆干旱胁迫下miRNA与mRNA荧光定量PCR内参基因的筛选[J]. 西北农林科技大学学报(自然科学版),2016,44(2):61-67.
[14]姜 琼,王幼宁,王利祥,等. 盐胁迫下大豆根组织定量PCR分析中内参基因的选择[J]. 植物学报,2015,50(6):754-764.
[15]陈玉连,张 涛,董登峰. 低磷胁迫大豆RT-qPCR内参基因的筛选及谷胱丙肽合成代谢酶的表达[J]. 广西植物,2017,37(8):1008-1018.
[16]周晓馥,王 晶,史宏伟,等. 18S rRNA作为植物实时荧光定量PCR内参基因的探究[J]. 吉林师范大学学报(自然科学版),2016,37(2):115-119.

