微粒观视域下提升“电解池”复习效率初探
王丽华,苏殿钊,张英锋
秦皇岛市第一中学,河北 秦皇岛 066006
高中化学;微粒观;电解池;模型
一、问题的提出
电化学知识属于能量转换的一部分内容,它能帮助学生深刻理解能量是可以在不同的形式间进行转化的,在转化的过程中保持着能量守恒。通过电化学的学习,可以培养学生正确的能量观,帮助学生树立节约能源的意识,激发学生发散思维,能创造出效能更好的能量转化装置,以解决现在能源紧张的状况。我们知道现代的三大经济支柱分别是“能源”“信息”和“材料”,因此能源的相关习题是人们关注的焦点。回顾近几年的高考试题(全国Ⅰ卷),每年都有电化学的习题出现(如表1),电化学习题不但是考试的重点,同时也是高考的高频点内容。做好电化学的复习意义重大。

表1 2012年—2018年全国Ⅰ卷电化学习题考查情况
二、从微粒观的角度重新审视电解池
复习课的作用不仅仅是基本知识的再现,它还肩负着对所学知识再认识的作用。通过复习课能把以前没有弄明白的内容弄清楚,通过复习课把知识的外延进行扩深,引领学生从多个角度来体会所学内容的本质特征,以便在今后的考试中能够灵活运用所学的知识来解答问题。在高三复习中,我们如何帮助学生深刻理解电化学知识呢?我们知道电化学的知识实际上是氧化还原反应知识的延续,它充分利用了氧化还原反应中电子转移的这一特征,把氧化剂和还原剂放在特定的装置中实现化学能与电能、电能与化学能的相互转化。我们就抓住这一特征,在电化学复习中,引导学生从微观粒子(电子和离子)的角度重新审视电化学内容,帮助学生深刻领会电化学的内涵,起到提高复习效率的作用。下面就以电解池的复习为例来做进一步探究。
(一)从导电微粒的角度看电解池的构成
我们在学习电解池的构成条件上主要是从以下四个方面来看的:(1)有没有直流电源(2)电极材料(3)电解质溶液(4)闭合回路。这些判据主要是从宏观的角度来分析的,学生对于电化学装置认识程度不够深刻,以至于学生碰到2016年的北京试题时(如表2),有很多学生不知如何去做。
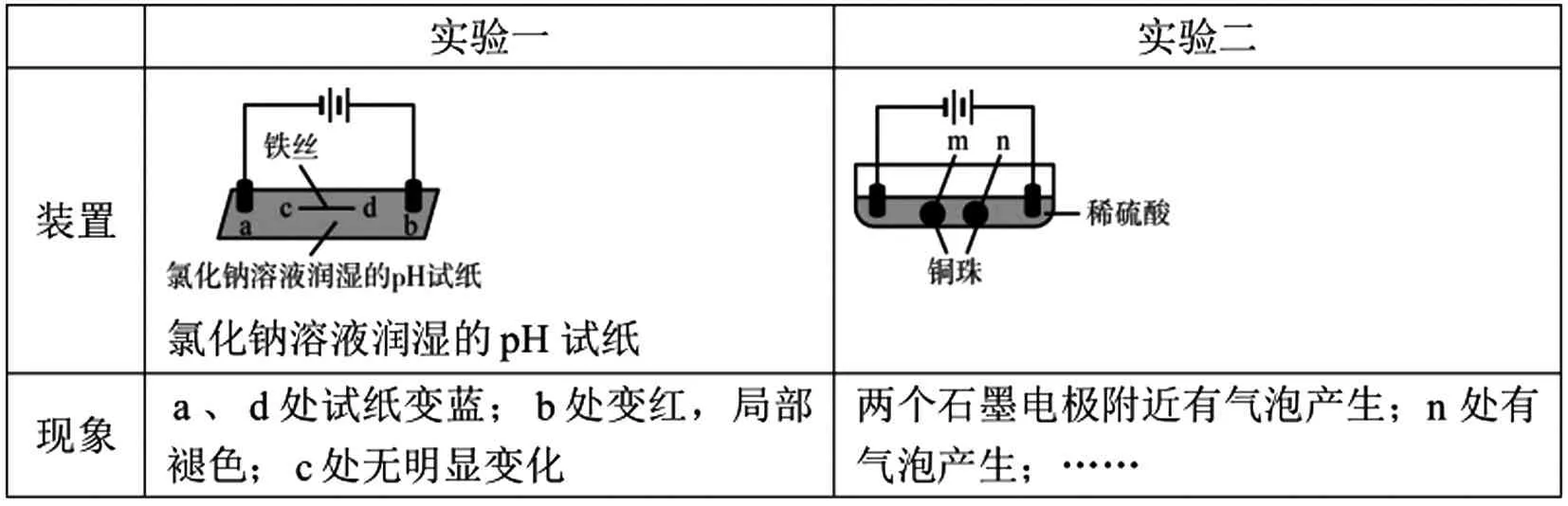
表2 (北京2016年高考理综12题)用石墨电极完成下列电解实验
下列对实验现象的解释或推测不合理的是:
A.a、b处:2H2O+2e—=H2↑+2OH—B.b处:2Cl—-2e-=Cl2↑
C.c处发生了反应:Fe-2e—=Fe2+D.根据实验一的原理,实验二中m处能析出铜
学生很容易判断出此题中的装置是电解池装置:一是题干中说是“用石墨电极完成下列电解实验”,二是装置中有明显的外加电源符号。但是装置是如何工作的,学生分析起来比较头疼,因为他们不清楚在两个电极之间放上一段金属或是铜球有什么用,从而造成此题解答起来很困难。造成这种现象的原因主要有两点:一是在平时的练习中我们见到的基本上都是典型的电解池的串联,没有碰到这种变式习题;二是在讲电解池的构成条件时,都是电极材料与电源的正负极直接相连或是多个电解池的串联(如图1)。
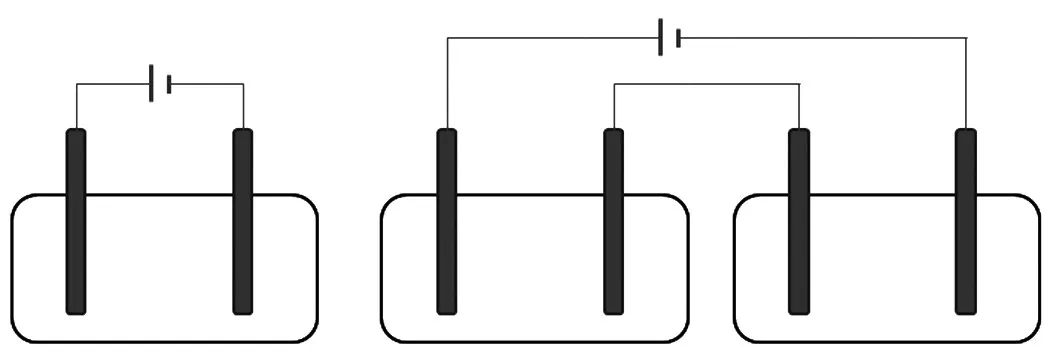
图1 基本的电解池和电解池的串联图
在分析电解池的装置构成条件时,如果从导电微粒的角度分析也许此题的难度就会有所降低。
我们知道,构成电解池的反应可以是自发进行的反应,也可以是非自发进行的反应,只要提供合适的电源、适宜的电极材料和电解质溶液,在“高压”下就能实现电能到化学能的转化。在电解池中,阳极区域发生氧化反应即失去电子的过程,阴极区域发生还原反应即得到电子的过程。还原剂在阳极上失电子,失去的电子从阳极流出,经外电路流到阴极上,被氧化剂获得,内电路靠电解质溶液中自由移动的阴、阳离子导电,从而构成闭合回路,使得电解反应能够持续反应下去,从而实现电能到化学能的转化。如果从导电微粒的角度看电解池的组成,可以得出这样的结论,电解池实际上是由两类导体组成即电子导体和离子导体。外电路是由电子导体组成(除外加电源外),靠的是自由移动的电子形成电流;内电路是由离子导体组成(即电解质溶液),靠的是自由移动的阴阳离子的运动形成电流。这样电解池的组成就可以总结为:电子导体(电极)→外加电源→电子导体(电极)→离子导体→电子导体。如果我们把外加电源单独拿出作为一个条件的话,构成电解池的另一个条件就可以简化为“电子导体→离子导体→电子导体”。从而判断电解池就变得简单些了。(如图2所示)
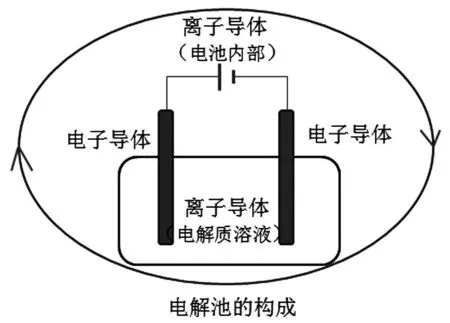
图2 电解池的构成
我们来看北京试题实验一装置(如图3)。我们可以做如下分析。
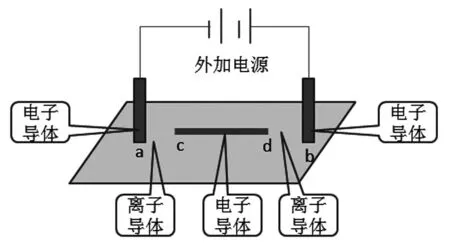
图3 “实验一”装置分析
在此装置中有外加电源,具备了构成电解池的一个条件,另外一个构成条件分析如下:
a→c:电子导体→离子导体→电子导体;这是一个电解池装置;
d→b:电子导体→离子导体→电子导体;这又是一个电解池装置。因此此装置就可以看成是两个电解池装置的串联,再根据外加电源的正负极连接方式,很容易判断出电解池的阴阳极以及各个电极的电极反应式,此题就会很容易解答出来。
同理可以分析出:“实验二”实际上是三个电解池的串联装置。
(二)从微粒的放电顺序看电解原理
我们知道电流是最强的氧化剂也是最强的还原剂,它可以让很多不能发生反应的反应发生。因此,电解池在工业生产中有着重要的应用。例如,电解池可以用来冶炼金属、精炼金属、电镀、氯碱工业,等等。在新授课的时候,很多教师还会讲解电解规律并总结一些电解口诀如“放氧生酸”“放氢生碱”等。面对这些知识,学生有时觉得内容太多不太好记,从而产生畏惧情绪,直接影响学生的学习兴趣。
在电化学学习过程中,学生感到困难的地方就是找不准放电的微粒有哪些?它直接影响着学生对电极反应式的书写。电极反应式是电化学的核心,不了解电极反应,就弄不清它的反应原理,对于解题而言就是一头雾水。如何帮助学生突破这一难点呢?教师可以从电解池的反应本质入手即微粒的放电顺序,帮助学生深入理解电解池的实质,从而达到突破难点的目的。
把溶液中常见的微粒用数轴的方式进行排列,排列的依据就是他们的放电顺序即阳离子的氧化性顺序和阴离子的还原性顺序。我们常用的电解质溶液是水做溶剂的,因此我们以水电离出的氢氧根离子和氢离子为界限,把离子分为四部分(如图4),然后进行讨论微粒的放电情况,从而顺利地写出电极反应式。
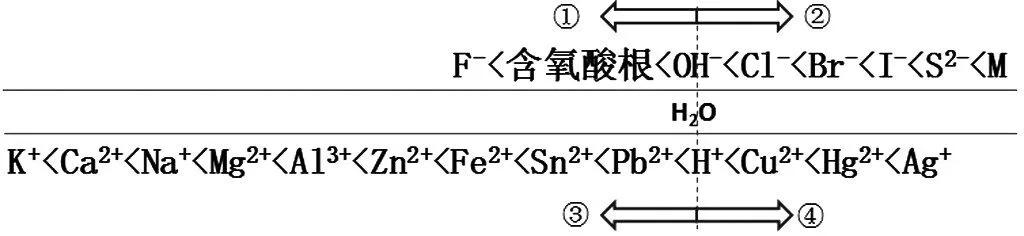
图4 微粒的放电顺序
我们以惰性电极进行电解为例,探讨放电顺序(见表3)。
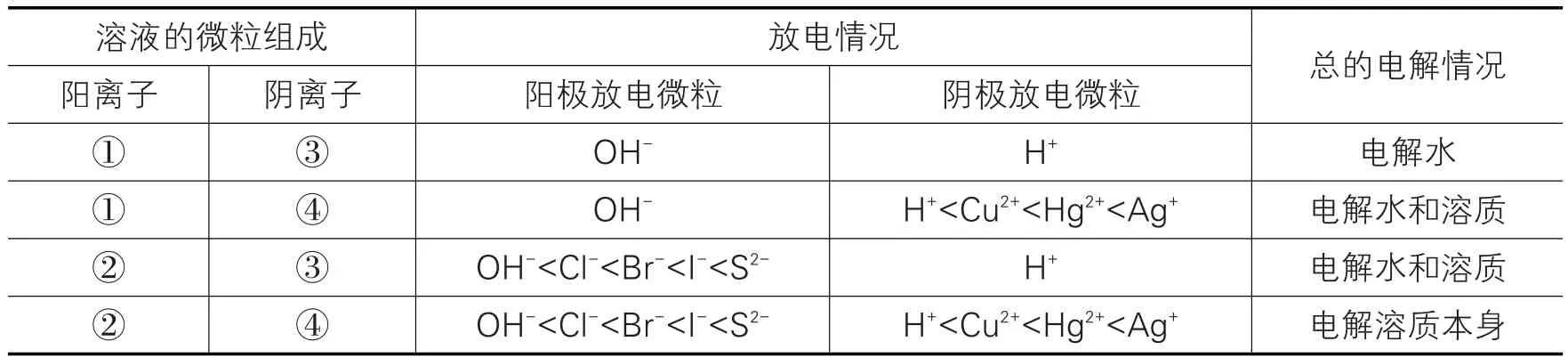
表3 惰性电极电解放电顺序
通过以上分析,我们可以看到,如果溶液中含有①、③部分中的离子,由于水电离出的OH-和H+的存在,一般情况下轮不到它们放电,离子的放电主要集中在②、④两部分,这样我们在研究电解习题时,就比较简单了。
例如:我们用惰性电极来电解硫酸铜和氯化钠的混合液。已知硫酸铜和氯化钠的物质的量为1∶1。试分析电解的情况。
【分析】硫酸铜和氯化钠都是强电解质,它们在溶液中能够完全电离。假设溶液的体积为1L,它们的物质的量分别为1mol,我们分析电解过程。
(1)首先分析出溶液中各微粒的物质的量:n(Cu2+)=1mol、n(SO42-)=1mol、n(Na+)=1mol、n(Cl—)=1mol。溶液中还有水电离出来的氢离子和氢氧根离子。
(2)我们把这些离子进行分类,同时排出它们的放电顺序(见表4)。

表4 硫酸铜、氯化钠电解放电顺序
说明:SO42-和Na+属于分类中的①和③中离子,因此它们不放电。
(3)讨论:(根据离子放电顺序,分情况讨论,见表5)
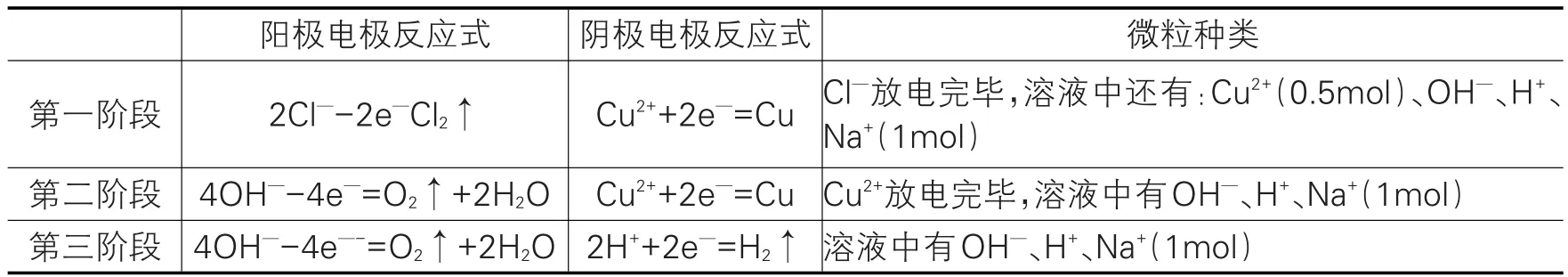
表5 硫酸铜、氯化钠离子放电顺序阶段讨论
(4)结论:在电解物质的量为1∶1的硫酸铜溶液和氯化钠溶液过程中,一共分为三个阶段。
此题从微粒的放电顺序出发,很容易分析清楚电解的详细过程。
(三)从电子守恒看物质变化的量的关系
电化学中一个重要的定律就是法拉第定律。法拉第定律是描述电极上通过的电量与电极反应物重量之间的关系的,又称为电解定律,是电解过程中遵循的基本定律。为了简单起见,一般我们只是寻找电解池的阴极和阳极上通过的电量。只要找到两极上得失电子的物质,然后我们列出电子守恒关系式,此类习题即可得到解决。
例如:如图所示的装置,闭合开关一段时间后,再断开,请回答问题(如图5)。在此过程中:
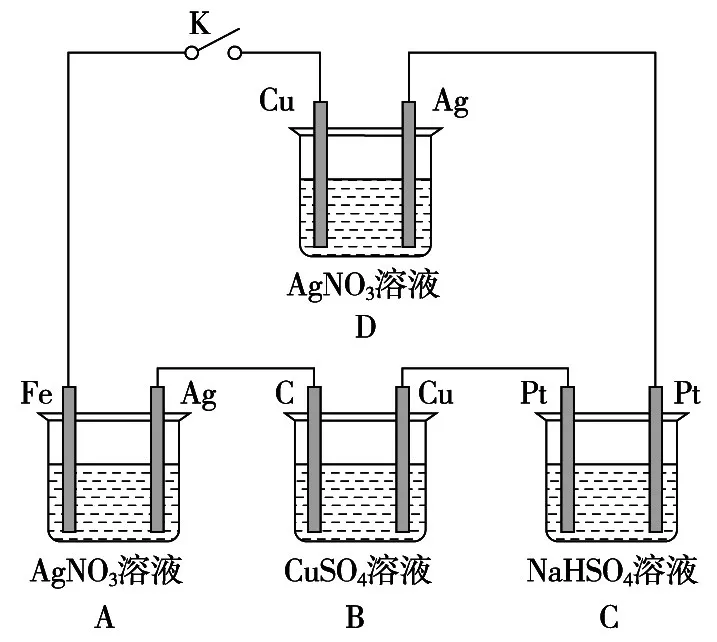
图5 闭合电路状态分析
(1)A中发生反应的离子方程式是______________,其中Fe电极的名称是________。
(2)若B中溶液仍为蓝色,其中一电极增重1.6g,则增重的是B中的________(填“C”或“Cu”)电极,电解后溶液的pH为________;要使电解后溶液恢复到电解前的状态,则需加入________(填化学式),其质量为________g。(假设电解前后溶液的体积500mL不变)
【分析】(1)图A是活泼性不同的两个电极插入电解液中形成闭合回路,故A为原电池装置,Fe为负极,Ag为正极,总反应的离子方程式为Fe+2Ag+======2Ag+Fe2+。
(2)图B为电解池,C为阳极,Cu为阴极,电解硫酸铜溶液,阳极反应为4OH--4e-======2H2O+O2↑,故阳极质量不变;阴极反应为Cu2++2e-======Cu,质量增加。电解池反应中,阳极失电子数目=阴极得电子数目,Cu电极增重1.6 g,则转移电子0.05 mol,阳极消耗n(OH-)=0.05 mol,故溶液中的同时阳极放出0.4 g O2,电解液要恢复到原状态,需加入2 g CuO。
(四)从微观粒子的运动来建立电解池的模型
在化学核心素养中有“数据推理与模型认知”这一素养。通过培养学生的模型认知,可以帮助他们把深奥的原理模型化、形象化,从而抓住电解的微观本质,深刻领会电解的内涵。在头脑中形成电解的模型后,可以引领学生在遇到陌生的电解习题时,能够保持头脑清晰,从容应对。以下是电解池的模型,它清晰地展示出了电解过程中微粒的运动情况以及变化情况(如图6)。
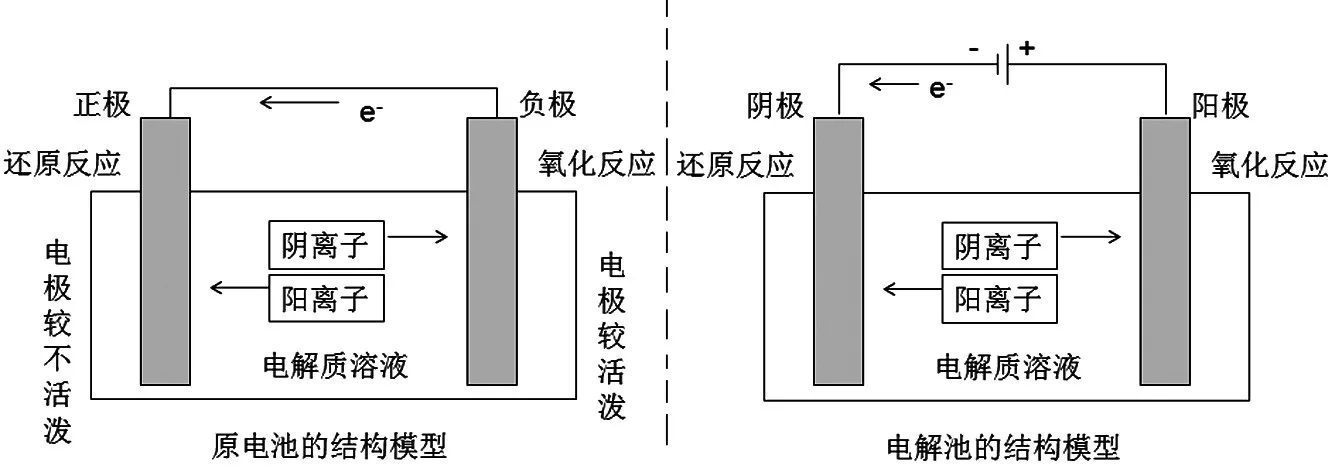
图6 电解过程中微粒运动分析
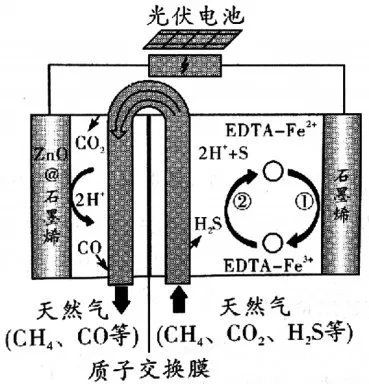
图7 石墨烯电极区反应
例如2018年全国Ⅰ卷第13题。最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图7所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是:
A.阴极的电极反应:CO2+2H++2e-=CO+H2O
B.协同转化总反应:CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
【分析】此题中的“最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。”就是习题的外衣即“情境素材”,它主要是向学生展示我国在处理天然气中的杂质方面所取得的成就,从而培养学生的爱国主义热情。接着往下看,“示意图”“电极”“电极区反应”等关键的词语,实际上就是展示出此题的考查内容即“电化学”。这样此题的灵魂也就抓住了。在观察示意图时,其中的“光伏电池”就暴露了本题运用的原理,即电解池装置。根据自己所学的电解池装置结构模型,梳理本题的解题过程。
【解题过程:看左边电极,根据图形提示可知发生的变化为CO2→CO,属于还原反应,根据电解池的原理结构模型可知,左边电极发生还原反应的为阴极,同理右边的电极为阳极。这样此电解池装置就分析清楚了。逐步分析选项A阴极反应的电极反应式是正确的,B选项阴阳两极的电极反应式相加即可得到总反应,C选项石墨烯电极为阳极,与电源的正极相连,因此石墨烯上的电势比ZnO@石墨烯电极上的高,C错误;D选项由于铁离子、亚铁离子均易水解,所以采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需要酸性,D正确。答案选C。】
通过刚才分析,我们很容易把此题变为熟悉的电解池,然后把题中的示意图和电解池的结构模型进行比对,找到它们的对应关系,此题就得到很好的解决。
三、反思
电解池是电化学知识的一部分,它在工业生产中有着极其重要的作用,因此人们对电解池的关注程度很高。在练习题中有关电解的习题也比较多,再加上电解池的习题形式多种多样,经常和工业生产紧密联系,因此很多学生感到此部分内容比较困难。在复习过程中,我们一定要从宏观上帮助学生对所学内容有一个感性认识,更重要的是从微观的角度帮助学生理解电解池的反应本质。从微粒观的角度来分析电解池的有关内容,可以培养学生深刻地把握电解的本质,对于提升复习效率能起到良好的促进作用。当然,用微粒观来解决电解的实际问题,有时也不是像我们想象的那样简单。比如溶液中的微粒的放电顺序受多种因素的影响,我们不能把离子的放电顺序固化,应该具体问题具体分析。

