生物质炭与噬菌体联用阻控与灭活土壤–生菜体系中抗生素抗性致病细菌①
赵远超,叶 茂,孙明明,张忠云,黄 丹,朱国繁,3,郑晓璇,晁会珍,冯彦房,武 俊*,胡 锋,蒋 新
生物质炭与噬菌体联用阻控与灭活土壤–生菜体系中抗生素抗性致病细菌①
赵远超1,2,叶 茂2*,孙明明1,张忠云2,黄 丹2,朱国繁2,3,郑晓璇1,晁会珍1,冯彦房4,武 俊1*,胡 锋1,蒋 新2
(1 南京农业大学资源与环境科学学院,南京 210095;2 中国科学院土壤环境与污染修复重点实验室(中国科学院南京土壤研究所),南京 210008;3 合肥工业大学资源与环境工程学院,合肥 230009;4 江苏省农业科学院农业资源与环境研究所,南京 210014)
农田土壤–蔬菜体系中残留和滋生的多种抗生素抗性致病细菌已对人体健康和生态环境安全造成较严重的隐患,因此开展针对性的风险管控技术研究十分迫切。生物质炭阻控与农业噬菌体疗法联用靶向灭活土壤–蔬菜体系中抗生素抗性致病细菌,为解决此类污染土壤问题提供了全新途径。本研究以自主制备的抗生素抗性致病细菌(携带四环素抗性基因W的大肠杆菌K12,携带氯霉素抗性基因C的铜绿假单胞菌PAO1)污染农田土壤为盆栽用土,开展生菜土培试验60 d。设置单独或同时添加生物质炭和接种广宿主型噬菌体(YSZ 5K)的不同处理,以土壤–生菜体系中K12、PAO1数量变化及W、C丰度消减程度表征联合修复的效果。结果表明,针对土壤–生菜体系中残留K12、PAO1和W、C消减程度变化,判断不同处理效果,依次为:BP(生物质炭与噬菌体联用)> B(单独施用生物质炭)>P(单独接种噬菌体)> CK(对照),其中BP处理条件下,K12与PAO1在土壤和生菜叶片中数量较之对照处理下降了2.1 ~ 3.1个数量级,W和C丰度较之对照处理下降了2.2 ~ 3.3个数量级。此外,在BP处理条件下,生菜收获后,土壤微生物群落结构与功能多样性和稳定性指数也得到显著提升,证明该联合治理方式是一种较为环境友好的修复技术。本研究结果可为降低土壤–蔬菜体系中抗性致病细菌的残留风险提供科学的理论依据和有效的管控技术。
土壤–蔬菜体系;生物质炭;农业噬菌体疗法;抗生素抗性致病细菌
由于抗生素类兽药的滥用、畜禽粪便安全化处理技术的不足及环境管理的缺失,中国及世界范围内许多国家的城郊畜牧业养殖厂周边农田土壤-蔬菜系统,常成为残留和滋生抗生素抗性细菌(antibiotic resistance bacteria,ARB)和抗性基因(antibiotic resistance genes,ARGs)的高风险热点“源”和“汇”,尤其是在大量环境中可移动基因元件(质粒、整合子、转座子)水平转移或垂直转导的促进作用下,一些人畜共患抗生素抗性致病细菌的扩散传播风险更会大大增加,同时给人体健康和生态安全带来了极为严重的潜在威胁[1-2]。因而,开展针对性降低风险的阻控技术和消除风险的生物靶向灭活技术研发已十分迫切和必要。
生物质炭(biochar)是一种多孔隙、吸附能力强、可提供土著微生物着床的环境友好型功能材料[3]。有研究表明,在畜禽养殖场周边农田土壤、医疗废弃物处理厂和垃圾填埋场周边覆土中,添加生物质炭可高效广谱性协同阻控多种ARB和ARGs在土壤-植物体系中的传播路径、传播频率和传播距离,环境中ARB和ARGs的扩散风险在生物质炭的阻隔、吸附、促消减作用下得到有效降低[4-6]。然而,基于生物质炭的阻控技术虽可以显著降低风险,但并未从根本上消除风险。仍然需要进一步研发深度灭活土壤-植物体系中抗生素抗性致病细菌的生物靶向修复技术。
噬菌体疗法的出现为解决上述问题提供了一种全新途径。细菌噬菌体(简称噬菌体)是一类专属性捕食活体宿主细菌而存活的生物体,在土壤、水、空气乃至人和动物体表或肠道内均广泛分布,据估算其总量达到1031数量级[7-8]。噬菌体疗法是指通过分离、筛选、纯化和富集宿主细菌的专属噬菌体之后,向污染土壤-植物体系中添加特定噬菌体菌液,定向侵染并灭活抗性致病细菌的修复方式[9-11]。已有学者成功将噬菌体疗法应用在灭活葡萄、辣椒、番茄等果蔬的植物病害细菌或人畜共患致病细菌的食品安全保障领域[12-14]。此外,前期研究常认为噬菌体仅限于侵染某一“种”类的宿主细菌,但近年来学术界越来越多的发现:噬菌体经过适当的基因改造或人工加速定向驯化后,可针对同一“属”内几种高度同源性的宿主细菌,甚至针对不同种属之间的宿主细菌也具有一定广谱性捕食区间[15-17]。这为噬菌体疗法进一步广泛应用奠定了坚实的理论基础。
基于上述研究背景,本研究将自主制备复合抗生素抗性致病细菌污染土壤,模拟实际污染土壤现状,进行生菜土培试验。探究单独及联合使用生物质炭阻控技术和广宿主型噬菌体疗法灭活技术,协同消除土壤-生菜体系内复合抗性致病细菌的过程与效果。同时基于修复过程中土著细菌群落结构组成和功能多样性变化,综合评价此联合修复技术的环境效应。本研究结果可为同步高效阻控和深度靶向灭活农田土壤-蔬菜体系中多种致病细菌的环境风险,提供环境友好、行之有效的生物修复技术,具有广泛应用前景。
1 材料与方法
1.1 试验材料
1.1.1 供试品种 生菜为意大利全年耐抽苔生菜(L.),河北金发种业有限公司。
1.1.2 供试土壤 采自南京城郊某奶牛场(32°30′ 45″N,118°94′7″E)附近农田土壤,采用五点取样法,取0 ~ 10 cm的表层土壤,于暗处4 °C冷藏保存。测定土样基本理化性质[18]:沙粒238 g/kg,壤粒454 g/kg,黏粒318 g/kg,pH 7.7,全氮1.7 g/kg,水溶性氮1.7 g/kg,全磷1.3 g/kg,全钾17.5 g/kg,CEC 19.4 cmol/kg。
1.1.3 供试生物质炭 由江苏省农业科学院面源污染治理与水体修复研究室提供,以玉米秸秆为原料,300 ℃高温烧制,测定其基本理化性质[19]:全碳556.4 g/kg,全氮13.6 g/kg,C/N 35.6,灰分186.5 g/kg,全磷2.3 g/kg,全钾11.6 g/kg,pH 9.5。
1.1.4 供试菌株 携带四环素抗性基因W和绿色荧光蛋白(green fluorescent protein,GFP)基因的大肠杆菌K12(K12)与携带氯霉素抗性基因C和红色荧光蛋白(red fluorescent protein,RFP)基因的铜绿假单胞菌(PAO1)及广宿主型噬菌体YSZ 5K(头长径约110 nm,横径约80 nm,尾长约120 nm;最佳感染复数MOI = 0.1)均为南京农业大学土壤生态实验室提供。
1.1.5 试验仪器与试剂 激光扫描共聚焦显微镜(Leica DM 5000B),实时荧光定量PCR仪(Applied Biosystems StepOnePlusTM),BIOLOG(MicroStation TM,型号:14060316,华粤行仪器有限公司),恒温培养箱,Luria-Bertani(LB)培养基。
1.2 试验设计
本研究采用温室盆栽试验,每个盆钵称取8 kg供试土壤,每个盆钵中同时接种100 ml浓度为107cfu/ml的K12(GFP,W)和PAO1(RFP,C)菌液,制备获得原始抗性致病细菌污染土壤。设有4组处理:①对照组(CK):每盆种植3棵生菜(在种子上覆土0.5 ~ 1 cm,室温18℃±2℃);②生物质炭处理(B):在对照组基础上添加生物质炭(10 g/kg);③噬菌体处理(P):在对照组基础上接种100 ml浓度为108pfu/ml的广宿主型噬菌体YSZ 5K;④生物质炭和噬菌体联合处理(BP):在对照组基础上添加生物质炭并接种噬菌体YSZ 5K。每隔3 d浇水,保持田间最大持水率的75%。每隔10 d,在生菜根部附近随机采集5个土样,共取样10 g土壤,混合均匀后,待测。并在第60天时采集新鲜生菜,去除根部附着土壤,在根与叶连接的成熟区剪断,于暗处4 ℃低温储藏[20]。
1.3 噬菌体疗法在土壤中灭活抗性致病细菌的效果
将土壤样品与100 ml无菌水混匀,振荡5 min,浸提10 min,取100 μl悬液稀释到适当浓度,并在LB平板上涂布计数,对K12和PAO1数量进行测定。
1.4 噬菌体疗法对土壤中抗性基因消减变化的研究
用土壤基因组DNA提取试剂盒(FastDNA® Spin Kit For Soil,货号:116560200)提取土壤基因组DNA,用微量分光光度计NanoDrop 测定提取的土壤DNA 的纯度(OD260/OD280在1.8 ~ 2.0之间)和浓度。用qPCR(StepOnePlusTM RealTime PCR system)对W、C基因进行丰度的定量分析(表1)。原始土壤中W、C检测为阴性。
1.5 噬菌体疗法对生菜中抗性致病细菌和抗性基因的影响
用激光扫描共聚焦显微镜(Zeiss LSM710),观测不同处理条件下,新鲜生菜根和叶片中K12和PAO1的赋存状态和定殖情况;取待测植物样品用无菌水漂洗3 ~ 4次,剪碎后放入盛有4 ml无菌水的研钵中充分研磨,静止后取上清,用细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit,货号:dp302-02)提取内生细菌总DNA,并用qPCR(StepOnePlusTM RealTime PCR system)对W、C基因丰度进行测定。

表1 抗性基因tetW和ampC的PCR 扩增引物序列
1.6 土壤微生物群落功能的多样性和稳定分析
将1.2中采集的土壤样品,进行微生物群落功能多样性和稳定性分析。土壤微生物群落功能多样性采用Biolog ECO测定法[21-22]。Biolog ECO微平板中多底物酶联反应采用每孔的平均吸光度值(average well color development,AWCD)来描述。

式中:C代表含底物试验孔的吸光值,代表不含底物对照孔的吸光值,31表示本试验中有31种碳源。土壤群落功能多样性采用培养Biolog ECO微平板孔中吸光值,计算土壤微生物群落功能多样性指数(Shannon指数()和Simpson指数())。
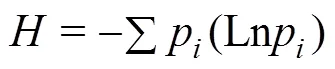
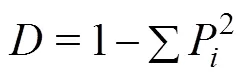
式中:p为第孔相对吸光值(-)与整个微平板相对吸光值总和(∑OD)的比率。
1.7 数据处理
所用数据均为3次重复采样的平均值,利用软件SPSS 21进行数据统计分析。图表采用Microsoft Excel 2016和软件OriginPro 9.0绘制。
2 结果与讨论
2.1 噬菌体疗法对土壤中抗性致病细菌的灭活效果
由于本研究所使用的K12和PAO1分别标记有稳定遗传的绿色荧光蛋白基因和红色荧光蛋白基因,因而采用平板涂布计数法,可对K12和PAO1数量动态变化规律进行监测。如图1所示,不同处理条件下,土壤中K12和PAO1消减程度从高到低顺序依次是:BP>P>B>CK,这可能是由于生物质炭是一种环境友好的土壤改良材料,已有较多研究表明添加生物质炭可以有效改善土壤益生菌群在总体土著菌群中的多样性、代谢活性和生态位比例[23-24]。因而相较于CK处理来说,单独添加生物质炭的B处理,土壤中K12和PAO1的数量得到显著抑制(<0.05)。另外,单独接种噬菌体的处理,第 60天时,土壤中K12和PAO1残留丰度分别为5.1×104cfu/g和5.63×104cfu/g,该结果直接验证了广宿主型噬菌体疗法在土壤中具有同步靶向灭活复合抗性致病细菌的能力;相较于单独添加生物质炭处理(B)或单独接种噬菌体处理(P),BP处理具有更为显著的协同灭活效果(<0.05),K12和PAO1的残留数量相较于原始接种量分别下降了2.5和2.1个数量级,分别仅为4.65×104cfu/g和5.15×104cfu/g。这可能是由于土壤中添加的生物质炭不仅可以通过吸附、阻隔作用主动持留一部分抗性致病细菌,同时生物质炭自身的多孔结构和富含养分元素也可以让抗性致病细菌在土壤微域环境形成相对密集的定殖区域,再加上外界的广宿主型噬菌体的引入,充分增加噬菌体接触到宿主致病细菌的概率,节约噬菌体寻找宿主时间和缩短噬菌体寻找宿主路径[25],这样更有利于噬菌体快速侵染并灭活复合致病细菌,达到消除风险的作用。
2.2 噬菌体疗法对土壤中ARGs丰度消减变化的影响
土壤中过量丰度ARGs存在,能通过食物链直接或间接传递作用增加人体获得抗生素抗性的风险,故而ARGs也被认为是一种新型环境生物大分子污染物。本研究同时关注不同处理条件对土壤中ARGs丰度消减的影响。从图2可以看出,各组处理下土壤中ARGs丰度的消减动态与K12和PAO1数量的消减动态接近一致。即:单独或同时添加生物质炭和接种噬菌体处理,对土壤中ARGs的消减有显著效果(<0.05);同时添加生物质炭和接种噬菌体处理(BP处理)对于深度消除土壤中ARGs具有显著的协同效应(<0.05),在BP处理下,土壤中ARGs消减最为显著,两种ARGs丰度下降幅度分别为2.2和3.2个数量级,其中W基因丰度由第1天的2.3×108copies/g下降到第60天的2.2×105copies/g,而C基因丰度由6.6×107copies/g下降到5.6×105copies/g。这可能是由于本研究检测到的土壤中关于四环素抗性的W基因都是存在于活体K12体内,而检测到的关于氯霉素抗性的C基因存在于活体PAO1体内,所以当不同处理条件对土壤中K12和PAO1的增殖活性产生显著抑制或者大幅度灭活残留数量后,相应ARGs丰度也随之减弱。

(CK:对照组;B:单独添加生物质炭处理;P:单独添加噬菌体处理;BP:生物质炭与噬菌体联用处理,下图同)

图2 污染土壤中抗性基因tetW与ampC的动态变化
2.3 生物质炭与噬菌体疗法联用追踪灭活生菜体内抗性致病细菌和抗性基因
ARB/ARGs从土壤向植物体内迁移富集的过程增加了人类在食物链上直接接触到抗性致病细菌的风险。为探究生物质炭与噬菌体疗法联用在污染土壤-生菜体系中的实际应用,本研究使用激光扫描共聚焦显微镜观测生菜根和叶片中K12和PAO1的赋存状态和定殖情况(图3)。由图3可知:不同处理条件下,根部中定殖残留的K12(绿点)与PAO1(红点)数量要显著高于叶片中残留的K12与PAO1数量(< 0.05);定殖的K12和PAO1主要分布和集中在植物真核细胞的间隙,尤其是较多地聚集在根部和叶片的气孔周围;不同处理条件对根叶中赋存K12和PAO1的影响具有一致的规律,即:根叶中赋存的K12和PAO1数量由高到低的顺序依次是:CK>B>P>BP。上述结果说明单独添加生物质炭可以有效降低K12和PAO1从土壤向生菜组织中的迁移富集;而单独接种噬菌体则是因为一方面高效靶向灭活了土壤中的K12和PAO1,另一方面也可能由于接种的噬菌体也具有自主的移动性,同样可以通过根系气孔或机械损伤部位迁移进入植物体内,从而深度追踪灭活生菜体内的复合致病细菌;对于BP处理来说,生物质炭在土壤中的协同阻控效应和噬菌体疗法靶向追踪灭活效应的叠加,更为直观地说明了该联合修复方法的高效。

图3 第60天时生菜根和叶中K12(绿点)和PAO1(红点)的丰度变化(40x/0.75)
进一步具体分析生菜组织中残留ARB和ARGs的情况,本研究对根叶中K12和PAO1进行了定量计数和ARGs荧光定量分析。第60天生菜收获后,根/叶鲜样中K12和PAO1的累计定殖总数量由高到低为:CK>B>P>BP(图4),与土壤中抗性细菌变化规律相似;单独或同时添加生物质炭和接种噬菌体,都可以显著消减生菜根叶中复合致病细菌的残留,并且赋存状态与图3中显微镜观测到的残留规律一致,其中BP处理最为显著(<0.05),残留在生菜根叶中的K12和PAO1累计总量分别下降到5.1×104、1.9×103cfu/g。根据这一规律深入分析第60天时不同处理条件对残留在根叶中ARGs丰度的变化(图5),发现:第60天时,CK处理下根和叶鲜样中W与C累计总丰度分别可以达到5.3×106、5.1×105copies/g;而在BP处理中,根叶中残留ARGs丰度消减最为显著(<0.05),W和C累计丰度较之CK下降了6.2和5.7个数量级,分别仅为4.3×103copies/g、1.8×102copies /g。上述结果综合证明了生物质炭阻控和噬菌体疗法靶向灭活的联合修复技术,可以靶向追踪消除土壤-生菜体系中K12和PAO1复合抗性致病细菌的残留滋生风险,是一种行之有效的风险消除技术。

图4 不同处理条件下生菜根(A)、叶(B)中K12和PAO1的赋存数量

图5 不同处理条件下生菜根(A)、叶(B)中tetW和ampC的残留丰度
2.4 噬菌体疗法对土壤微生物群落多样性的影响
噬菌体疗法在灭活土壤-生菜体系中抗性致病细菌的同时,可能对土壤中其他益生菌群或整体微生物群落结构和功能多样性造成一定程度的影响,因此进行土壤生态风险评估十分必要[26]。AWCD数值的变化表示土壤微生物整体代谢活性的波动;丰富度指数Shannon()反映的是群落的丰富度, 其值越小表示样性越低;优势度指数Simpson()反映土壤微生物群落常见种的优势度变化,数值越大其微生物多样性越低。第60天后不同处理下土壤Biolog ECO测定结果见表2。
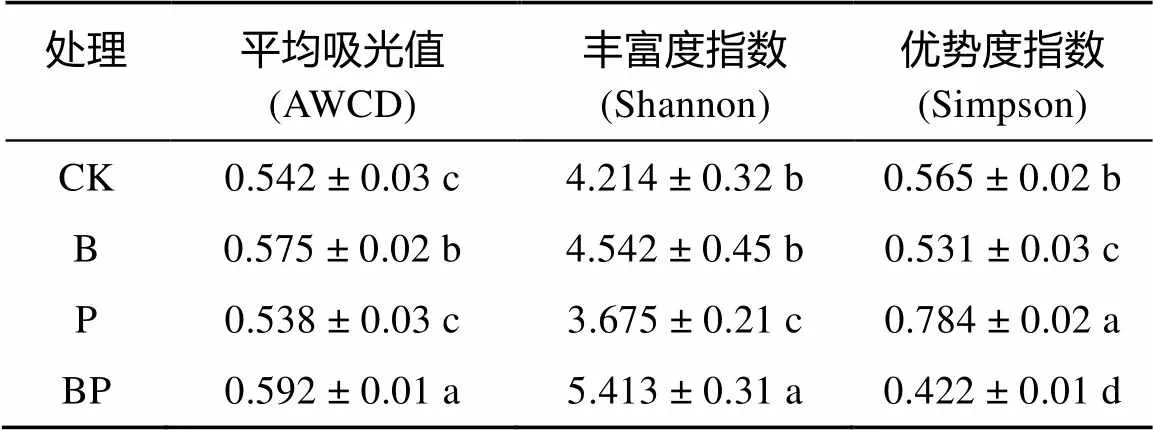
表2 不同处理方式土壤微生物群落功能多样性指数(第 60 天)
注:表中同列数据小写字母不同表示处理间差异显著(<0.05)。
AWCD值由高到低表现为BP>B>CK>P,而Shannon指数和Simpson指数也佐证了这一规律(表2),即:单独添加生物质炭对土壤微生物多样性有所增强,这可能是由于生物质炭是温和友好的土壤环境改良剂,可以大幅度改善土壤水热通气条件和养分循环周转过程,增强微生物活性,提高土壤微生物群落多样性;单独接种噬菌体后对土壤微生物多样性略有下降,这可能是由于接种的广宿主型噬菌体在进入实际土壤后为继续存活,拓宽了其捕食区间,从而对土壤细菌群落的多样性造成一定程度的减少;而同时添加生物质炭和接种噬菌体后土壤微生物多样性显著增强(<0.05),这可能是由于生物质炭能够同时吸附土著菌群和噬菌体,缩小噬菌体活动区间,提高其靶向灭活致病细菌的效率,进而增强生物质炭吸附效果,促进土壤中有益菌群的增长。这证明了生物质炭施用与噬菌体疗法联合使用对于维持土壤-生菜体系中细菌群落结构组成多样性具有良性贡献。上述结果共同证明施用生物质炭和接种噬菌体的联合技术对于同步维护土著微生物群落结构和功能稳定性具有积极的作用,可以大幅度消减噬菌体疗法在应用过程中对生态环境造成的潜在负面风险。
3 结论
本研究发现同时添加生物质炭和接种广宿主型噬菌体的联合方式,不仅可以高效广谱地阻控四环素抗性的K12和氯霉素抗性的PAO1从土壤向生菜体内迁移富集的过程,还可以靶向追踪灭活土壤-生菜体系中定殖的K12与PAO1及消减相应携带的ARGs丰度。此外,该联合修复方式对于维护土壤微生物群落结构组成多样性和功能稳定性也具有积极作用,是一种环境友好、生态安全的修复技术,可以为深度消除土壤-蔬菜系统中ARB和ARGs的扩散传播和定殖残留风险提供一种全新思路,具有广泛的应用前景。
[1] Zhu J C, Zhang Z Q, Fan Z M, et al. Biogas potential, cropland load and total amount control of animal manure in China[J]. Journal of Agro-Environment Science, 2014, 33(3): 435–444
[2] Sun M, Ye M, Schwab A P, et al. Human migration activities drive the fluctuation of ARGs: Case study of landfills in Nanjing, eastern China[J]. Journal of Hazardous Materials, 2016, 315: 93–101
[3] Gul S, Whalen J K, Thomas B W, et al. Physico-chemical properties and microbial responses in biochar-amended soils: Mechanisms and future directions[J]. Agriculture Ecosystems & Environment, 2015, 206: 46–59
[4] 周志强, 刘琛, 杨红薇, 等. 生物质炭对磺胺类抗生素在坡耕地紫色土中吸附-解吸及淋溶过程的影响[J]. 土壤, 2018, 50(2): 353–360
[5] Barancheshme F, Munir M. Strategies to combat antibiotic resistance in the wastewater treatment plants[J]. Frontiers in Microbiology, 2017, 8: 2603
[6] Ye M, Sun M, Feng Y, et al. Effect of biochar amendment on the control of soil sulfonamides, antibiotic-resistant bacteria, and gene enrichment in lettuce tissues[J]. Journal of Hazardous Materials, 2016, 309: 219–227
[7] Sharon I, Morowitz M J, Thomas B C, et al. Time series community genomics analysis reveals rapid shifts in bacterial species, strains, and phage during infant gut colonization[J]. Genome Research, 2013, 23(1): 111–120
[8] Roach D R, Debarbieux L. Phage therapy: Awakening a sleeping giant[J]. 2017, 1(1): 93–103
[9] Yu P, Mathieu J, Lu G W, et al. Control of antibiotic- resistant bacteria in activated sludge using polyvalent phages in conjunction with a production host[J]. Environmental Science & Technology Letters, 2017, 4(4): 137–142
[10] Sun M M, Ye M, Jiao W T, et al. Changes in tetracycline partitioning and bacteria/phage-cmediated ARGs in microplastic- contaminated greenhouse soil facilitated by sophorolipid[J]. Journal of Hazardous Materials, 2018, 345(5): 131–139
[11] Yu P, Mathieu J, Yu Y, et al. Suppression of enteric bacteria by bacteriophages: Importance of phage polyvalence in the presence of soil bacteria[J]. Environmental Science & Technology, 2017, 51(9): 5270
[12] Elshibiny A, Elsahhar S, Adel M. Phage applications for improving food safety and infection control in Egypt[J]. Journal of Applied Microbiology, 2017, 123(2): 556–567
[13] Zhao Y C, Ye M, Zhang X T, et al. Comparing polyvalent bacteriophage and bacteriophage cocktails for controlling antibiotic-resistant bacteria in soil-plant system[J]. Science of The Total Environment, 2019, 657: 918–925
[14] Champagne C P, Moineau S, Lafleur S, et al. The effect of bacteriophages on the acidification of a vegetable juice medium by microencapsulated Lactobacillus plantarum[J]. Food Microbiology, 2016, 63: 28–34
[15] Yu P, Mathieu J, Li M, et al. Isolation of polyvalent bacteriophages using sequential multiple host approaches[J]. Applied & Environmental Microbiology, 2015, 82(3): 808–915
[16] Hyman P, Abedon S T. Bacteriophage host range and bacterial resistance[J]. Advances in Applied Microbiology, 2010, 70: 217–248
[17] Alexa R, Samantha W, Paul H. More is better: Selecting for broad host range bacterio-phages bacteriophages[J]. Frontiers in Microbiology, 2016, 7: 1352
[18] 尹春艳, 骆永明, 滕应, 等. 典型设施菜地土壤抗生素污染特征与积累规律研究[J]. 环境科学, 2012, 33(8): 2810–2816
[19] 许燕萍, 谢祖彬, 朱建国, 等. 制炭温度对玉米和小麦生物质炭理化性质的影响[J]. 土壤, 2013, 45(1): 73–78
[20] Chen X, Pizzatti C, Bonaldi M, et al. Biological control of lettuce drop and host plant colonization by rhizospheric and endophytic streptomycetes[J]. Frontiers in Microbiology, 2016, 7: 714
[21] Wu M, Qin H, Chen Z, et al. Effect of long-term fertilization on bacterial composition in rice paddy soil[J]. Biology & Fertility of Soils, 2011, 47(4): 397–405
[22] Thingstad T F, Våge S, Storesund J E, et al. A theoretical analysis of how strain-specific viruses can control microbial species diversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(21): 7813–7818
[23] Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota–A review[J]. Soil Biology & Biochemistry, 2015, 43(9): 1812–1836
[24] 滕应, 骆永明, 李振高. 污染土壤的微生物多样性研究[J]. 土壤学报, 2006(6): 1018–1026
[25] Flores C O, Meyer J R, Valverde S, et al. PNAS plus: Statistical structure of host-phage interactions[J]. Proceedings of the National Academy of Science, 2011, 108(28): 288–297
[26] Gómez P, Bennie J, Gaston K J, et al. The impact of resource availability on bacterial resistance to phages in soil[J]. Plos One, 2015, 10(4): e0123752
Combined Biochar and Bacteriophage to Control and Inactivate Antibiotic Resistance Pathogenic Bacteria in Soil-Lettuce System
ZHAO Yuanchao1,2, YE Mao2*, SUN Mingming1, ZHANG Zhongyun2,HUANG Dan2,ZHU Guofan2,3, ZHENG Xiaoxuan1,CHAO Huizhen1, FENG Yanfang4, WU Jun1*,HU Feng1, JIANG Xin2
(1 College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China; 2 Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 3 School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China; 4 Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Ubiquitous existence of antibiotic resistant pathogens (ARP) in the agricultural land and vegetation system has posed great threat against public health and environmental safety, making it essential to develop targeted controlling technologies. In this work, biochar and bacteriophage combined technology was investigated for its effectiveness in targeted inactivating the ARP in the soil-lettuce system. Biochar and polyvalent phage YSZ 5K were applied to the ARP (tetracycline resistantK12 and chloramphenicol resistantPAO1) contaminated soil. The residual K12 and PAO1 counts and antibiotic resistance genes (W andC) abundances were determined after 60 days of incubation. The results showed that the combined technology was proved most effective, followed by sole application of biochar, sole inoculation of YSZ 5K, and the control. For the combined treatment, the counts of K12 / PAO1 decreased by 2.1–3.1 magnitudes and the abundances ofW/C decreased by 2.2–3.3 magnitudes in the soil and lettuce leaves, respectively. In addition, the structural and functioning diversity of soil microbial community was improved significantly after the combined treatment. The results obtained here demonstrate the combined application of biochar and polyvalent phage YSZ 5K an environmentally-friendly technology that could effectively decrease the ARP in the soil-lettuce system.
Soil-vegetable system; Biochar; Agricultural phage therapy; Antibiotic resistant pathogenic bacteria
国家重点研发计划项目(2018FYC1803100)、2017年度江苏省环保科研重点项目(2017005)、2017年江苏省农业科技自主创新资金项目(CX(17)3047)、国家自然科学基金面上项目(41771350)和中国科学院青年创新促进会项目(2018350)资助。
yemao@issas.ac.cn;wujun2013@njau.edu.cn)
赵远超(1993—),男,黑龙江齐齐哈尔人,硕士研究生,主要从事噬菌体分离纯化、定向进化及农业噬菌体疗法在抗性致病细菌污染土壤中的靶向灭活研究。E-mail: 2016103027@njau.edu.cn
S154.1;Q938.1+3
A
10.13758/j.cnki.tr.2019.05.014

