朱樱花组培快繁技术研究
谢云巧,宁玲,李小红,陈华飞,廖良宇,赵掛东
(云南农业大学热带作物学院,云南普洱 665000)
朱樱花(Calliandra haematocephalaHassk.)又名美蕊花、红合欢、红绒球,豆科含羞草亚科朱樱花属植物,具有固氮能力、耐贫瘠、耐干旱、管理要求低、生长速度快,是绿化造林、改善土壤、改善生态环境的重要树种;朱樱花的叶含有大量蛋白质,可作饲料;是紫胶虫的寄主树[1];是一种可食用花卉,树皮中含单宁,能促进消化道蠕动,改善便秘和食欲不振;具有很好的抗氧化性和抗炎作用[2]。朱樱花的繁殖方法主要是种子繁殖和扦插繁殖。种子繁殖历时长、处理过程繁琐;常规扦插繁殖的插条生根困难、生根率低[3]。该试验在有关合欢[4~10]、相思[11~14]等木本植物快繁技术的基础上,研究朱樱花组织培养。目前已有研究采用的外植体均来源于成年外植体进行组培,尚未见到有关采用朱花樱种子自然萌发的幼苗的茎段作为外植体进行组培的报道。朱樱花所采用的外植体易发生褐变,为防止褐变,笔者以自然条件下种子播种生长的籽苗茎段、幼苗茎段和嫩叶,成年植株茎段和嫩叶作外植体。应用朱樱花组培快繁技术有效的克服传统育苗缺陷,实现朱樱花的工厂化育苗、大力推广朱樱花种植。
1 材料与方法
1.1 外植体的选取部位
该试验外植体分别来自云南农业大学热带作物学院内3年生的朱樱花成株以及2019年3月播种的朱樱花幼苗。采集朱樱花幼嫩的带3~5个芽的茎尖、叶片、当年春播有2~3片真叶的幼苗。
1.2 试验方法
1.2.1 材料的预处理
将处理好的外殖体分别用自来水冲洗2次后用低浓度洗衣粉水洗1次,自来水冲洗3次;在超净工作台上用 75%酒精消毒 10s,0.1%升汞消毒 5~10min后用无菌水冲洗3次。将外植体分割成0.5cm长的带芽茎段和幼嫩的茎段后接种。以多年生嫩茎为外植体用 0.1%升汞分别消毒 8min、6min、5min,培养5d后进行褐化率、污染率对比。
1.2.2 试验设计
愈伤组织诱导、丛生芽诱导、分别采用设置10个处理、5个处理,每个处理8个重复的方法。即设置10种不同的培养基配方,每个配方接种8瓶,每瓶接种外植体3个。该试验培养基诱导愈伤组织、丛生芽诱导采用MS培养基,诱导生根采用1/2MS培养基。蔗糖浓度30g/L,琼脂浓度6g/L。
1.2.3 培养条件
置于温度(25±2)℃、光照强度1000~3000Lx、光照10h/d条件下培养。初代培养进行4d的暗培养后再进行光照培养。
2 结果与分析
2.1 褐化率、污染率的对比试验
由于朱樱花所采用的外植体易发生褐变,为防止褐变,笔者以自然条件下种子播种生长的籽苗茎段、多年生幼苗茎段和嫩叶作为外植体。采用75%酒精消毒10s和1%升汞不同的消毒时间来控制褐化率和污染率。表1说明,成年植株以带芽茎尖为外植体用75%酒精消毒10s+1%升汞消毒6min褐化率、污染率明显减少,而籽苗表现良好。在75%酒精消毒10s+1%升汞消毒8min、6min褐化率、污染率均为0%。
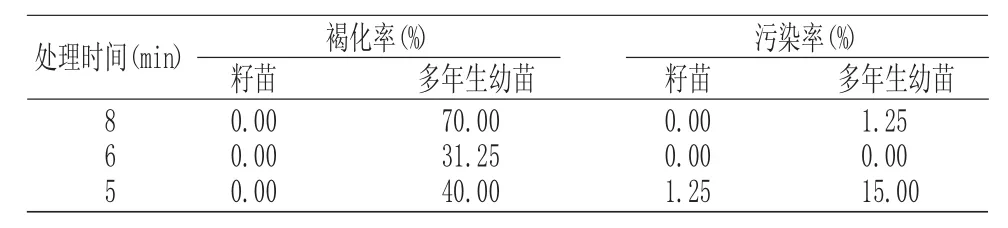
表1 1%升汞不同消毒时间对褐化污染的影响Tab.1 Effects of mercuric chloride different sterilizing time on the browning rate and pollution rate
2.2 愈伤组织诱导
2.2.1 多年生嫩茎愈伤组织诱导
多年生嫩茎接种30d后,进行愈伤组织统计。多年生嫩茎培养30d最佳的愈伤组织配方为BA1.5mg/L+NAA1.0mg/L,诱导率为87.5%。结果分析如表 2所示:
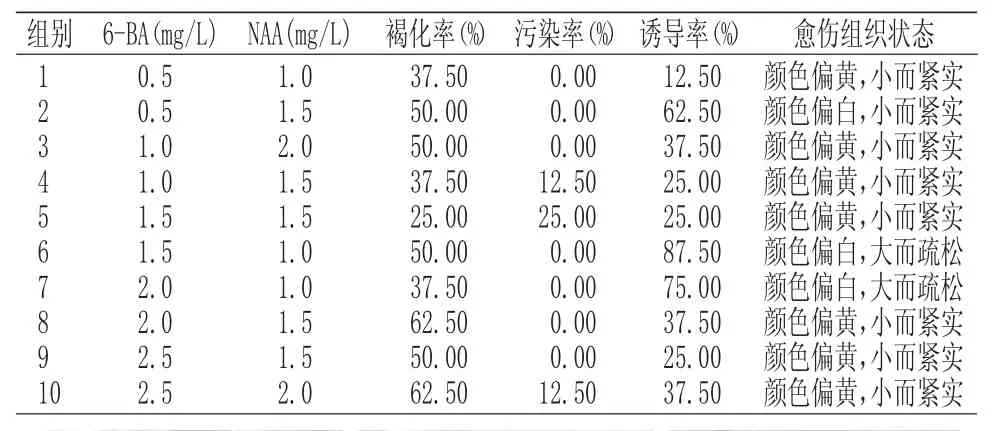
表2 多年生嫩茎愈伤组织诱导Tab.2 Callus induction of perennial young stem

图1 多年生嫩茎培养30d后产生的愈伤组织,愈伤组织颜色偏黄,小而紧实Fig.1 Callus produced by young perennial stems after 30 days of culture was yellowish,small and compact
图2 多年生嫩茎愈伤组织诱导Fig.2 Callus induction of perennial young stem
2.2.2 籽苗茎段、幼苗茎段和嫩叶愈伤组织诱导
籽苗茎段接种15d后,进行愈伤组织统计。愈伤组织最佳培养基配方为 BA1.0mg/L+NAA2.0mg/L,诱导率为100%。结果分析如表 3所示:
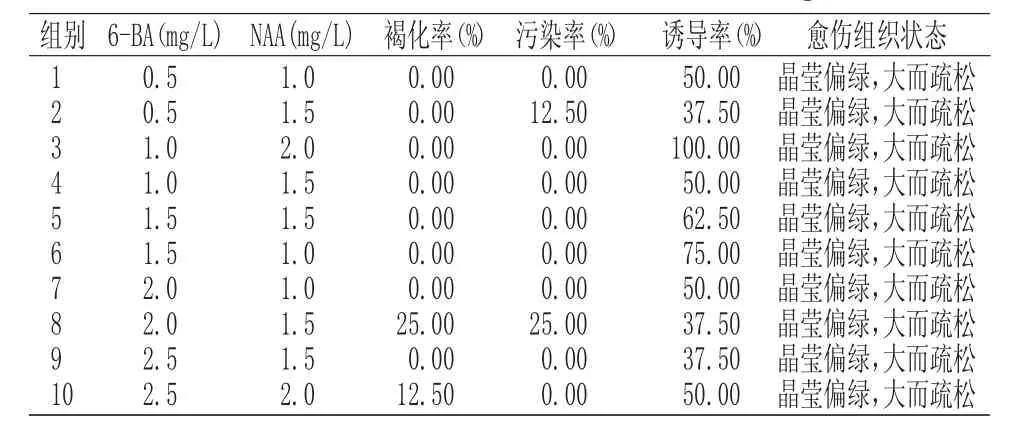
表3 新生幼苗愈伤组织诱导Tab.3 Callus induction of new seedlings

图3 籽苗培养15d产生的愈伤组织,颜色晶莹偏绿,大而疏松Fig.3 Callus produced after 15 days of seedling culture showed a greenish,large and loose color
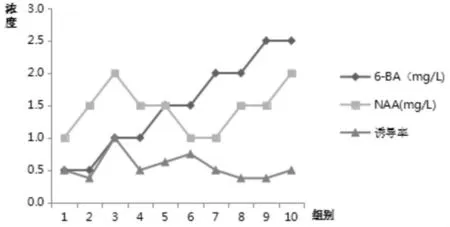
图4 新生幼苗愈伤组合诱导Fig.4 Callus induction of new seedlings
2.3 丛生芽诱导
2.3.1 多年生嫩茎愈伤组织诱导芽分化
多年生嫩茎产生的愈伤组织培养30d后没有芽的分化,丛生芽诱导率为0%。结果分析如表 4所示:
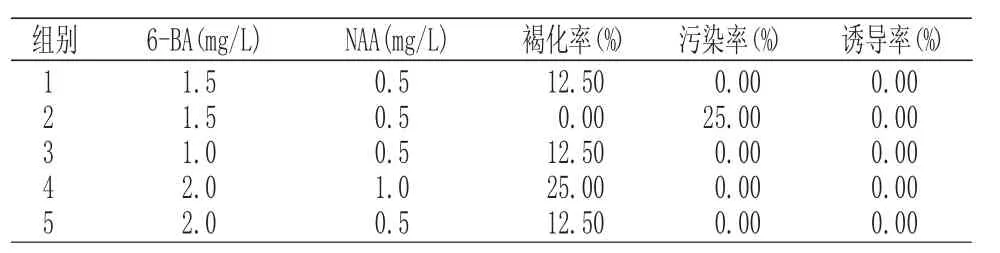
表4 多年生嫩茎愈伤组织诱导芽分化Tab.4 Callus induced bud differentiation in young perennial stems
2.3.2 幼苗愈伤组织诱导芽分化
在籽苗产生的愈伤组织的基础上进行丛生芽诱导,培养30d进行发芽数统计,最佳培养基配方为BA2.0mg/L+NAA1.5mg/L,诱导率为100%。结果分析如表5所示:
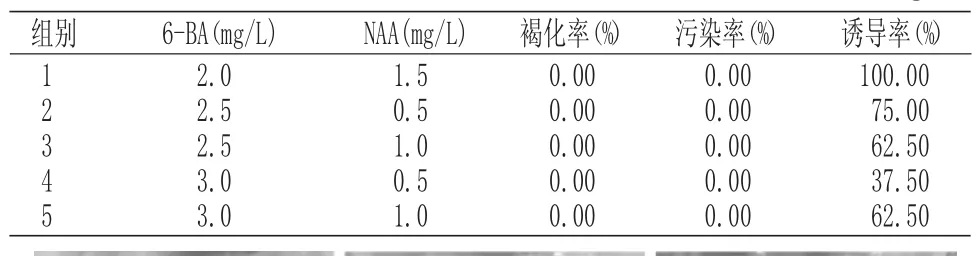
表5 新生幼苗愈伤组织诱导芽分化Tab.5 Callus induced bud differentiation in new seedlings

图5 新生幼苗产生培养诱导的不定芽,分芽点多,小芽多Fig.5 New seedlings produced cultured adventitious buds,with more bud points and more small buds

图6 新生幼苗愈伤组织诱导芽分化Fig.6 Callus induced differentiation in new seedlings
2.4 不定根诱导
将新生幼苗产生的不定芽转接到生根培养基中,在NAA0.5mg/L中进行生根。
3 结论与讨论
该试验采用朱樱花营养体器官即籽苗茎段,幼苗茎段和多年生春梢茎段作为研究的外植体。用籽苗和幼苗作为外植体不仅可以减少从朱樱花未成熟种子、成熟种子中剥离幼胚进行种子繁殖这一耗费劳力的过程,而且通过朱樱花快繁技术可以不受种子成熟程度、环境变化、天气等自然因素的影响[15],常年提供组培苗。就外植体的选择,愈伤组织和丛生苗的诱导、以及在组培过程中褐变的处理等进行了初步的研究,结果表明:消毒方法以多年生嫩茎为外植体用75%酒精消毒10s和1%升汞消毒6min,褐化率、污染率明显减少。筛选合适的基因型和外植体,从源头降低酚类物质的含量是组培褐变防治的重要手段[16~18]。朱樱花组织培养以籽苗作为外植体最好,愈伤组织诱导率高且不会褐化。愈伤组织最佳培养基配方为BA1.0mg/L+NAA2.0mg/L,在籽苗产生的愈伤组织的基础上进行丛生芽诱导,最佳培养基配方为BA2.0mg/L+NAA1.5mg/L。试验发现籽苗除根以外都可产生愈伤组织;多年生春梢茎段产生愈伤组织后不会再分化但愈伤组织会变得松软、易脱落直至死亡;多年生春梢茎段褐化现象只存在于第一次接种,转接后不会发生。本研究为朱樱花后续的进一步研究提供了一定参考。

